Espectroscopia ultravioleta-visible
La espectroscopia UV o espectrofotometría UV-visible ( UV-Vis o UV/Vis ) se refiere a la espectroscopia de absorción o espectroscopia de reflectancia en parte del ultravioleta y las regiones visibles adyacentes completas del espectro electromagnético . Siendo relativamente económica y fácil de implementar, esta metodología es ampliamente utilizada en diversas aplicaciones aplicadas y fundamentales. El único requisito es que la muestra absorba en la región UV-vis, es decir, que sea un cromóforo. La espectroscopia de absorción es complementaria a la espectroscopia de fluorescencia. Los parámetros de interés, además de la longitud de onda de medición, son la absorbancia (A) o la Transmitancia (%T) o la Reflectancia (%R), y su cambio con el tiempo. [1] [2]
La mayoría de las moléculas e iones absorben energía en el rango ultravioleta o visible, es decir, son cromóforos. El fotón absorbido excita un electrón en el cromóforo a orbitales moleculares de mayor energía, dando lugar a un estado excitado . [3] Para los cromóforos orgánicos, se asumen cuatro posibles tipos de transiciones: π–π*, n–π*, σ–σ* y n–σ*. Los complejos de metales de transición a menudo están coloreados (es decir, absorben luz visible) debido a la presencia de múltiples estados electrónicos asociados con orbitales d incompletos. [2]
La espectroscopia UV/Vis se utiliza habitualmente en química analítica para la determinación cuantitativa de diversos analitos o muestras, como iones de metales de transición , compuestos orgánicos altamente conjugados y macromoléculas biológicas. El análisis espectroscópico se lleva a cabo comúnmente en soluciones, pero también se pueden estudiar sólidos y gases.
La ley de Beer-Lambert establece que la absorbancia de una solución es directamente proporcional a la concentración de las especies absorbentes en la solución y la longitud del camino. [4] Por lo tanto, para una longitud de trayectoria fija, la espectroscopia UV/Vis se puede utilizar para determinar la concentración del absorbente en una solución. Es necesario saber qué tan rápido cambia la absorbancia con la concentración. Esto se puede tomar de las referencias (tablas de coeficientes de extinción molar ) o, más exactamente, determinarse a partir de una curva de calibración .
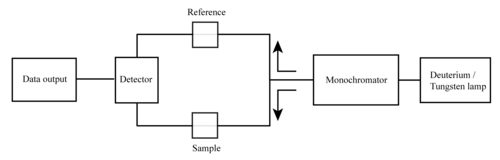
Se puede utilizar un espectrofotómetro UV/Vis como detector para HPLC . La presencia de un analito da una respuesta que se supone proporcional a la concentración. Para obtener resultados precisos, la respuesta del instrumento al analito en el desconocido debe compararse con la respuesta a un estándar; esto es muy similar al uso de curvas de calibración. La respuesta (p. ej., la altura del pico) para una concentración particular se conoce como factor de respuesta .
Las longitudes de onda de los picos de absorción se pueden correlacionar con los tipos de enlaces en una molécula dada y son valiosas para determinar los grupos funcionales dentro de una molécula. Las reglas de Woodward-Fieser , por ejemplo, son un conjunto de observaciones empíricas utilizadas para predecir λ max , la longitud de onda de la absorción UV/Vis más intensa, para compuestos orgánicos conjugados como dienos y cetonas .. Sin embargo, el espectro por sí solo no es una prueba específica para una muestra determinada. La naturaleza del solvente, el pH de la solución, la temperatura, las altas concentraciones de electrolitos y la presencia de sustancias que interfieren pueden influir en el espectro de absorción. Las variaciones experimentales como el ancho de la rendija (ancho de banda efectivo) del espectrofotómetro también alterarán el espectro. Para aplicar la espectroscopia UV/Vis al análisis, estas variables deben controlarse o contabilizarse para identificar las sustancias presentes. [5]

_nickel_(II)_chloride_UV-vis.JPG/440px-Bis(triphenylphosphine)_nickel_(II)_chloride_UV-vis.JPG)