| |||
| Nombres | |||
|---|---|---|---|
| Nombre IUPAC Tetrafluoruro de xenón | |||
| Identificadores | |||
Modelo 3D ( JSmol ) | |||
| ChemSpider | |||
| Tarjeta de información ECHA | 100.033.858 | ||
PubChem CID | |||
| UNII | |||
Tablero CompTox ( EPA ) | |||
| |||
| |||
| Propiedades | |||
| XeF 4 | |||
| Masa molar | 207,2836 g mol −1 | ||
| Apariencia | Blanco sólido | ||
| Densidad | 4.040 g cm −3 , sólido | ||
| Punto de fusion | 117 ° C (243 ° F; 390 K) sublima [1] | ||
| Reacciona | |||
| Estructura | |||
| D 4h | |||
| plano cuadrado | |||
| 0 D | |||
| Termoquímica | |||
Entropía molar estándar ( S | 146 J · mol −1 · K −1 [2] | ||
| −251 kJ · mol −1 [2] | |||
Salvo que se indique lo contrario, los datos se proporcionan para materiales en su estado estándar (a 25 ° C [77 ° F], 100 kPa). | |||
| Referencias de Infobox | |||
El tetrafluoruro de xenón es un compuesto químico con fórmula química XeF
4. Fue el primer compuesto binario descubierto de un gas noble . [3] Es producido por la reacción química del xenón con flúor , F
2, según la ecuación química : [4] [5]
- Xe + 2 F
2→ XeF
4
Esta reacción es exotérmica , liberando una energía de 251 kJ / mol. [3]
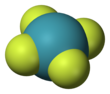
El tetrafluoruro de xenón es una sustancia cristalina incolora . Su estructura fue determinada por espectroscopia de RMN y cristalografía de rayos X en 1963. [6] [7] La estructura es cuadrada plana , como ha sido confirmado por estudios de difracción de neutrones , [8] Según la teoría VSEPR , además de cuatro fluoruros ligandos, el centro del xenón tiene dos pares de electrones solitarios. Estos pares solitarios son mutuamente trans.
Xenon tetrafluoruro sublima a una temperatura de 115,7 ° C .
Síntesis [ editar ]
El tetrafluoruro de xenón se produce calentando una mezcla de xenón y flúor en una proporción de 1: 5 en un recipiente de níquel a 400 ° C. Algo de hexafluoruro de xenón , XeF
6, también se produce, y esta producción se incrementa con una mayor concentración de flúor en la mezcla de entrada. [9] El níquel no es un catalizador de esta reacción; Los recipientes de níquel se utilizan porque reaccionan con el flúor para formar una capa protectora que no se despega de fluoruro de níquel (II) NiF
2 en sus superficies interiores.
Reacciones [ editar ]
El tetrafluoruro de xenón se hidroliza a bajas temperaturas para formar xenón elemental, oxígeno , ácido fluorhídrico y trióxido de xenón acuoso . [10]
La reacción con fluoruro de tetrametilamonio da pentafluoroxenato de tetrametilamonio , que contiene el pentagonal XeF-
5anión. El XeF-
5El anión también se forma por reacción con fluoruro de cesio : [11]
- CsF + XeF
4→ CsXeF
5
Reacción con pentafluoruro de bismuto ( BiF
5) forma el XeF+
3catión: [12]
- BiF
5+ XeF
4→ XeF 3 BiF 6
El XeF+
3El catión en la sal XeF 3 Sb 2 F 11 se ha caracterizado por espectroscopia de RMN. [13]
A 400 ° C, XeF
4reacciona con el xenón para formar XeF2: [9]
- XeF 4 + Xe → 2 XeF 2
La reacción de tetrafluoruro de xenón con platino produce tetrafluoruro de platino y xenón: [9]
- XeF 4 + Pt → PtF 4 + Xe
Aplicaciones [ editar ]
El tetrafluoruro de xenón tiene pocas aplicaciones. Se ha demostrado que degrada la goma de silicona para analizar trazas de impurezas metálicas en la goma. XeF
4reacciona con la silicona para formar productos gaseosos simples, dejando un residuo de impurezas metálicas. [14]
Referencias [ editar ]
- ^ Holleman, Arnold F .; Wiberg, Egon (2001). Wiberg, Nils (ed.). Química inorgánica . Traducido por Eagleson, Mary; Cervecero, William. Prensa académica. pag. 394. ISBN 0-12-352651-5.
- ↑ a b Zumdahl, Steven S. (2009). Principios químicos (6ª ed.). Compañía Houghton Mifflin. pag. A23. ISBN 0-618-94690-X.
- ↑ a b Zumdahl (2007). Química . Boston: Houghton Mifflin. pag. 243. ISBN 0-618-52844-X.
- ^ Claassen, HH; Selig, H .; Malm, JG (1962). "Tetrafluoruro de xenón". Mermelada. Chem. Soc. 84 (18): 3593. doi : 10.1021 / ja00877a042 .
- ^ Chernick, CL; Claassen, HH; Fields, PR; Hyman, HH; Malm, JG; Manning, WM; Matheson, MS; Quarterman, LA; Schreiner, F .; Selig, HH; Sheft, I .; Siegel, S .; Pereza, EN; Stein, L .; Studier, MH; Weeks, JL; Zirin, MH (1962). "Compuestos de flúor de xenón y radón". Ciencia . 138 (3537): 136-138. Código Bibliográfico : 1962Sci ... 138..136C . doi : 10.1126 / science.138.3537.136 . PMID 17818399 .
- ^ Brown, Thomas H .; Whipple, EB; Verdier, Peter H. (1963). "Tetrafluoruro de xenón: espectro de resonancia magnética de alta resolución de flúor-19". Ciencia . 140 (3563): 178. Bibcode : 1963Sci ... 140..178B . doi : 10.1126 / science.140.3563.178 . PMID 17819836 .
- ^ Ibers, James A .; Hamilton, Walter C. (1963). "Tetrafluoruro de xenón: estructura cristalina". Ciencia . 139 (3550): 106–107. Código Bibliográfico : 1963Sci ... 139..106I . doi : 10.1126 / science.139.3550.106 . PMID 17798707 .
- ^ Burns, John H .; Agron, PA; Levy, Henri A (1963). "Molécula de tetrafluoruro de xenón y su movimiento térmico: un estudio de difracción de neutrones". Ciencia . 139 (3560): 1208–1209. Código Bibliográfico : 1963Sci ... 139.1208B . doi : 10.1126 / science.139.3560.1208 . PMID 17757912 .
- ^ a b c Bard, Allen J .; Parsons, Roger; Jordán, José; Unión Internacional de Química Pura y Aplicada (1985). Potenciales estándar en solución acuosa . Prensa CRC. págs. 767–768 . ISBN 0-8247-7291-1.
- ^ Williamson; Koch, CW (marzo de 1963). "Tetrafluoruro de xenón: reacción con soluciones acuosas". Ciencia . 139 (3559): 1046–1047. Código Bibliográfico : 1963Sci ... 139.1046W . doi : 10.1126 / science.139.3559.1046 . ISSN 0036-8075 . PMID 17812981 .
- ^ Harding, Charlie; Johnson, David Arthur; Janes, Rob (2002). Elementos del bloque p . Mundo molecular. 9 . Real Sociedad de Química. pag. 93. ISBN 0-85404-690-9.
- ^ Suzuki, Hitomi; Matano, Yoshihiro (2001). Química del organobismuto . Elsevier. pag. 8. ISBN 0-444-20528-4.
- ^ Gillespie, RJ; Landa, B .; Schrobilgen, GJ (1971). "Trifluoroxenon (IV) µ -fluoro-bispentafluoroantimonate (V): el XeF+
3catión ". Revista de la Sociedad Química D: Chemical Communications (23): 1543-1544. doi : 10.1039 / C29710001543 . - ^ Rigin, V .; Skvortsov, NK; Rigin, VV (marzo de 1997). "Tetrafluoruro de xenón como agente de descomposición para caucho de silicona para aislamiento y determinación espectrométrica de emisión atómica de metales traza". Analytica Chimica Acta . 340 (1-3): 1-3. doi : 10.1016 / S0003-2670 (96) 00563-6 .
Enlaces externos [ editar ]
- Página de WebBook para XeF 4