 | |
 | |
| Datos clinicos | |
|---|---|
| Vías de administración | Oral, sublingual, insuflación, intravenosa |
| Código ATC |
|
| Estatus legal | |
| Estatus legal | |
| Datos farmacocinéticos | |
| Metabolismo | Hepático ( CYP muy involucrado) |
| Excreción | Renal |
| Identificadores | |
| |
| Número CAS | |
| PubChem CID | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| CHEMBL | |
| Tablero CompTox ( EPA ) | |
| Tarjeta de información ECHA | 100.230.706 |
| Datos químicos y físicos | |
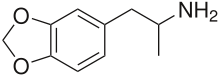
| Fórmula | C 10 H 13 N O 2 |
| Masa molar | 179,219 g · mol −1 |
| Modelo 3D ( JSmol ) | |
| |
| |
| | |
La 3,4-
La MDA rara vez se busca como droga recreativa en comparación con otras drogas de la familia de las anfetaminas; sin embargo, sigue siendo un fármaco importante y ampliamente utilizado debido a que es un metabolito primario, [1] producto de la N-desalquilación hepática, [2] de MDMA (éxtasis). Además, es común encontrar MDA como adulterante de MDMA producido ilícitamente. [3] [4]
Usos [ editar ]
Médico [ editar ]
Actualmente, la MDA no tiene un uso médico aceptado.
Recreativo [ editar ]
Aunque es ilegal, la MDA se compra, vende y usa como una 'droga del amor' recreativa, debido a que mejora el estado de ánimo y la empatía . [5] A veces se cita una dosis recreativa de MDA entre 100 y 160 mg. [6]
Efectos adversos [ editar ]
La MDA produce efectos neurotóxicos serotoninérgicos, [7] [8] que se cree que son activados por el metabolismo inicial de la MDA. [2] Además, MDA activa una respuesta de la neuroglia , aunque esta desaparece después de su uso. [7]
Sobredosis [ editar ]
Los síntomas de toxicidad aguda pueden incluir agitación , sudoración , aumento de la presión arterial y frecuencia cardíaca , aumento dramático de la temperatura corporal , convulsiones y muerte . La muerte suele ser causada por efectos cardíacos y hemorragia cerebral posterior ( accidente cerebrovascular ). [9] [ cita médica necesaria ]
Interacciones [ editar ]
Esta sección está vacía. Puede ayudar agregando más . ( Abril de 2017 ) |
Farmacología [ editar ]
Farmacodinámica [ editar ]
La MDA es un sustrato de los transportadores de serotonina , noradrenalina , dopamina y monoamina vesicular , así como un agonista de TAAR1 , [10] y por estas razones actúa como inhibidor de la recaptación y agente liberador de serotonina , noradrenalina y dopamina (es decir, es una SNDRA ). [11] También es un agonista de la serotonina 5-HT 2A , [12] 5-HT 2B , [13] y 5-HT 2C receptores [14] y programas de afinidad para la α 2A - , α 2B - , y α 2C receptores adrenérgicos y de serotonina 5-HT 1A y 5-HT 7 receptores . [15]
El isómero óptico ( S ) de MDA es más potente que el isómero óptico ( R ) como psicoestimulante y posee una mayor afinidad por los tres transportadores de monoamina .
En términos de los efectos subjetivos y conductuales de la MDA, se cree que la liberación de serotonina es necesaria por sus efectos empatógeno-entactógeno, la liberación de dopamina y noradrenalina es responsable de sus efectos psicoestimulantes, la liberación de dopamina es necesaria por su euforia ( gratificante y adictiva ). efectos, y el agonismo directo del receptor de serotonina 5-HT 2A es causante de sus efectos psicodélicos. [ cita médica necesaria ]
Farmacocinética [ editar ]
Se ha informado que la duración del fármaco es de aproximadamente 6 a 8 horas. [6]
Química [ editar ]
MDA es un derivado de fenetilamina y anfetamina metilendioxilada sustituida . En relación con otras fenetilaminas y anfetaminas, es el 3,4-metilendioxi, derivado α-metílico de β-feniletilamina , el derivado 3,4-metilendioxi de anfetamina y el derivado N - desmetílico de MDMA.
Sinónimos [ editar ]
Además de la 3,4-metilendioxianfetamina , la MDA también se conoce por otros sinónimos químicos como los siguientes:
- α-Metil-3,4-metilendioxi-β-feniletilamina
- 1- (3,4-Metilendioxifenil) -2-propanamina
- 1- (1,3-benzodioxol-5-il) -2-propanamina
Síntesis [ editar ]
La MDA se sintetiza típicamente a partir de aceites esenciales como el safrol o el piperonal . Los enfoques comunes de estos precursores incluyen:
- Reacción del grupo funcional alqueno de safrol con un ácido mineral que contiene halógeno seguido de alquilación de amina . [16] [17]
- Oxidación de Wacker de safrol para producir 3,4-metilendioxifenilpropan-2-ona (MDP2P) seguida de aminación reductora [17] [18] o mediante reducción de su oxima . [19]
- Reacción de Henry de piperonal con nitroetano seguida de reducción de compuestos nitro . [17] [20] [21] [22] [23]
- La reacción de Darzens sobre heliotropina también fue realizada por J. Elks, et al. [24] Esto da MDP2P , que luego se sometió a una reacción de Leuckart.
Detección en fluidos corporales [ editar ]
La MDA se puede cuantificar en sangre, plasma u orina para monitorear su uso, confirmar un diagnóstico de envenenamiento o ayudar en la investigación forense de un tráfico u otra infracción criminal o una muerte súbita. Algunos programas de detección de abuso de drogas se basan en el cabello, la saliva o el sudor como muestras. La mayoría de las pruebas de detección de inmunoensayo de anfetaminas comerciales tienen una reacción cruzada significativa con MDA y los principales metabolitos de MDMA, pero las técnicas cromatográficas pueden distinguir fácilmente y medir por separado cada una de estas sustancias. Las concentraciones de MDA en la sangre u orina de una persona que ha tomado solo MDMA son, en general, inferiores al 10% de las del fármaco original. [25] [26] [27]
Derivados [ editar ]
MDA constituye parte de la estructura central del agonista del receptor β-adrenérgico protokylol .
Historia [ editar ]
La MDA fue sintetizada por primera vez por C. Mannich y W. Jacobsohn en 1910. [19] Fue ingerida por primera vez en julio de 1930 por Gordon Alles, quien más tarde autorizó la droga a Smith, Kline & French . [28] La MDA se utilizó por primera vez en pruebas con animales en 1939, y las pruebas en humanos comenzaron en 1941 en la exploración de posibles terapias para la enfermedad de Parkinson . De 1949 a 1957, más de 500 sujetos humanos recibieron MDA en una investigación de su uso potencial como antidepresivo y / o anoréxico por Smith, Kline & French . El ejército de los Estados Unidostambién experimentó con la droga, cuyo nombre en código EA-1298, mientras trabajaba para desarrollar una droga de verdad o un agente incapacitante. Harold Blauer [29] murió en enero de 1953 después de que le inyectaran por vía intravenosa, sin su conocimiento o consentimiento, 450 mg de la droga como parte del Proyecto MKUltra . La MDA fue patentada como ataractica por Smith, Kline & French en 1960, y como anorexia bajo el nombre comercial "Amphedoxamine" en 1961. La MDA comenzó a aparecer en la escena de las drogas recreativas alrededor de 1963 a 1964. Entonces era barata y fácilmente disponible como producto químico de investigación de varias casas de suministros científicos. Varios investigadores, incluidosClaudio Naranjo y Richard Yensen , han explorado la MDA en el campo de la psicoterapia . [30] [31]
Sociedad y cultura [ editar ]
Nombre [ editar ]
Cuando la MDA estaba en desarrollo como un fármaco farmacéutico potencial, se le dio el nombre común internacional (DCI) de tenanfetamina .
Situación legal [ editar ]
Australia [ editar ]
La MDA es una sustancia prohibida de la Lista 9 según los Estándares de Venenos . [32] Una sustancia de la Lista 9 figura como "Sustancias que pueden ser objeto de abuso o mal uso, cuya fabricación, posesión, venta o uso debería estar prohibida por la ley, excepto cuando se requiera para investigación médica o científica, o para análisis, enseñanza o fines de capacitación con la aprobación de las Autoridades de Salud de la Commonwealth y / o del Estado o Territorio ". [32]
Estados Unidos [ editar ]
MDA es una sustancia controlada de Lista I en los EE. UU.
Investigación [ editar ]
En 2010, se estudió la capacidad de la MDA para invocar experiencias místicas y alterar la visión en voluntarios sanos. El estudio concluyó que MDA es una "herramienta potencial para investigar experiencias místicas y percepción visual []". [6]
Referencias [ editar ]
- ^ Crean, RD; Davis, SA; Von Huben, SN; Lay, CC; Katner, SN; Taffe, MA (13 de octubre de 2006). "Efectos de (±) 3,4-metilendioximetanfetamina, (±) 3,4-metilendioxianfetamina y metanfetamina sobre la temperatura y la actividad en macacos rhesus" . Neurociencia . 142 (2): 515-525. doi : 10.1016 / j.neuroscience.2006.06.033 . PMC 1853374 . PMID 16876329 .
- ^ a b de la Torre, R; Farre, M; Roset, Pn; Pizzaro, N; Abanades, S; Segura, M; Segura, M; Camí, J (2004). "Farmacología humana de MDMA: farmacocinética, metabolismo y disposición". Monitoreo de fármacos terapéuticos . 26 (2): 137-144. doi : 10.1097 / 00007691-200404000-00009 . PMID 15228154 .
- ^ EcstasyData.org. "EcstasyData.org: estadísticas de resultado de prueba: sustancias por año" . www.ecstasydata.org . Consultado el 27 de junio de 2017 .
- ^ "Información transeuropea sobre drogas" . idpc.net . Consultado el 27 de junio de 2017 .
- ^ Monte AP, Marona-Lewicka D, Cozzi NV, Nichols DE (1993). "Síntesis y examen farmacológico de benzofurano, indan y análogos de tetralina de 3,4- (metilendioxi) anfetamina". Revista de Química Medicinal . 36 (23): 3700-3706. doi : 10.1021 / jm00075a027 . PMID 8246240 .
- ^ a b c Baggott, MJ; Siegrist, JD; Galloway, GP; Robertson, LC; Coyle, JR; Mendelson, JE (2010). "Investigación de los mecanismos de visiones inducidas por alucinógenos con 3,4-metilendioxianfetamina (MDA): un ensayo controlado aleatorio en seres humanos" . PLOS ONE . 5 (12): e14074. doi : 10.1371 / journal.pone.0014074 . PMC 2996283 . PMID 21152030 .
- ^ a b Herndon, Joseph M .; Cholanianos, Aram B .; Lau, Serrine S .; Monks, Terrence J. (marzo de 2014). "Respuesta de la célula glial a 3,4- (±) -metilendioximetanfetamina y sus metabolitos" . Ciencias Toxicológicas . 138 (1): 130-138. doi : 10.1093 / toxsci / kft275 . ISSN 1096-6080 . PMC 3930364 . PMID 24299738 .
- ^ Kalant, Harold (2 de octubre de 2001). "La farmacología y toxicología del" éxtasis "(MDMA) y drogas relacionadas" . CMAJ: Revista de la Asociación Médica Canadiense . 165 (7): 917–928. ISSN 0820-3946 . PMC 81503 . PMID 11599334 .
- ^ Díaz, Jaime. Cómo influyen las drogas en el comportamiento. Acantilados de Englewood: Prentice Hall, 1996.
- ^ Lewin AH, Miller GM, Gilmour B (diciembre de 2011). "El receptor 1 asociado a trazas de amina es un sitio de unión estereoselectivo para compuestos de la clase de las anfetaminas" . Bioorg. Medicina. Chem . 19 (23): 7044–8. doi : 10.1016 / j.bmc.2011.10.007 . PMC 3236098 . PMID 22037049 .
- ^ Rothman RB, Baumann MH (2006). "Potencial terapéutico de los sustratos transportadores de monoaminas" . Curr Top Med Chem . 6 (17): 1845–59. doi : 10.2174 / 156802606778249766 . PMID 17017961 .
- ^ Giuseppe Di Giovanni; Vincenzo Di Matteo; Ennio Esposito (2008). Interacción serotonina-dopamina: evidencia experimental y relevancia terapéutica . Elsevier. págs. 294–. ISBN 978-0-444-53235-0.
- ^ Rothman, Richard B; Baumann, Michael H (2009). "Fármacos serotoninérgicos y valvulopatías" . Opinión de expertos sobre seguridad de los medicamentos . 8 (3): 317–329. doi : 10.1517 / 14740330902931524 . ISSN 1474-0338 . PMC 2695569 . PMID 19505264 .
- ^ Nash JF, Roth BL, Brodkin JD, Nichols DE, Gudelsky GA (1994). "Efecto de los isómeros R (-) y S (+) de MDA y MDMA sobre el recambio de fosfatidil inositol en células cultivadas que expresan receptores 5-HT2A o 5-HT2C". Neurosci. Lett . 177 (1–2): 111–5. doi : 10.1016 / 0304-3940 (94) 90057-4 . PMID 7824160 . S2CID 41352480 .
- ^ Manzoni, Olivier Jacques; Ray, Thomas S. (2010). "Psicodélicos y el receptor humano" . PLOS ONE . 5 (2): e9019. doi : 10.1371 / journal.pone.0009019 . ISSN 1932-6203 . PMC 2814854 . PMID 20126400 .
- ^ Muszynski, IE (1961). "Producción de algunos derivados de anfetaminas". Acta Poloniae Pharmaceutica . 18 : 471–478. PMID 14477621 .
- ^ a b c Shulgin, Alexander; Manning, Tania; Daley, Paul (2011). El índice de Shulgin, volumen uno: fenetilaminas psicodélicas y compuestos relacionados (1ª ed.). Berkeley, CA: Transform Press. pag. 165. ISBN 9780963009630.
- ^ Noggle, FT Jr; DeRuiter, J .; Largo, MJ. (1986). "Identificación espectrofotométrica y cromatográfica líquida de 3,4-metilendioxifenilisopropilamina y sus homólogos N-metilo y N-etilo". Revista Asociación de Químicos Analíticos Oficiales . 69 (4): 681–686. PMID 2875058 .
- ↑ a b Mannich, C .; Jacobsohn, W .; Mannich, Hr. C. (1910). "Über Oxifenil-alquilamina y Dioxifenil-alquilamina" . Berichte der Deutschen Chemischen Gesellschaft . 41 (1): 189-197. doi : 10.1002 / cber.19100430126 .
- ^ Ho, Beng-Thong; McIsaac, William M .; An, Rong; Tansey, L. Wayne; Walker, Kenneth E .; Englert Jr., Leo F .; Noel, Michael B. (1970). "Análogos de a-metilfenetilamina". Revista de Química Medicinal . 13 (1): 26–30. doi : 10.1021 / jm00295a007 . PMID 5412110 .
- ^ Butterick, John R .; Unrau, AM (1974). "Reducción de β-nitroestireno con dihidruro de bis- (2-metoxietoxi) -aluminio de sodio. Una ruta conveniente para fenilisopropilaminas sustituidas". Revista de la Sociedad Química, Comunicaciones químicas . 8 (8): 307–308. doi : 10.1039 / C39740000307 .
- ^ Toshitaka, Ohshita; Hiroaka, Ando (1992). "Síntesis de derivados de fenetilamina como alucinógenos" . Revista japonesa de toxicología y salud ambiental . 38 (6): 571–580. doi : 10.1248 / jhs1956.38.571 . Consultado el 20 de junio de 2014 .
- ^ Shulgin, Alexander y Shulgin, Ann (1991). PiHKAL: Una historia de amor química . Lafayette, CA: Transform Press. ISBN 9780963009609.
- ^ Alces, J .; Hola, DH (1943). "7. β-3: 4-Metilendioxifenilisopropilamina". J. Chem. Soc . 0 : 15-16. doi : 10.1039 / JR9430000015 . ISSN 0368-1769 .
- ^ Kolbrich EA, Goodwin RS, Gorelick DA, Hayes RJ, Stein EA, Huestis MA. Farmacocinética plasmática de la 3,4-metil
enedioximetanfetamina después de la administración oral controlada a adultos jóvenes. El r. Drug Monit. 30: 320–332, 2008. - ^ Barnes AJ, De Martinis BS, Gorelick DA, Goodwin RS, Kolbrich EA, Huestis MA (2009). "Disposición de MDMA y metabolitos en el sudor humano después de la administración controlada de MDMA" . Química clínica . 55 (3): 454–62. doi : 10.1373 / clinchem.2008.117093 . PMC 2669283 . PMID 19168553 .
- ^ R. Baselt, Disposición de fármacos y productos químicos tóxicos en el hombre , novena edición, Publicaciones biomédicas, Seal Beach, California, 2011, págs. 1078–1080.
- ^ "El primer viaje de MDA y la medición de 'experiencia mística' después de MDA, LSD y psilocibina" . Investigación psicodélica. 18 de julio de 2008. Archivado desde el original el 13 de julio de 2012.
- ^ El History Channel documentó los detalles de su muerte aquí https://www.youtube.com/watch?v=ySw-0uY4CUA Vea el minuto 2:38 en adelante.
- ↑ Naranjo, C .; Shulgin, AT; Sargent, T. (1967). "Evaluación de 3, 4-metilendioxianfetamina (MDA) como complemento de la psicoterapia". Farmacología . 17 (4): 359–364. doi : 10.1159 / 000137100 . PMID 5631047 .
- ^ Yensen, R .; Di Leo, FB; Rhead, JC; Richards, WA; Soskin, RA; Turek, B .; Kurland, AA (1976). "Psicoterapia asistida por MDA con pacientes ambulatorios neuróticos: un estudio piloto". The Journal of Nervous and Mental Disease . 163 (4): 233–245. doi : 10.1097 / 00005053-197610000-00002 . PMID 972325 . S2CID 41155810 .
- ^ a b Estándar de venenos (octubre de 2015) comlaw.gov.au
Enlaces externos [ editar ]
- Bóveda Erowid MDA
- Entrada MDA en PiHKAL
- Entrada MDA en PiHKAL • info