 | |
 | |
| Nombres | |
|---|---|
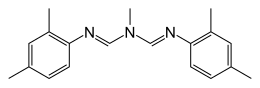
| Nombre IUPAC N , N ' - [(Metilimino) dimetilidina] di-2,4-xilidina | |
| Identificadores | |
Modelo 3D ( JSmol ) | |
| CHEBI | |
| CHEMBL | |
| ChemSpider | |
| Tarjeta de información ECHA | 100.046.691 |
| KEGG | |
PubChem CID | |
| UNII | |
Tablero CompTox ( EPA ) | |
| |
| |
| Propiedades | |
| C 19 H 23 N 3 | |
| Masa molar | 293,41 g / mol |
| Punto de fusion | 86 a 87 ° C (187 a 189 ° F; 359 a 360 K) |
| Insoluble | |
| Presión de vapor | 2,6 x 10 −6 mmHg |
| Farmacología | |
| QP53AD01 ( OMS ) | |
Salvo que se indique lo contrario, los datos se proporcionan para materiales en su estado estándar (a 25 ° C [77 ° F], 100 kPa). | |
| Referencias de Infobox | |
Amitraz (código de desarrollo BTS27419) es un acaricida e insecticida no sistémico [1] y también se ha descrito como escabicida . Fue sintetizado por primera vez por Boots Co. en Inglaterra en 1969. [2] Se ha descubierto que Amitraz tiene un efecto repelente de insectos, funciona como insecticida y también como sinergista de pesticidas . [3] Su eficacia se remonta a la actividad agonista alfa-adrenérgica , la interacción con los receptores de octopamina del sistema nervioso central y la inhibición de la síntesis de monoamino oxidasas y prostaglandinas . [4] Por lo tanto, conduce a la sobreexcitación y, en consecuencia, a la parálisis y muerte de los insectos. Debido a que el amitraz es menos dañino para los mamíferos, el amitraz es, entre muchos otros propósitos, mejor conocido como insecticida contra la infestación de perros por ácaros o garrapatas. [1] También se usa ampliamente en la industria apícola como control del ácaro Varroa destructor , aunque hay informes recientes de resistencia (impulsada por el uso excesivo y el uso no indicado en la etiqueta). [ cita requerida ]
Utilice [ editar ]
El amitraz es particularmente eficaz contra los ácaros , [5] pero se utiliza como pesticida en muchos campos diferentes. Por lo tanto, el amitraz está disponible en muchas formas diferentes, como un polvo humectable, un concentrado emulsionable, un concentrado / líquido soluble y un collar impregnado (para perros). [6] Se caracteriza por ser un sinergista repelente de insectos, insecticida y pesticida . Estas son las propiedades que lo hacen especialmente útil como plaguicida : [4]
- El efecto repelente hace que los insectos se alejen de su objetivo, ya que este se trata con amitraz. [4]
- Actúa como insecticida , lo que significa que puede usarse para controlar insectos que son directa o indirectamente dañinos para el hombre. [4]
- Como sinergista de plaguicidas , también aumenta el efecto de algunos otros plaguicidas si se combinan con amitraz. [4]
Estos pueden rastrearse hasta los mecanismos de acción, que conducen a un amplio campo de efectos, incluida la letalidad directa , los efectos conductuales excitantes-repelentes y la quimioesterilización para las especies de destino. [7] Además, generalmente causa poco daño a especies no objetivo, lo cual es una de las ventajas del amitraz. Además, el amitraz es especialmente eficaz contra insectos como la araña roja y las garrapatas en sus formas juveniles y resistentes. [7] Con fines agrícolas, el amitraz se utiliza principalmente para controlar la psila de la pera (Cacopsylla pyricola) en los cultivos de pera de Oregón y la mosca blanca y los ácaros en los cultivos de algodón o pera.[6] También se aplica a frutas de pepita, cítricos, algodón, frutas de hueso, frutas de arbusto, fresas, lúpulos, cucurbitáceas, berenjenas, pimientos, tomates y plantas ornamentales para controlar todas las etapas de tetraníquidos y ácaros eriófidos, chupones de peras, cochinillas. , cochinillas , moscas blancas , pulgones y huevos y larvas de primer estadio de lepidópteros . [1] Para aplicar amitraz, se pueden utilizar varias técnicas, como un chorro de aire y un spray concentrado a las peras o mediante una barrera terrestre y un avión al algodón. [8] Las diferencias territoriales en el uso de amitraz dependen de las especies de ácaros que infestan los cultivos / árboles / etc., la práctica local y el número y tamaño de los perales. Una infestación, por ejemplo, por Tetranychus spp.requiere tasas más altas de amitraz. Teniendo en cuenta estos factores, los volúmenes de aplicación de amitraz se han estandarizado en términos de concentración máxima de pulverización y en la tasa de amitraz por hectárea. [6]
Además de su aplicación como plaguicida en plantas, el amitraz también se utiliza como ectoparasiticida animal en bovinos, caprinos, ovinos, porcinos y caninos. [1] En estas aplicaciones, se aplica exclusivamente de forma externa. [9] Alcanza una eficacia especial contra los ácaros (en primer lugar Demodex canis ), pero también actúa contra los piojos , las moscas y todas las etapas de desarrollo de las garrapatas . [1] [9] [10] En combinación con agentes adicionales, también se puede usar contra la infestación por pulgas. [9] [10]Para el tratamiento de perros, el amitraz está disponible como collar o como solución en aerosol o de lavado y tiene un efecto inmediato contra la infestación por garrapatas, así como un efecto preventivo. En algunos países, las emulsiones de amitraz también se aplican para tratar la demodicosis de gatos o perros, una infestación excesiva de ácaros de la familia Demodicidae. [9] [10] Para el tratamiento de ganado bovino, ovino, caprino y porcino, el amitraz está disponible en forma de spray o solución de lavado para tratar o prevenir infestaciones por ácaros, piojos, moscas y garrapatas. Por lo tanto, los cerdos y el ganado deben ser fumigados y las ovejas y las cabras deben bañarse. [10] Otras especies animales - caballos o chihuahuas, por ejemplo - no deben tratarse con amitraz porque pueden ocurrir efectos adversos. [9] [10]
Efectos adversos [ editar ]
Los efectos adversos en los mamíferos son causados por la actividad agonista alfa-adrenérgica del amitraz. Los síntomas pueden incluir presión arterial baja y pulso, hipotermia, letargo, falta de apetito, vómitos, aumento de azúcar en sangre y problemas digestivos. [9] [10] [11] Además, en los perros pueden producirse irritaciones de la piel o de las mucosas como respuesta a un collar que contiene amitraz. Esto puede provocar picazón, eccema, alopecia o conjuntivitis . [9] [11]
Toxicidad [ editar ]
Toxicidad humana [ editar ]
En 2006, la Agencia de Protección Ambiental de los Estados Unidos ( USEPA ) reevaluó la clasificación de amitraz a un descriptor no cuantificable de "Evidencia sugestiva de carcinogenicidad ", y en 2013 determinó que la cuantificación del riesgo utilizando un enfoque no lineal para amitraz tendrá en cuenta adecuadamente para toda la toxicidad crónica, incluida la carcinogenicidad, que podría resultar de la exposición al amitraz y sus metabolitos. [12] La exposición accidental de los hombres a mayores cantidades de amitraz puede provocar la muerte por insuficiencia respiratoria, principalmente después de la ingestión o inhalación. En Turquía, durante 1989, se detectaron 41 casos de intoxicaciones mortales por amitraz. [13]La dosis tóxica observada en aproximadamente el 50% de estos pacientes ha sido de 0,3 ga 1,25 g de formulaciones de amitraz al 12,5% y de 0,5 a 2 g de formulaciones al 20%. Los pacientes restantes tomaron dosis de hasta 10 g. [3] Otros síntomas frecuentes después de una intoxicación masiva por amitraz son depresión del SNC , depresión respiratoria , miosis , hipotermia , hiperglucemia , pérdida del conocimiento, vómitos y bradicardia . [3]
Tratamiento [ editar ]
En caso de sobredosis de amitraz en seres humanos , se puede utilizar como antídoto atipamezol o yohimbina , que actúan como antagonistas α2. [3] [14] Inicialmente, es importante sacar al paciente del área contaminada con amitraz. Cuando se ha inhalado amitraz, el paciente primero debe recibir protección respiratoria. Además, el paciente debe recibir 4 L de oxígeno por minuto. [3] [14] En caso de intoxicación por contacto con la piel, primero se debe quitar la ropa contaminada. Las áreas afectadas deben lavarse con agua. Si los ojos han estado expuestos al amitraz, se debe administrar anestesia y lavarlos cuidadosamente. [3] [14] Después de la ingesta oral de amitraz, es importante hacer que el paciente beba aprox. 0,3 L de agua para reducir el efecto irritante del amitraz en el esófago. [14] Además, es importante evitar en la mayor medida posible que el paciente vomite, para reducir el riesgo de una mayor aspiración de amitraz. [14] Posteriormente, el paciente debe ser observado durante al menos 24 horas para asegurarse de que los síntomas no vuelvan a aparecer. [3]
Toxicidad no humana [ editar ]
| Especies | Método de administración | Dosis [15] [16] |
|---|---|---|
| Rata | oral | 400 mg / kg |
| dérmico | > 1600 mg / kg | |
| intraperitoneal | 800 mg / kg | |
| Ratón | oral | 1600 mg / kg |
| intraperitoneal | > 100 mg / kg | |
| Conejo | oral | > 100 mg / kg |
| dérmico | > 200 mg / kg | |
| Babuino | oral | 150-250 mg / kg |
| Perro | oral | 100 mg / kg |
| conejillo de indias | oral | 400 a 800 mg / kg |
Síntesis [ editar ]
Desde su descubrimiento por Boots Co. en 1969, se han desarrollado tres rutas principales de síntesis para el amitraz, que se destacan en términos de facilidad y generalidad. [7]
Ruta 1: 2,4-xilidina + ortoformiato de trietilo + metilamina (formación de imina / formación de amina): [17]
Una de las primeras plantas de fabricación de amitraz utilizó este esquema de reacción (figura 1). [5] Por tanto, las reacciones se han llevado a cabo en un recinto cerrado, para reciclar los reactivos no utilizados. [5] El primer paso de esta ruta es la reacción de una anilina con ortoformiato de trietilo . En la planta de fabricación mencionada se ha utilizado 2,4-xilidina como anilina . [7] La reacción produce un éster de formimidato intermedio. [5] [7] En el siguiente paso se agrega metilamina , que se combina con el éster de formimidato para producir la formamidina deseada. [5] [7] A medida que se forman las formamidinas, el etanol se libera de la reacción química y se recicla. [5] Este es probablemente el método más adecuado para la síntesis de amitraz, porque este segundo paso produce N ' -2,4-dimetil- N -metilformamidina. Los grupos -NH libres de estas moléculas reaccionan entre sí para finalmente producir amitraz. [5] Los últimos pasos del proceso de fabricación incluyen la cristalización del alcohol isopropílico , el filtrado y el secado. Estos últimos pasos deben ser realizados por personal capacitado, que use ropa protectora completa con un equipo de respiración de presión positiva. [5] [7]
Ruta 2: formamida sustituida + anilina :
El primer paso de esta ruta de síntesis a una N-arilformamidina como amitraz es la reacción de una formamida sustituida , generalmente una dialquilformamida, con una anilina . [6] Para obtener amitraz, se puede usar N-metil formamida y clorhidrato de 2,4 dimetil anilina (figura 2). Esta reacción es catalizada por la presencia de haluros de ácido, como POCl 3 , SOCl 2 , COCl 2 o un haluro de arilsulfonilo, como cloruro de p-toluenosulfonilo (figura 2). [7] [18] Esto produce un intermedio, que reacciona además como catalizado por el ácido p-tolueno a N, N '- [(metilimino) dimetilidina] di-2,4-xilidina (amitraz). [18] Alternativamente, la anilina en el primer paso se puede reemplazar por una arilformamida. Además, puede usarse la sustitución de la dialquilformamida por una N -alquilpirrolidona para obtener productos del grupo clenpirina a partir de esta reacción. [7]
ruta 3: arilisocianato + formamida:
Para lograr esta reacción una mezcla de un arilisocianato y adecuado formamida se calienta y marcados por la evolución de CO 2 , para producir el formamidina deseado.
Metabolismo [ editar ]
Dado que el uso más común del amitraz es como pesticida , es importante considerar que entre animales y plantas a menudo ocurren diferentes vías de biotransformación . La mayoría de las especies animales, incluidos los humanos, pueden metabolizar el amitraz rápidamente para formar seis metabolitos durante la biotransformación , N -metil- N ′ - (2,4-xilil) formamida, Forma- 2'4'xilidina, 4-N-Metil-formidoil) amino -ácido meta-toluix, ácido 4-formamido-meta-toluico, ácido 4- acetamido-meta-toluico y ácido 4- amino-meta-toluico. [19] [20] [21]
En ratas, la vía metabólica (figura 3) se ha examinado después de la administración oral de amitraz marcado con 14C, que se metaboliza, degrada y excreta eficazmente a cuatro de los metabolitos en la orina y seis en las heces. [20] La vía metabólica o la tasa no difirió entre los sexos.
Hornish y Nappier (1983) [ se necesita cita completa ] detectaron que la vía metabólica después de la administración dérmica sigue la misma ruta de degradación que después de la absorción oral, porque el compuesto original, N-metil-N '- (2,4-xilil) formamidina y forma-2 ', 4'-xilidida se encontraron en orina y sangre también después de la administración dérmica. [20] En los seres humanos, N- metil- N- (2,4-xilil) formamidina, form-2 ', 4'-xilidida, ácido 4-amino-meta-toluico, 4-acetamido-meta-toluico y 4- Los ácidos formamido-meta-toluicos también se reconocieron en la orina, lo que indica la misma vía metabólica o una similar. [21]
Como se ilustra en la figura 3, el primer paso es una reacción de hidrólisis a N-metil-N '- (2,4-xilil) -formamidina, que ya puede excretarse en la orina pero sigue siendo farmacológicamente activa. [20] [21] Dependiendo de la dosis, la cantidad de este metabolito en la orina puede variar del 4% en dosis bajas al 23% -38% en dosis altas (p. Ej., En el caso de ratas: 1-100 mg por kg de cuerpo peso). [20] Como no se excreta, también se puede oxidar a ácido 4-N-metil-formidoil) amino-meta-toluico, que se puede oxidar más a ácido 4-formamido-meta-toluico. [20] La forma 2,4-xilidina se forma directamente por hidrólisis a partir de amitraz o surge de N-metil-N '- (2,4-xilil) formamidina. [21] Durante esta etapa temprana debiotransformación La N-metil-N '- (2,4-xilil) formamidina y la Forma-2,4-xilidina ya pueden formar conjugados. [20] Pero la ruta principal seguida después de la formación de la Forma-2,4-xilidina es la oxidación a ácido 4-formamido-meta-toluico, que se metaboliza más a su conjugado acetilo, ácido 4-acetamido-meta-toluico o Ácido 4-amino-meta-toluico. [20] [21] El ácido 4-formamido-meta-toluico y el ácido 4-acetamido-meta-toluico constituyen el 32% de los metabolitos que se encuentran en la orina y se detectan con cualquier dosis administrada. Por lo tanto, se consideran dos de los principales metabolitos de la vía del amitraz. [20] La forma-2 ', 4'-xilidida y el ácido 4-amino-meta-toluico representan solo el 2% de la excreción total. [20]En los insectos se forman diferentes metabolitos. Se producen N-metil-N '- (2,4-xilil) formamidina, Forma-2,4-xilidina y ácido 4-amino-meta-toluico, pero además se detectaron varios metabolitos no identificados. [21]
En las plantas, la biotransformación del amitraz avanza muy rápidamente. Los metabolitos predominantes detectados son N- (2,4-dimetilfenil) -N'-metilformamidina (BST 27 271) y 2,4-dimetilformanilida (BST 27 919). [8]
N- (2,4-dimetilfenil) -N'-metilformamidina (BST 27 271), 2,4-dimetilformanilida (BST 27 919) y N, N'-bis-dimetilfenilformamidina (BTS 28 037) resultan de la hidrólisis de amitraz. Por tanto, la N- (2,4-dimetilfenil) -N'-metilformamidina (BST 27 271) se produce en cantidades superiores a la 2,4-dimetilformanilida (BST 27 919). La N- (2,4-dimetilfenil) -N'-metilformamidina (BST 27 271) se puede metabolizar adicionalmente a 2,4-dimetilformanilida (BST 27 919) o 2,4-dimetilanilina (BTS 24 868). [8]
La N, N'-bis-dimetilfenilformamidina (BTS 28 037) se puede transformar en 2,4-dimetilformanilida (BST 27 919) o reaccionar directamente con 2,4-dimetilanilina (BTS 24 868), pero los mecanismos exactos de estas biotransformaciones son aún no se sabe. [8] Sin embargo, de 2,4-dimetilanilina (BTS 24 868) y N, N'-bis-dimetilfenilformamidina (BTS 28 037) se ha contabilizado menos del 1%, lo que los convierte en metabolitos menores en comparación con N- (2, 4-dimetilfenil) -N'-metilformamidina (BST 27 271) y 2,4-dimetilformanilida (BST 27 919). [8] La Figura 4 muestra la ruta metabólica sugerida del amitraz en las plantas. [8]
Cinética [ editar ]
Las reacciones de hidrólisis del amitraz dependen en gran medida del pH ambiental. Aunque el amitraz se somete a reacciones de hidrólisis a cualquier pH, los estudios de espectrofotometría , HPLC y GC-MS revelaron que se producen diferencias en función del pH, que afectan tanto al tipo de productos de reacción como a la velocidad de reacción. [1] [22] En condiciones básicas (pH> 6), el amitraz se metaboliza a 2,4-dimetilfenilformamida. Seguido de hidrólisis a 2,4-dimetilanilina, que también se beneficia de un pH básico. [1] [22] A pH muy ácido (pH <3), se ha observado que la 2,4-dimetilanilina es el principal producto de degradación. En condiciones menos ácidas (pH 3-6), se producen principalmente N- (2,4-dimetilfenil) -N'-metilformamidina y ya se producen cantidades de 2,4-dimetilfenilformamida. [1]
Mecanismo de acción [ editar ]
Amitraz se usa como pesticida . Por lo tanto, la exposición de seres humanos al amitraz ocurre principalmente por inhalación o contacto dérmico con el compuesto durante su uso o producción. [13] Los efectos tóxicos para los seres humanos que siguen a la absorción de amitraz incluyen pérdida del conocimiento, vómitos, insuficiencia respiratoria, miosis , hipotermia , bradicardia , hiperglucemia y depresión del sistema nervioso central . [4]
La actividad farmacológica del amitraz incluye diferentes mecanismos de acción que producen efectos tóxicos tanto en humanos como en animales. Muchos de estos efectos y la mayoría de los efectos en humanos son causados por su actividad agonista alfa-adrenérgica . [4] Además, el amitraz inhibe la síntesis de prostaglandinas , interactúa con los receptores de octopamina del sistema nervioso central e inhibe las monoamino oxidasas . [4]
Los estudios en animales revelaron que los daños debidos a la intoxicación por amitraz se pueden recuperar incluso después de la exposición a una dosis potencialmente letal . Esto podría significar que los efectos del amitraz son reversibles o al menos recuperables. [23] Cuando una intoxicación por amitraz es letal, la muerte es el resultado de una depresión respiratoria. [23]
Actividad agonista alfa-adrenérgica [ editar ]
Amitraz es un agonista central de los receptores alfa adrenérgicos. [13] Eso significa que estimula selectivamente los receptores alfa adrenérgicos , que son receptores metabotrópicos acoplados a proteína G, que generalmente son el objetivo de las catecolaminas . La estimulación de estos receptores es en gran medida la razón de los efectos neurotóxicos y preconvulsivos del amitraz. [24] El xileno presente en las formulaciones de amitraz además induce depresión del sistema nervioso central . [4] Los receptores adrenérgicos se pueden dividir en dos subclases, receptores adrenérgicos alfa1 y alfa2. Para determinar si el amitraz interactúa con la subclase 1 o la subclase 2, se administraron inyecciones subcutáneas de amitraz (0,3 a 3,0 mg / kg) a ratones.[25] En consecuencia, seproduceun retraso deltránsito gastrointestinal dependiente de la dosisen ratones conscientes. Este efecto podría ser antagonizado por agentes bloqueantes alfa2-adrenérgicos, pero la administración de otros antagonistas no redujo el efecto depresor sobre eltránsito gastrointestinal . [25] Por lo tanto, se sugiere que el retraso deltránsito gastrointestinal inducido por amitrazestá mediado por receptores adrenérgicos alfa2 posuncionales y parece no implicar la activación de adrenérgicos β, dopaminérgicos , serotoninérgicos , histaminérgicos , colinérgicos , GABAérgicos oopioid receptors.[25]Besides the neurotoxic effects other clinical effects observed in amitraz poisoning are related to alpha2-adrenergic agonistic activity.[3] Adrenergic receptors are present in many different cells. The activation of these receptors by an agonist as amitraz generally induces a sympathetic response. This leads to an increased heart rate, dilation of the pupils, elevation of blood pressure and blood and energy supply focus on skeletal muscles.[13]
Interaction with the octopamine receptor[edit]
It's thought that the mode of action of amitraz involves the interaction with the neuromodulator octopamine.[26] This interaction is probably the reason for increased nervous activity of ticks as a response on amitraz.[26][27]Usual activation of the receptors may lead to changes in the concentration of intracellular second messengers such as cyclic nucleotides cyclic AMP (cAMP) and cyclic GMP, inositol-1,4,5-trisphosphate and Ca2+.[28] Influencing this signal transduction system can lead to various events depending on the celltype.[28]Since it has been discovered that the octopamine receptor coding gene is expressed on very high rates in the somata of the honeybee brain, it is suggested that it is involved in the processing of sensory inputs, antennal motor outputs and higher-order brain functions. The amitraz-octopamine receptor interaction restrains these normal functions of the octopamine receptor. Therefore, it is efficient as an insect-pesticide.[26][28]Still, resistance against amitraz can occur. A mutation can lead to a working version of the octopamine receptor but with an altered pesticide target side.[26] This is probably the case for a very resistant Brazilian and Mexican tick strain, which have two nucleotide substitutions on the octopamine receptor coding gene compared with the Australian strains.[26]A closer understanding of these resistance meachnisms would help to develop more rapid and accurate diagnostic tools for detecting resistance and steer development of alternative acaricides.[26]
Inhibition of monoamine oxidases[edit]
In vitro a monoamine oxidase-inhibiting effect of amitraz has been found.[13] Monoamine oxidases catalyze the oxidative deamination of monoamines and thereby form flavoproteins and inactivate neurotransmitters.[29]However, in vivo it has been observed that only at high doses of amitraz or its main metabolite N-2,4-dimethylphenyl-N-methyl-formamide monoamine oxidase inhibition occurs.[13] In dogs it has been observed that after administration of such a dose an increase in plasma glucose and suppression of insulin occurs.[13]
Inhibition of prostaglandin synthesis[edit]
Like other formamidines amitraz inhibits the synthesis of prostaglandin E2 from arachidonic acid by bovine seminal vesicle microsomes.[30] In a dose of 5 to 80 mg/kg body weight, given intraperitoneally to rats, amitraz reduces yeast-induced fever and antagonizes the carrageenin-induced swelling of the hind paw.[30] Some of the physiological effects of amitraz probably go back to this aspirin-like activity and occur due to inhibition of prostaglandin synthesis.[23]
See also[edit]
- Mitaban
References[edit]
- ^ a b c d e f g h Corta, E., Bakkali, A., Berrueta, L. A., Gallo, B., & Vicente, F. (1999). Kinetics and mechanism of amitraz hydrolysis in aqueous media by HPLC and GC-MS. Talanta, 48(1), 189-199
- ^ Harrison, I. R., et al. (1973). 1,3,5-Triazapenta-1, 4-dienes: Chemical aspects of a new group of pesticides. Pestic. Sci. 4: 901
- ^ a b c d e f g h PubChem Substance. Amitraz – Substance Summary. retrieved from https://pubchem.ncbi.nlm.nih.gov/summary/summary.cgi?sid=24868774#x332
- ^ a b c d e f g h i Bonsall, J. L., & Turnbull, G. J. (1983). Extrapolation from safety data to management of poisoning with reference to amitraz (a formamidine pesticide) and xylene. Human Toxicology
- ^ a b c d e f g h Brown, P. M. (1977). Toxicological problems associated with the manufacture of triazapentadienes. Proceedings of the Royal Society of Medicine, 70(1), 41-43
- ^ a b c d Environmental Protection Agency. (1996). R.E.D. Facts – Amitraz. Prevention, Pesticides And Toxic Substances (7508W), November 1996 retrieved from "Archived copy" (PDF). Archived from the original (PDF) on 2012-05-18. Retrieved 2012-04-05.CS1 maint: archived copy as title (link)
- ^ a b c d e f g h i Hollingworth, R. M. (1976). Chemistry, biological activity, and uses of formamidine pesticides. Environmental Health Perspectives, 14(April), 57-69
- ^ a b c d e f IPCS INCHEM. (1984). Pesticide residues in food – 1984. retrieved from http://www.inchem.org/documents/jmpr/jmpmono/v84pr03.htm
- ^ a b c d e f g Peter R., de Bruin C., Odendaal D., Thompson P.N. The use of a pour-on and spray dip containing Amitraz to control ticks (Acari: Ixodidae) on cattle. J S Afr Vet Assoc, 2006, 77(2), 66-9
- ^ a b c d e f Tarallo V.D., Lia R.P., Sasanelli M., Cafarchia C., Otranto D. Efficacy of Amitraz plus Metaflumizone for the treatment of canine demodicosis associated with Malassezia pachydermatis. Parasit Vectors, 2009, 2(1)
- ^ a b Grossman M.R. Amitraz toxicosis associated with ingestion of an acaricide collar in a dog. J Am Vet Med Assoc, 1993, 203(1), 55-7
- ^ Federal Register Volume 78, Number 54 (Wednesday, March 20, 2013) Rules and Regulations Pages 17123-17130 [FR Doc No: 2013-06191].
- ^ a b c d e f g Ellenhorn, M.J., S. Schonwald, G. Ordog, J. Wasserberger. Ellenhorn's Medical Toxicology: Diagnosis and Treatment of Human Poisoning. 2nd ed. Baltimore, MD: Williams and Wilkins, 1997., p. 1730
- ^ a b c d e Gifte.de. (2007) Amitraz. retrieved from http://www.gifte.de/Chemikalien/amitraz.htm
- ^ Hayes W.J. et al. (1991). Handbook of Pesticide Toxicology. Volume 3 Classes of Pesticides. pg.1487
- ^ Lewis, R. J. (1996). Sax's Dangerous Properties of Industrial Materials. 9th edition, Volume 1-3, pg. 2227
- ^ PubChem Substance. Amitraz – Substance Summary. Retrieved from https://pubchem.ncbi.nlm.nih.gov/summary/summary.cgi?sid=13178#x321
- ^ a b Thomas A. Unger, T.A.U. (1996). Pesticide synthesis handbook. New Jersey: Noyes Publications, pp. 836.
- ^ Chou, C.-P. et al. (2004). Solid-Phase Extraction and GC-MSD Determination of Amitraz and Metabolites in Urine. Journal of Food and Drug Analysis. Vol. 12, No. 3, 2004, 212-216
- ^ a b c d e f g h i j IPCS INCHEM. (2012). Amitraz. retrieved from http://www.inchem.org/documents/jmpr/jmpmono/v098pr02.htm
- ^ a b c d e f Terence Robert Roberts, T.R.R. (1999). Metabolic pathways of agrochemicals. Cambridge: The Royal Society of Chemistry, pp 729 – 733
- ^ a b Pierpoint, A. C. Et al (1997). Kinetics and Mechanism of Amitraz Hydrolysis. Journal of Agricultural and Food Chemistry. 45 (5), pp 1937–1939
- ^ a b c Agin, H., Calkavur, S., Uzun, H., & Bak, M. (2004). Amitraz poisoning: clinical and laboratory findings. Indian Pediatrics, 41(5), 482-486
- ^ Chen-Izu, Y., Xiao, R. P., Izu, L. T., Cheng, H., Kuschel, M., Spurgeon, H., & Lakatta, E. G. (2000). G(i)-dependent localization of beta(2)-adrenergic receptor signaling to L-type Ca(2+) channels. Biophysical Journal, 79(5), 2547–2556
- ^ a b c Hsu, W. H. and Lu, Z.-X. (1984). Amitraz' induced delay of gastrointestinal transit in mice: Mediated by α2 adrenergic receptors. Drug Development Research, Volume 4 (6), 655- 680.
- ^ a b c d e f Chen, A. C., He, H., & Davey, R. B. (2007). Mutations in a putative octopamine receptor gene in amitraz-resistant cattle ticks. Veterinary Parasitology, 148(3-4), 379-383.
- ^ Li, A. Y., Davey, R. B., Miller, R. J., & George, J. E. (2004). Detection and characterization of amitraz resistance in the southern cattle tick, Boophilus microplus (Acari: Ixodidae). Journal of Medical Entomology, 41(2), 193-200
- ^ a b c Grohmann, L., Blenau, W., Erber, J., Ebert, P. R., Strünker, T., & Baumann, A. (2003). Molecular and functional characterization of an octopamine receptor from honeybee (Apis mellifera) brain. Journal of Neurochemistry, 86(3), 725-735
- ^ Tipton KF, Boyce S, O'Sullivan J, Davey GP, Healy J (August 2004). "Monoamine oxidases: certainties and uncertainties". Curr. Med. Chem. 11 (15): 1965–82
- ^ a b Yim, G. K., Holsapple, M. P., Pfister, W. R., & Hollingworth, R. M. (1978). Prostaglandin synthesis inhibited by formamidine pesticides. Life Sciences, 23(25), 2509–2515
External links[edit]
- Amitraz in the Pesticide Properties DataBase (PPDB)