antiaromaticidad
La antiaromaticidad es una característica de una molécula cíclica con un sistema de electrones π que tiene mayor energía debido a la presencia de 4n electrones deslocalizados (π o par solitario) en ella. A diferencia de los compuestos aromáticos , que siguen la regla de Hückel ([4 n +2] π electrones) [1] y son muy estables, los compuestos antiaromáticos son muy inestables y muy reactivos. Para evitar la inestabilidad de la antiaromaticidad, las moléculas pueden cambiar de forma, volviéndose no planas y, por lo tanto, rompiendo algunas de las interacciones π. A diferencia de la corriente de anillo diamagnético presente en los compuestos aromáticos , los compuestos antiaromáticos tienen una corriente de anillo paramagnético, que se puede observar mediante espectroscopía de RMN ..
Ejemplos de compuestos antiaromáticos son pentaleno (A), bifenileno (B), catión ciclopentadienilo (C). El ejemplo prototípico de antiaromaticidad, el ciclobutadieno , es objeto de debate, y algunos científicos argumentan que la antiaromaticidad no es un factor importante que contribuya a su desestabilización. [2]
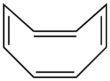
El ciclooctatetraeno es un ejemplo de una molécula que adopta una geometría no plana para evitar la desestabilización que resulta de la antiaromaticidad. Si fuera plano, tendría un solo sistema π de ocho electrones alrededor del anillo, pero en cambio adopta una forma similar a la de un bote con cuatro enlaces π individuales. [3] Debido a que los compuestos antiaromáticos suelen tener una vida corta y es difícil trabajar con ellos experimentalmente, la energía de desestabilización antiaromática a menudo se modela mediante simulación en lugar de experimentación. [2]
El término 'antiaromaticidad' fue propuesto por primera vez por Ronald Breslow en 1967 como "una situación en la que se desestabiliza una deslocalización cíclica de electrones". [4] Los criterios de la IUPAC para la antiaromaticidad son los siguientes: [5]
Esto difiere de la aromaticidad solo en el cuarto criterio: las moléculas aromáticas tienen 4 n +2 electrones π en el sistema π conjugado y, por lo tanto, siguen la regla de Hückel . Las moléculas no aromáticas son no cíclicas, no planas o no tienen un sistema π conjugado completo dentro del anillo.
Tener un sistema de anillos planos es esencial para maximizar la superposición entre los orbitales p que forman el sistema π conjugado. Esto explica por qué ser una molécula plana y cíclica es una característica clave tanto de las moléculas aromáticas como de las antiaromáticas. Sin embargo, en realidad, es difícil determinar si una molécula está completamente conjugada o no simplemente mirando su estructura: a veces las moléculas pueden distorsionarse para aliviar la tensión y esta distorsión tiene el potencial de interrumpir la conjugación. Por lo tanto, se deben realizar esfuerzos adicionales para determinar si una determinada molécula es o no genuinamente antiaromática. [6]