Surfactante
Los tensioactivos son compuestos que reducen la tensión superficial (o tensión interfacial) entre dos líquidos, entre un gas y un líquido, o entre un líquido y un sólido. Los tensioactivos pueden actuar como detergentes , agentes humectantes , emulsionantes , agentes espumantes o dispersantes . La palabra "tensioactivo" es una mezcla de resaca ace- actuar ive un ge nt , [1] COINED c. 1950 . [2]
Los agentes que aumentan la tensión superficial son "tensioactivos" en el sentido literal, pero no se denominan tensioactivos ya que su efecto es opuesto al significado común. Un ejemplo común de aumento de la tensión superficial es la salazón : al agregar una sal inorgánica a una solución acuosa de una sustancia débilmente polar, la sustancia precipitará. La sustancia puede ser en sí misma un tensioactivo; esta es una de las razones por las que muchos tensioactivos son ineficaces en el agua de mar.
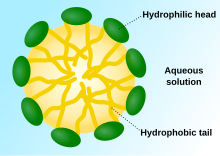
Los tensioactivos suelen ser compuestos orgánicos que son anfifílicos , lo que significa que contienen tanto grupos hidrófobos (sus colas ) como grupos hidrófilos (sus cabezas ). [3] Por lo tanto, un tensioactivo contiene tanto un componente insoluble en agua (o soluble en aceite) como un componente soluble en agua. Los tensioactivos se difundirán en el agua y se adsorberán en las interfaces .entre el aire y el agua o en la interfaz entre el aceite y el agua, en el caso de que el agua se mezcle con aceite. El grupo hidrófobo insoluble en agua puede extenderse fuera de la fase de agua a granel, hacia el aire o hacia la fase de aceite, mientras que el grupo de cabeza soluble en agua permanece en la fase de agua.
La producción mundial de tensioactivos se estima en 15 millones de toneladas por año, de las cuales aproximadamente la mitad son jabones . Otros tensioactivos producidos a gran escala son los alquilbencenosulfonatos lineales (1,7 millones de toneladas / año), los ligninsulfonatos (600.000 toneladas / año), los etoxilatos de alcoholes grasos (700.000 toneladas / año) y los etoxilatos de alquilfenol (500.000 toneladas / año). [4]
En la fase acuosa a granel, los tensioactivos forman agregados, tales como micelas , donde las colas hidrófobas forman el núcleo del agregado y las cabezas hidrófilas están en contacto con el líquido circundante. También se pueden formar otros tipos de agregados, como micelas esféricas o cilíndricas o bicapas lipídicas . La forma de los agregados depende de la estructura química de los tensioactivos, a saber, el equilibrio de tamaño entre la cabeza hidrófila y la cola hidrófoba. Una medida de esto es el equilibrio hidrófilo-lipófilo (HLB). Los tensioactivos reducen la tensión superficial del agua al adsorberse en la interfaz líquido-aire. La relación que une la tensión superficial y el exceso de superficie se conoce comoIsoterma de Gibbs .
La dinámica de la adsorción de tensioactivos es de gran importancia para aplicaciones prácticas tales como procesos de formación de espuma, emulsificación o recubrimiento, donde las burbujas o gotas se generan rápidamente y necesitan estabilizarse. La dinámica de absorción depende del coeficiente de difusión del tensioactivo. A medida que se crea la interfaz, la adsorción está limitada por la difusión del tensioactivo a la interfaz. En algunos casos, puede existir una barrera energética para la adsorción o desorción del tensioactivo. Si tal barrera limita la tasa de adsorción, se dice que la dinámica es "cinéticamente limitada". Tales barreras de energía pueden deberse a repulsiones estéricas o electrostáticas . La reología de la superficie de las capas de tensioactivo, incluidas la elasticidad y la viscosidad de la capa, juegan un papel importante en la estabilidad de las espumas y emulsiones.