 | |
 | |
 | |
| Nombres | |
|---|---|
| Nombre IUPAC Di-μ-carbonildicarbonilbis (η 5 -ciclopenta-2,4-dien-1-il) diiron | |
| Otros nombres Bis (ciclopentadienil) tetracarbonil-diirón, Di (ciclopentadienil) tetracarbonil-diirón, Bis (dicarbonilciclopentadieniliron) | |
| Identificadores | |
| |
Modelo 3D ( JSmol ) | |
| ChemSpider | |
| Tarjeta de información ECHA | 100.032.057 |
| Número CE |
|
PubChem CID | |
| |
| |
| Propiedades | |
| C 14 H 10 Fe 2 O 4 | |
| Masa molar | 353,925 g / mol |
| Apariencia | Cristales de color violeta oscuro |
| Densidad | 1,77 g / cm 3 , sólido |
| Punto de fusion | 194 ° C (381 ° F; 467 K) |
| Punto de ebullición | descomposición |
| insoluble | |
| Solubilidad en otros disolventes. | benceno, THF, clorocarbonos |
| Estructura | |
| octaédrico distorsionado | |
| 3.1 D (solución de benceno) | |
| Peligros | |
| Principales peligros | Fuente de CO |
| Pictogramas GHS |    |
| Palabra de señal GHS | Peligro |
| H228 , H302 , H331 , H330 | |
| Compuestos relacionados | |
Compuestos relacionados | Fe (C 5 H 5 ) 2 Fe (CO) 5 |
Salvo que se indique lo contrario, los datos se proporcionan para materiales en su estado estándar (a 25 ° C [77 ° F], 100 kPa). | |
| Referencias de Infobox | |
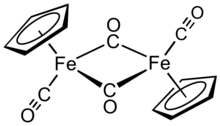
El dímero de ciclopentadieniliron dicarbonilo es un compuesto organometálico con la fórmula [( η 5 -C 5 H 5 ) Fe (CO) 2 ] 2 , a menudo abreviado como Cp 2 Fe 2 (CO) 4 , [CpFe (CO) 2 ] 2 o incluso Fp 2 , con el nombre coloquial "dímero fip". Es un sólido cristalino de color púrpura rojizo oscuro, que es fácilmente soluble en disolventes orgánicos moderadamente polares como el cloroformo y la piridina , pero menos soluble en tetracloruro de carbono y disulfuro de carbono.. Cp 2 Fe 2 (CO) 4 es insoluble pero estable frente al agua. Cp 2 Fe 2 (CO) 4 es razonablemente estable al almacenamiento al aire y sirve como material de partida conveniente para acceder a otros derivados de Fp (CpFe (CO) 2 ) (descritos a continuación). [1]
Estructura [ editar ]
En solución, el Cp 2 Fe 2 (CO) 4 puede considerarse un complejo dimérico de medio sándwich . Existe en tres formas isoméricas: cis , trans y una forma abierta sin puente. Estas formas isoméricas se distinguen por la posición de los ligandos. Los isómeros cis y trans difieren en la posición relativa de los ligandos C 5 H 5 (Cp). Los isómeros cis y trans tienen la formulación [( η 5 -C 5 H 5 ) Fe (CO) ( μ -CO)] 2, es decir, dos ligandos de CO son terminales mientras que los otros dos ligandos de CO forman un puente entre los átomos de hierro. Los isómeros cis y trans se interconvierten a través del isómero abierto, que no tiene ligandos puente entre los átomos de hierro. En cambio, se formula como ( η 5 -C 5 H 5 ) (OC) 2 Fe − Fe (CO) 2 ( η 5 -C 5 H 5 ) - los metales se mantienen unidos por un enlace hierro-hierro. En el equilibrio, predominan los isómeros cis y trans .
Además, se sabe que los carbonilos terminales y de puente se someten a intercambio: el isómero trans puede experimentar un intercambio de ligando de CO de puente-terminal a través del isómero abierto, o mediante un movimiento de torsión sin pasar por la forma abierta. Por el contrario, los ligandos de CO terminales y de puente del isómero cis solo pueden intercambiarse a través del isómero abierto. [2]
En solución, los isómeros cis , trans y abiertos se interconvierten rápidamente a temperatura ambiente, lo que hace que la estructura molecular sea fluxional . El proceso de flujo para el dímero de dicarbonilo de ciclopentadieniliron es más rápido que la escala de tiempo de RMN, de modo que sólo se observa una señal Cp única promediada en el espectro de RMN de 1 H a 25 ° C. Asimismo, el espectro de RMN de 13 C muestra una señal de CO aguda por encima de -10 ° C, mientras que la señal de Cp se agudiza a un pico por encima de 60 ° C. Los estudios de RMN indican que el isómero cis es ligeramente más abundante que el isómero trans a temperatura ambiente, mientras que la cantidad de la forma abierta es pequeña. [2]El proceso fluxional no es lo suficientemente rápido para producir promedios en el espectro IR . Por tanto, se ven tres absorciones para cada isómero. Los ligandos de CO puente aparecen alrededor de 1780 cm -1, mientras que los ligandos de CO terminales se observan alrededor de 1980 cm -1 . [3]
La estructura molecular en estado sólido de los isómeros cis y trans se ha analizado mediante difracción de rayos X y neutrones . La separación Fe-Fe y las longitudes de enlace Fe-C son los mismos en los Fe 2 C 2 romboides, un exactamente planar Fe 2 C 2 anillo de cuatro miembros en el trans isómero en comparación con un romboide plegada en cis con un ángulo de 164 ° y distorsiones significativas en el anillo Cp del isómero trans que reflejan diferentes poblaciones orbitales Cp. [4] Aunque los libros de texto más antiguos muestran los dos átomos de hierro unidos entre sí, los análisis teóricos indican la ausencia de un enlace directo Fe-Fe. Esta vista es consistente con los cálculos y los datos cristalográficos de rayos X que indican una falta de densidad de electrones significativa entre los átomos de hierro. [5] Sin embargo, Labinger ofrece una opinión disidente, basada principalmente en reactividad química y datos espectroscópicos, argumentando que la densidad de electrones no es necesariamente la mejor indicación de la presencia de un enlace químico. Además, sin un enlace Fe-Fe, los carbonilos de puente deben tratarse formalmente como ligando μ-X 2 y ligando μ-L para que los centros de hierro cumplan la regla de los 18 electrones.. Se argumenta que este formalismo da implicaciones engañosas con respecto al comportamiento químico y espectroscópico de los grupos carbonilo. [6]
La estructura promediada de estos isómeros de Cp 2 Fe 2 (CO) 4 da como resultado un momento dipolar de 3,1 D en benceno . [7]
Síntesis [ editar ]
Cp 2 Fe 2 (CO) 4 fue preparado por primera vez en 1955 en Harvard por Geoffrey Wilkinson usando el mismo método empleado hoy: la reacción de hierro pentacarbonilo y diciclopentadieno . [6] [8]
- 2 Fe (CO) 5 + C 10 H 12 → ( η 5 -C 5 H 5 ) 2 Fe 2 (CO) 4 + 6 CO + H 2
En esta preparación, el diciclopentadieno se agrieta para dar ciclopentadieno, que reacciona con Fe (CO) 5 con pérdida de CO . A partir de entonces, las rutas de las rutas fotoquímica y térmica difieren sutilmente, pero ambas implican la formación de un intermedio hidruro . [4] El método se utiliza en el laboratorio de enseñanza. [3]
Reacciones [ editar ]
Aunque no tiene un valor comercial importante, Fp 2 es un caballo de batalla en la química organometálica porque es económico y los derivados de FpX son resistentes (X = haluro, organilo).
"Fp - " (FpNa y FpK) [ editar ]
La escisión reductora de [CpFe (CO) 2 ] 2 (formalmente un complejo de hierro (I)) produce derivados de metales alcalinos derivados formalmente del anión ciclopentadieniliron dicarbonilo, [CpFe (CO) 2 ] - o llamado Fp - (formalmente hierro (0) ), que se supone que existen como un par de iones estrecho . Un reductor típico es sodio metálico o amalgama de sodio ; [9] Se han utilizado aleaciones de NaK , grafito de potasio (KC 8 ) y trialquilborohidruros de metales alcalinos. [CpFe (CO) 2 ] Na es un reactivo ampliamente estudiado ya que se alquila, acila o metala fácilmente mediante el tratamiento con unelectrófilo . [10] Es un excelente nucleófilo S N 2, siendo de uno a dos órdenes de magnitud más nucleófilo que el tiofenolato, PhS , cuando reacciona con bromuros de alquilo primarios y secundarios. [11]
- [CpFe (CO) 2 ] 2 + 2 Na → 2 CpFe (CO) 2 Na
- [CpFe (CO) 2 ] 2 + 2 KBH (C 2 H 5 ) 3 → 2 CpFe (CO) 2 K + H 2 + 2 B (C 2 H 5 ) 3
El tratamiento de NaFp con un haluro de alquilo (RX, X = Br, I) produce FeR ( η 5 -C 5 H 5 ) (CO) 2
- CpFe (CO) 2 K + CH 3 I → CpFe (CO) 2 CH 3 + KI
La Fp 2 también se puede escindir con metales alcalinos [12] y mediante reducción electroquímica . [13] [14]
FpX (X = Cl, Br, I) [ editar ]
Los halógenos escinden oxidativamente [CpFe (CO) 2 ] 2 para dar la especie Fe (II) FpX (X = Cl, Br, I):
- [CpFe (CO) 2 ] 2 + X 2 → 2 CpFe (CO) 2 X
Un ejemplo es el yoduro de ciclopentadieniliron dicarbonilo .
Fp ( η 2 -alqueno) + , Fp ( η 2 -alquino) + y otros "Fp + " [ editar ]
En presencia de aceptores de aniones haluro como AlBr 3 o Ag BF 4 , los compuestos FpX (X = haluro) reaccionan con alquenos , alquinos o ligandos lábiles neutros (como éteres y nitrilos ) para producir complejos Fp + . [15] En otro enfoque, las sales de [Fp (isobuteno)] + se obtienen fácilmente por reacción de NaFp con cloruro de metalilo seguido de protonólisis. Este complejo es un precursor general y conveniente de otros complejos catiónicos Fp-alqueno y Fp-alquino. [16] El proceso de intercambio se ve facilitado por la pérdida de gaseosos y voluminososisobuteno . [17] Generalmente, los alquenos menos sustituidos se unen con más fuerza y pueden desplazar ligandos de alquenos más impedidos. Los complejos de alqueno y alquino también se pueden preparar calentando un éter catiónico o un complejo de agua, por ejemplo [Fp ( thf )]+
BF-
4, con el alqueno o alquino. [18] [FpL]+
BF-
4Los complejos también se pueden preparar mediante el tratamiento de FpMe con HBF 4 · Et 2 O en CH 2 Cl 2 a -78 ° C, seguido de la adición de L. [19]
Los complejos de alqueno- Fp también se pueden preparar a partir del anión Fp indirectamente. Por lo tanto, la abstracción de hidruro de compuestos Fp-alquilo usando hexafluorofosfato de trifenilmetilo produce complejos [Fp (α-alqueno)] + .
- FpNa + RCH 2 CH 2 I → FpCH 2 CH 2 R + NaI
- FpCH 2 CH 2 R + Ph 3 CPF 6 → [Fp (CH
2= CHR)+
] PF-
6 + Ph 3 CH
La reacción de NaFp con un epóxido seguida de deshidratación promovida por ácido también produce complejos de alqueno. Los Fp (alqueno) + son estables con respecto a la bromación , hidrogenación y acetoximercuración , pero el alqueno se libera fácilmente con yoduro de sodio en acetona o calentando con acetonitrilo . [20]
El ligando de alqueno en estos cationes se activa hacia el ataque de nucleófilos , abriendo el camino a una serie de reacciones de formación de enlaces carbono-carbono . Las adiciones nucleofílicas suelen ocurrir en el carbono más sustituido. Esta regioquímica se atribuye a la mayor densidad de carga positiva en esta posición. El regiocontrol suele ser modesto. La adición del nucleófilo es completamente estereoselectiva , ocurriendo en contra del grupo Fp. También se informa que los complejos análogos de Fp (alquino) + experimentan reacciones de adición nucleofílica por varios nucleófilos de carbono, nitrógeno y oxígeno. [21]
Los complejos Fp (alqueno) + y Fp (alquino) + π también son bastante ácidos en las posiciones alílica y propargílica, respectivamente, y pueden desprotonarse cuantitativamente con bases amínicas como Et 3 N para dar Fp-alilo y Fp-alenilo σ neutros. -complejos: [16]
- Fp (H
2C = CHCH
2CH
3)+
BF-
4+ Et 3 N → FpCH 2 CH = CHCH 3 + Et
3NUEVA HAMPSHIRE+
BF-
4 - FpCH 2 CH = CHCH 3 + E+
BF-
4→ Fp (H
2C = CHCH ( E ) CH
3)+
BF-
4
Fp-alilo y Fp-alenilo reaccionan con electrófilos catiónicos E (como Me 3 O + , carbocationes , iones oxocarbenio ) para generar productos de funcionalización alílico y propargílico, respectivamente. [16] Se ha demostrado que el complejo relacionado [Cp * Fe (CO) 2 (thf)] + [BF 4 ] - cataliza la funcionalización propargílica y alílica de C-H aprovechando los procesos de desprotonación y funcionalización electrofílica descritos anteriormente. [22]
Reactivos de ciclopropanación basados en Fp [ editar ]
Se han desarrollado reactivos basados en Fp para ciclopropanaciones . [23] El reactivo clave se prepara a partir de FpNa con un tioéter y yoduro de metilo , y tiene una buena vida útil, en contraste con los intermedios típicos de Simmons-Smith y los diazoalcanos .
- FpNa + ClCH 2 SCH 3 → FpCH 2 SCH 3 + NaCl
- FpCH 2 SCH 3 + CH 3 I + NaBF 4 → FpCH 2 S (CH 3 ) 2 ] BF 4 + NaI
El uso de [FpCH 2 S (CH 3 ) 2 ] BF 4 no requiere condiciones especiales.
- Fp (CH
2S+
(CH
3)
2) BF-
4 + (Ph) 2 C = CH 2 → 1,1-difenilciclopropano +…
Se agrega cloruro de hierro (III) para destruir cualquier subproducto.
Precursores de Fp = CH+
2, como FpCH 2 OMe que se convierte en carbeno de hierro tras la protonación, también se han utilizado como reactivos de ciclopropanación. [24]
Reacción fotoquímica [ editar ]
Fp 2 exhibe fotoquímica . [25] Tras la irradiación UV a 350 nm, se reduce con el dímero de 1-bencil-1,4-dihidronicotinamida , (BNA) 2 . [26]
Referencias [ editar ]
- ^ Kelly, William J. (2001). "Bis (dicarbonilciclopentadieniliron)". Enciclopedia de reactivos para síntesis orgánica . doi : 10.1002 / 047084289X.rb139 . ISBN 0471936235.
- ^ a b Harris, Daniel C .; Rosenberg, Edward; Roberts, John D. (1974). "Espectros de resonancia magnética nuclear de carbono-13 y mecanismo de intercambio de carbonilo puente-terminal en di- µ -carbonil-bis [carbonil ( η- ciclopentadienil) hierro] (Fe-Fe) [{( η -C 5 H 5 ) Fe ( CO) 2 } 2 ]; cd -di- μ carbonilo- f carbonilo- ae -di ( η ciclopentadienil) - b - (trietil-fosfito) di-hierro (Fe-Fe) [( η -C 5 H 5 ) 2 Fe 2(CO) 3 P (OEt) 3 ], y algunos complejos relacionados ". Revista de la Sociedad Química: Dalton Transactions (22): 2398-2403. Doi : 10.1039 / DT9740002398 . ISSN 0300-9246 .
- ↑ a b Girolami, G .; Rauchfuss, T .; Angelici, R. (1999). Síntesis y técnica en química inorgánica (3ª ed.). Sausalito, CA: University Science Books. págs. 171–180. ISBN 978-0-935702-48-4.
- ↑ a b Wilkinson, G. , ed. (mil novecientos ochenta y dos). Química Organometálica Integral . 4 . Nueva York: Pergamon Press. págs. 513–613. ISBN 978-0-08-025269-8.
- ↑ Green, Jennifer C .; Verde, Malcolm LH; Parkin, Gerard (2012). "La aparición y representación de enlaces de dos electrones de tres centros en compuestos inorgánicos covalentes". Comunicaciones químicas . 2012 (94): 11481–11503. doi : 10.1039 / c2cc35304k . PMID 23047247 .
- ↑ a b Labinger, Jay A. (2015). "¿El dímero de ciclopentadienil hierro dicarbonilo tiene un enlace metal-metal? ¿Quién pregunta?". Inorgánica Chimica Acta . Agrupaciones y compuestos de unión metal-metal. 424 : 14-19. doi : 10.1016 / j.ica.2014.04.022 . ISSN 0020-1693 .
- ^ Algodón, F. Albert; Yagupsky, G. (1967). "Cambios tautoméricos en carbonilos metálicos. I. Dímero de dicarbonilo de π-ciclopentadienilirón y dímero de dicarbonilo de π-ciclopentadienil-rutenio". Química inorgánica . 6 (1): 15-20. doi : 10.1021 / ic50047a005 . ISSN 0020-1669 .
- ^ Piper, TS; Algodón, FA; Wilkinson, G. (1955). "Monóxido de carbono ciclopentadienilo y compuestos relacionados de algunos metales de transición". Revista de Química Inorgánica y Nuclear . 1 (3): 165-174. doi : 10.1016 / 0022-1902 (55) 80053-X .
- ^ Chang, TCT; Rosenblum, M .; Simms, N. (1988). "Vinilación de enolatos con un equivalente de catión de vinilo: trans -3-metil-2-vinilciclohexanona" . Síntesis orgánicas . 66 : 95.; Volumen colectivo , 8 , p. 479
- ^ Rey, B. (1970). "Aplicaciones de los aniones de carbonilo metálico en la síntesis de compuestos organometálicos inusuales". Cuentas de Investigación Química . 3 (12): 417–427. doi : 10.1021 / ar50036a004 .
- ^ Dessy, Raymond E .; Pohl, Rudolph L .; King, R. Bruce (1 de noviembre de 1966). "Electroquímica organometálica. VII.1 Las nucleofilicidades de aniones metálicos y metaloidales derivados de metales de los grupos IV, V, VI, VII y VIII" . Revista de la Sociedad Química Estadounidense . 88 (22): 5121–5124. doi : 10.1021 / ja00974a015 . ISSN 0002-7863 .
- ^ Ellis, JE; Flom, EA (1975). "La química de los aniones de carbonilo metálico: III. Aleación de sodio-potasio: un reactivo eficiente para la producción de aniones de carbonilo metálico". Revista de Química Organometálica . 99 (2): 263–268. doi : 10.1016 / S0022-328X (00) 88455-7 .
- ^ Dessy, RE; King, RB; Waldrop, M. (1966). "Electroquímica organometálica. V. La serie de transición". Revista de la Sociedad Química Estadounidense . 88 (22): 5112–5117. doi : 10.1021 / ja00974a013 .
- ^ Dessy, RE; Weissman, PM; Pohl, RL (1966). "Electroquímica organometálica. VI. Escisión electroquímica de enlaces metal-metal". Revista de la Sociedad Química Estadounidense . 88 (22): 5117–5121. doi : 10.1021 / ja00974a014 .
- ^ Plata, J. (1993). Química del Hierro . Dordrecht: Springer Holanda. ISBN 9789401121408. OCLC 840309324 .
- ^ a b c Cutler, A .; Ehnholt, D .; Lennon, P .; Nicholas, K .; Marten, David F .; Madhavarao, M .; Raghu, S .; Rosan, A .; Rosenblum, M. (1975). "La química de los complejos de .eta.5-ciclopentadienilhierro dicarbonilo. Síntesis generales de monosustituido η 2 complejos de olefina y de 1-sustituidos η 1 -alil complejos. Efectos conformacionales en el curso de la desprotonación de ( η 2 olefina) cationes". Revista de la Sociedad Química Estadounidense . 97 (11): 3149–3157. doi : 10.1021 / ja00844a038 . ISSN 0002-7863 .
- ^ Turnbull, Mark M. (2001). "Tetrafluoroborato de dicarbonil (ciclopentadienil) (isobuteno) hierro". Enciclopedia de reactivos para síntesis orgánica . eEROS . doi : 10.1002 / 047084289X.rd080 . ISBN 0471936235.
- ^ Schriver, DF; Bruce, MI; Wilkinson, G. (1995). Hierro, Rutenio y Osmio . Kidlington: Elsevier Science. ISBN 978-0-08-096396-9. OCLC 953660855 .
- ^ Redlich, Mark D .; Mayer, Michael F .; Hossain, M. Mahmun (2003). "Ácido de Lewis de hierro [( η 5- C 5 H 5 ) Fe (CO) 2 (THF)] + reacciones orgánicas catalizadas". Aldrichimica Acta . 36 : 3-13.
- ^ Pearson, AJ (1994). Compuestos de hierro en síntesis orgánica . San Diego, CA: Academic Press. págs. 22–35. ISBN 978-0-12-548270-7.
- ^ Akita, Munetaka; Kakuta, Satoshi; Sugimoto, Shuichiro; Terada, Masako; Tanaka, Masako; Moro-oka, Yoshihiko (2001). "Nucleofílica Adición a la η 2 -Alkyne ligando en [CpFe (CO) 2 ( η 2 -R-C ⋮ C-R)] + . Dependencia de la Alquenilo Estereoquímica Producto de la basicidad del nucleófilo". Organometálicos . 20 (13): 2736–2750. doi : 10.1021 / om010095t . ISSN 0276-7333 .
- ^ Wang, Yidong; Zhu, Jin; Durham, Austin C .; Lindberg, Haley; Wang, Yi-Ming (2019). "Funcionalización α-C-H de enlaces π mediante complejos de hierro: hidroxialquilación catalítica de alquinos y alquenos". Revista de la Sociedad Química Estadounidense . 141 (50): 19594-19599. doi : 10.1021 / jacs.9b11716 . ISSN 0002-7863 . PMID 31791121 .
- ^ Mattson, MN; O'Connor, EJ; Helquist, P. (1992). "Ciclopropanación utilizando un reactivo de transferencia de metileno que contiene hierro: 1,1-difenilciclopropano" . Síntesis orgánicas . 70 : 177.; Volumen colectivo , 9 , p. 372
- ^ Johnson, MD (1982), "Compuestos de hierro mononucleares con ligandos de hidrocarburos η 1 " , Química organometálica integral , Elsevier, págs. 331-376, doi : 10.1016 / b978-008046518-0.00049-0 , ISBN 978-0-08-046518-0, consultado el 11 de diciembre de 2019
- ^ Wrighton, M. (1974). "Fotoquímica de carbonilos metálicos". Revisiones químicas . 74 (4): 401–430. doi : 10.1021 / cr60290a001 .
- ^ Fukuzumi, S .; Ohkubo, K .; Fujitsuka, M .; Yo también.; Teichmann, MC; Maisonhaute, E .; Amatore, C. (2001). "Generación fotoquímica de anión ciclopentadieniliron dicarbonilo por un análogo de dímero de dinucleótido de nicotinamida adenina". Química inorgánica . 40 (6): 1213-1219. doi : 10.1021 / ic0009627 . PMID 11300821 .