 | |
 | |
| Nombres | |
|---|---|
| Nombre IUPAC preferido Triamida hexametilfosfórica [1] | |
| Otros nombres | |
| Identificadores | |
Modelo 3D ( JSmol ) | |
| CHEBI | |
| ChemSpider | |
| Tarjeta de información ECHA | 100.010.595 |
| KEGG | |
PubChem CID | |
| UNII | |
Tablero CompTox ( EPA ) | |
| |
| |
| Propiedades | |
| C 6 H 18 N 3 O P | |
| Masa molar | 179,20 g / mol |
| Apariencia | líquido transparente e incoloro [2] |
| Olor | aromático, suave, amínico [2] |
| Densidad | 1,03 g / cm 3 |
| Punto de fusion | 7,20 ° C (44,96 ° F; 280,35 K) |
| Punto de ebullición | 232,5 ° C (450,5 ° F; 505,6 K) CRC [3] |
| miscible [2] | |
| Presión de vapor | 0,03 mmHg (4,0 Pa) a 20 ° C [2] |
| Peligros | |
| Principales peligros | Sospecha de carcinógeno [2] |
| Ficha de datos de seguridad | MSDS de Oxford |
| punto de inflamabilidad | 104,4 ° C (219,9 ° F; 377,5 K) |
| NIOSH (límites de exposición a la salud de EE. UU.): | |
PEL (permitido) | ninguno [2] |
REL (recomendado) | Ca [2] |
IDLH (peligro inmediato) | Ca [ND] [2] |
Salvo que se indique lo contrario, los datos se proporcionan para materiales en su estado estándar (a 25 ° C [77 ° F], 100 kPa). | |
| Referencias de Infobox | |
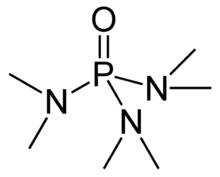
La hexametilfosforamida , a menudo abreviada como HMPA , es una fosforamida (una amida de ácido fosfórico ) con la fórmula [(CH 3 ) 2 N] 3 PO. Este líquido incoloro es un reactivo útil en síntesis orgánica .
Estructura y reactividad [ editar ]
HMPA es el óxido de la triamida hexametilfosforosa de fosfina terciaria altamente básica (HMPT), P (NMe 2 ) 3 . Como otros óxidos de fosfina (como el óxido de trifenilfosfina ), la molécula tiene un núcleo tetraédrico y un enlace P = O que está altamente polarizado, con una carga negativa significativa que reside en el átomo de oxígeno.
Los compuestos que contienen un enlace nitrógeno- fósforo típicamente son degradados por el ácido clorhídrico para formar una amina protonada y un fosfato.
Disuelve los metales alcalinos formando soluciones azules que son estables durante algunas horas. [4] Los electrones solvatados están presentes en estas soluciones azules. [5]
Aplicaciones [ editar ]
HMPA es un solvente especializado para polímeros , gases y compuestos organometálicos . Mejora la selectividad de las reacciones de litiación al romper los oligómeros de las bases de litio como el butillitio . Debido a que el HMPA solvata selectivamente los cationes, acelera las reacciones de S N 2 que de otro modo serían más lentas al generar más aniones desnudos. Los centros básicos de nitrógeno en HMPA se coordinan fuertemente con Li + . [6]
HMPA es un ligando en los reactivos útiles basados en complejos de peróxido de molibdeno , por ejemplo, MoO (O 2 ) 2 (HMPA) (H 2 O) se usa como oxidante en síntesis orgánica. [7]
Reactivos alternativos [ editar ]
A menudo se puede utilizar dimetilsulfóxido en lugar de HMPA como codisolvente. Ambos son fuertes aceptores de enlaces de hidrógeno y sus átomos de oxígeno se unen a cationes metálicos . Otras alternativas al HMPA incluyen las N , N '-tetraalquilureas DMPU (dimetilpropilenurea) [8] [9] o DMI (1,3-dimetil-2-imidazolidinona). [10] Se ha informado que la triamida del ácido tripirrolidinofosfórico (TPPA) es un buen reactivo sustituto del HMPA en reducciones con diyoduro de samario [11] y como aditivo de base de Lewis para muchas reacciones que involucran cetilos de samario . [12]
Toxicidad [ editar ]
El HMPA es solo levemente tóxico, pero se ha demostrado que causa cáncer en ratas. [6] El HMPA puede degradarse por la acción del ácido clorhídrico .
Referencias [ editar ]
- ^ a b "Materia principal". Nomenclatura de la química orgánica: Recomendaciones y nombres preferidos de la IUPAC 2013 (Libro azul) . Cambridge: La Real Sociedad de Química . 2014. págs. P001 – P004. doi : 10.1039 / 9781849733069-FP001 . ISBN 978-0-85404-182-4.
- ^ a b c d e f g h Guía de bolsillo de NIOSH sobre peligros químicos. "# 0321" . Instituto Nacional de Seguridad y Salud Ocupacional (NIOSH).
- ^ Haynes, William M. (2010). Manual de Química y Física (91 ed.). Boca Raton, Florida, EE.UU .: CRC Press . pag. 3-280. ISBN 978-1-43982077-3.
- ^ Luehrs, Dean C .; Kohut, John P. (1974). "Solvatos de hexametilfosforamida de sales de metales alcalinos". Revista de Química Inorgánica y Nuclear . 36 (7): 1459-1460. doi : 10.1016 / 0022-1902 (74) 80605-6 .
- ^ Gremmo, Norberto; Randles, John EB (1974). "Electrones solvatados en hexametilfosforamida. Parte 1. — Conductividad de soluciones de metales alcalinos". Revista de la Sociedad Química, Transacciones de Faraday 1: Química física en fases condensadas . 70 : 1480-1487. doi : 10.1039 / F19747001480 .
- ↑ a b Dykstra, RR (2001). "Triamida hexametilfosfórica". Enciclopedia de reactivos para síntesis orgánica . Nueva York, NY: John Wiley & Sons. doi : 10.1002 / 047084289X.rh020 . ISBN 978-0471936237.
- ^ Dickman, Michael H .; Papa, Michael T. (1994). "Peroxo y Superoxo complejos de cromo, molibdeno y tungsteno". Revisiones químicas . 94 (3): 569–584. doi : 10.1021 / cr00027a002 .
- ^ Mukhopadhyay, T .; Seebach, D. (1982). "Sustitución de HMPT por la urea cíclica DMPU como codisolvente para bases y nucleófilos altamente reactivos" . Helvetica Chimica Acta . 65 (1): 385–391. doi : 10.1002 / hlca.19820650141 .
- ^ Beck, AK; Seebach, D. (2001). " N , N '-Dimetilpropilenurea". Enciclopedia de reactivos para síntesis orgánica . Nueva York: John Wiley & Sons. doi : 10.1002 / 047084289X.rd366 . ISBN 978-0471936237.
- ^ Lo, Chi-Chu; Chao, Pei-Min (1990). "Reemplazo del solvente cancerígeno HMPA por DMI en la síntesis de feromonas sexuales de insectos". Revista de Ecología Química . 16 (12): 3245–3253. doi : 10.1007 / BF00982095 . PMID 24263426 .
- ^ McDonald, Chriss E .; Ramsey, Jeremy D .; Sampsell, David G .; Butler, Julie A .; Cecchini, Michael R. (2010). "Triamida de ácido tripirrolidinofosfórico como activador en reducciones de diyoduro de samario". Letras orgánicas . 12 (22): 5178–5181. doi : 10.1021 / ol102040s . PMID 20979412 .
- ^ Berndt, Mathias; Hölemann, Alexandra; Niermann, André; Bentz, Christoph; Zimmer, Reinhold; Reissig, Hans-Ulrich (2012). "Reemplazo de HMPA en diyoduro de samario promovió ciclizaciones y reacciones de compuestos de organolitio". Revista europea de química orgánica . 2012 (7): 1299–1302. doi : 10.1002 / ejoc.201101830 . ISSN 1099-0690 .
La triamida del ácido tripirrolidinofosfórico (TPPA) puede reemplazar al HMPA cancerígeno como aditivo básico de Lewis en muchas reacciones que involucran cetilos de samario.
En la mayoría de los casos, los rendimientos y selectividades de las ciclizaciones de (het) aril, alquenil y alquinil cetonas son similares.
Enlaces externos [ editar ]
- "Hexametilfosforamida CAS No. 680-31-9" (PDF) . Informe sobre carcinógenos (12ª ed.). Programa Nacional de Toxicología, Departamento de Salud y Servicios Humanos. 2011.
- "Hexametilfosforamida" . Guía de bolsillo de NIOSH sobre peligros químicos . Centros para el Control y la Prevención de Enfermedades, Departamento de Salud y Servicios Humanos. 2011.
- Merck Index . 4761 (12ª ed.).