| Interleucina humana 12 | |
|---|---|
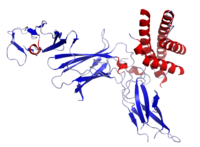 Estructura cristalina de la IL-12 humana | |
| Identificadores | |
| Símbolo | IL12, p70 |
| PDB | 1F45 |
| IL12A | ||||||
|---|---|---|---|---|---|---|
| Identificadores | ||||||
| Símbolo | IL12A | |||||
| Alt. simbolos | CLMF1, NKSF1, p35 | |||||
| Gen NCBI | 3592 | |||||
| HGNC | 5969 | |||||
| OMIM | 161560 | |||||
| RefSeq | NM_000882 | |||||
| UniProt | P29459 | |||||
| Otros datos | ||||||
| Lugar | Chr. 3 p12-q13.2 | |||||
| ||||||
| interleucina 12B | ||||||
|---|---|---|---|---|---|---|
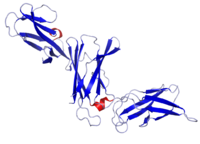 Estructura cristalina de IL-12B | ||||||
| Identificadores | ||||||
| Símbolo | IL12B | |||||
| Alt. simbolos | CLMF2, NKSF2, p40 | |||||
| Gen NCBI | 3593 | |||||
| HGNC | 5970 | |||||
| OMIM | 161561 | |||||
| PDB | 1F42 | |||||
| RefSeq | NM_002187 | |||||
| UniProt | P29460 | |||||
| Otros datos | ||||||
| Lugar | Chr. 5 q31.1-33.1 | |||||
| ||||||
La interleucina 12 ( IL-12 ) es una interleucina que es producida naturalmente por células dendríticas , [1] macrófagos , neutrófilos y células linfoblastoides B humanas ( NC-37 ) en respuesta a la estimulación antigénica. IL-12 pertenece a la familia de la interleucina-12. La familia IL-12 es única porque comprende las únicas citocinas heterodiméricas, que incluyen IL-12, IL-23 , IL-27 e IL-35 . [2] A pesar de compartir muchas características estructurales y socios moleculares, median efectos funcionales sorprendentemente diversos.
Gen y estructura [ editar ]
IL-12 se compone de un paquete de cuatro hélices alfa . Es una citocina heterodimérica codificada por dos genes separados, IL-12A (p35) e IL-12B (p40). El heterodímero activo (denominado " p70 ") y un homodímero de p40 se forman después de la síntesis de proteínas.
Funciones [ editar ]
IL-12 participa en la diferenciación de células T vírgenes en células Th1 . [3] Es conocido como factor estimulante de las células T, que puede estimular el crecimiento y la función de las células T. Estimula la producción de interferón-gamma (IFN-γ) y factor de necrosis tumoral alfa (TNF-α) a partir de células T y células asesinas naturales (NK) , y reduce la supresión de IFN-γ mediada por IL-4 . [4] Las células T que producen IL-12 tienen un correceptor , CD30 , que está asociado con la actividad de IL-12.
La IL-12 juega un papel importante en las actividades de las células asesinas naturales y los linfocitos T. La IL-12 media la potenciación de la actividad citotóxica de las células NK y los linfocitos T citotóxicos CD8 + . También parece haber un vínculo entre IL-2 y la transducción de señales de IL-12 en las células NK. IL-2 estimula la expresión de dos receptores de IL-12, IL-12R-β1 e IL-12R-β2, manteniendo la expresión de una proteína crítica involucrada en la señalización de IL-12 en células NK . La respuesta funcional mejorada se demuestra mediante la producción de IFN-γ y la destrucción de las células diana.
La IL-12 también tiene actividad antiangiogénica , lo que significa que puede bloquear la formación de nuevos vasos sanguíneos. Lo hace aumentando la producción de interferón gamma , que a su vez aumenta la producción de una quimiocina llamada proteína inducible-10 (IP-10 o CXCL10 ). Entonces, IP-10 media este efecto anti-angiogénico. Debido a su capacidad para inducir respuestas inmunes y su actividad anti-angiogénica, ha habido interés en probar la IL-12 como un posible fármaco contra el cáncer . Sin embargo, no se ha demostrado que tenga una actividad sustancial en los tumores probados hasta la fecha. Existe un vínculo que puede ser útil en el tratamiento entre la IL-12 y las enfermedades psoriasis y enfermedad inflamatoria intestinal.[ cita requerida ]
Transducción de señales [ editar ]
IL-12 se une al receptor de IL-12, que es un receptor heterodimérico formado por IL-12Rβ1 e IL-12Rβ2 . [5] Se considera que la IL-12Rβ2 juega un papel clave en la función de la IL-12, ya que se encuentra en las células T activadas y es estimulada por citocinas que promueven el desarrollo de células Th1 e inhibida por aquellas que promueven el desarrollo de células Th2 . Tras la unión, IL-12R-β2 se fosforila en tirosina y proporciona sitios de unión para las quinasas, Tyk2 y Jak2 . Estos son importantes en la activación de proteínas de factores de transcripción críticos como STAT4 que están implicadas en la señalización de IL-12 enCélulas T y células NK. Esta vía se conoce como vía JAK-STAT . [6]
Se puede encontrar una amplia revisión y visualización de la señalización de IL-12 en la base de datos de vías revisada por pares Reactome: Interleukin-12 family
Autoinmunidad [ editar ]
La IL-12 está relacionada con la autoinmunidad . Se demostró que la administración de IL-12 a personas que padecen enfermedades autoinmunes empeora los fenómenos autoinmunes. Se cree que esto se debe a su papel clave en la inducción de respuestas inmunes Th1. Por el contrario, la eliminación del gen de IL-12 en ratones o un tratamiento de ratones con anticuerpos específicos de IL-12 mejoraron la enfermedad.
Los resultados publicados en el Journal of Allergy and Clinical Immunology de un estudio en el que se ha demostrado que los ratones que fueron criados para ser alérgicos al maní, la interleucina-12 no está presente, sugieren que la molécula normalmente detiene el desarrollo de alergias a los alimentos. Se están realizando más investigaciones para determinar si los resultados encontrados en ratones son tan profundos en humanos. [7] [8]
Mutaciones del receptor β1 de IL-12 e IL-12 [ editar ]
La interleucina 12 (IL-12) es producida por células presentadoras de antígenos activadas ( células dendríticas , macrófagos ). [9] Promueve el desarrollo de respuestas Th1 y es un poderoso inductor de la producción de IFNγ por las células T y NK . [10]
Se descubrió que un niño con infección por Bacillus Calmette-Guérin y Salmonella enteritidis tenía una gran deleción homocigótica dentro del gen de la subunidad p40 de IL-12, lo que impedía la expresión de la citocina funcional IL-12 p70 por las células dendríticas activadas y los fagocitos. Como resultado, la producción de IFNγ por los linfocitos del niño se vio notablemente afectada. [11] Esto sugirió que la IL-12 es esencial para la inmunidad protectora contra bacterias intracelulares como micobacterias y Salmonella .
Esta idea está respaldada por la observación de que un receptor de IL-12 es importante para la producción de IFNγ por los linfocitos. Las células T y NK de siete pacientes no emparentados que tenían infecciones micobacterianas idiopáticas graves y Salmonella no produjeron IFNγ cuando se estimularon con IL-12. [11] Por lo demás, los pacientes estaban sanos. Se encontró que tenían mutaciones en la cadena β1 del receptor de IL-12, lo que resultaba en codones de parada prematuros en el dominio extracelular, lo que resultaba en falta de respuesta a esta citocina, lo que nuevamente demuestra el papel crucial de IL-12 en la defensa del huésped.
Las respuestas inmunes defectuosas Th1 y Th17 que conducen a la candidiasis mucocutánea crónica son el resultado de una mutación posterior en la vía de señalización de IL-12 . El rasgo se asignó a mutaciones en el gen STAT1 , que se asociaron con una menor producción de interferón-γ, IL-17 e IL-22 en respuesta a la actividad Jak2 y Tyk2 asociada al receptor de IL-12 o IL-23 . [12]
Ver también [ editar ]
- CNTO 1275
Referencias [ editar ]
- ^ Kaliński P, Hilkens CM, Snijders A, Snijdewint FG, Kapsenberg ML (julio de 1997). "Las células dendríticas deficientes en IL-12, generadas en presencia de prostaglandina E2, promueven la producción de citocinas de tipo 2 en células auxiliares T humanas vírgenes en maduración" . Revista de inmunología . 159 (1): 28–35. PMID 9200435 .
- ^ Vignali DA, Kuchroo VK (julio de 2012). "Citocinas de la familia IL-12: creadores de juegos inmunológicos" . Inmunología de la naturaleza . 13 (8): 722–8. doi : 10.1038 / ni.2366 . PMC 4158817 . PMID 22814351 .
- ^ Hsieh CS, Macatonia SE, Tripp CS, Wolf SF, O'Garra A, Murphy KM (abril de 1993). "Desarrollo de linfocitos T TH1 CD4 + a través de IL-12 producida por macrófagos inducidos por Listeria". Ciencia . 260 (5107): 547–9. doi : 10.1126 / science.8097338 . PMID 8097338 .
- ^ Zheng, Hua; Ban, Yi; Wei, Fang; Ma, Xiaojing (2016), Ma, Xiaojing (ed.), "Regulación de la producción de interleucina-12 en células presentadoras de antígeno", Regulación de la expresión génica de citocinas en inmunidad y enfermedades , Springer Países Bajos, 941 , págs. 117-138, doi : 10.1007 / 978-94-024-0921-5_6 , ISBN 978-94-024-0919-2, PMID 27734411
- ^ Presky DH, Yang H, Minetti LJ, Chua AO, Nabavi N, Wu CY, et al. (Noviembre de 1996). "Un complejo de receptor de interleucina 12 funcional se compone de dos subunidades de receptor de citocina de tipo beta" . Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 93 (24): 14002–7. doi : 10.1073 / pnas.93.24.14002 . PMC 19484 . PMID 8943050 .
- ^ Wang KS, Frank DA, Ritz J (mayo de 2000). "La interleucina-2 mejora la respuesta de las células asesinas naturales a la interleucina-12 mediante la regulación positiva del receptor de interleucina-12 y STAT4" . Sangre . 95 (10): 3183–90. doi : 10.1182 / sangre.V95.10.3183 . PMID 10807786 . Archivado desde el original el 15 de abril de 2013.
- ^ Temblay JN, Bertelli E, Arques JL, Regoli M, Nicoletti C (septiembre de 2007). "La producción de IL-12 por las células dendríticas del parche de Peyer es fundamental para la resistencia a la alergia alimentaria". La Revista de Alergia e Inmunología Clínica . 120 (3): 659–65. doi : 10.1016 / j.jaci.2007.04.044 . PMID 17599398 .
- ^ "Molécula de alergia alimentaria descubierta" . BBC News . 1 de julio de 2007.
- ^ Dorman SE, Holland SM (diciembre de 2000). "Defectos de la vía del interferón-gamma e interleucina-12 y enfermedad humana" . Reseñas de citocinas y factores de crecimiento . 11 (4): 321–33. doi : 10.1016 / s1359-6101 (00) 00010-1 . PMID 10959079 .
- ^ Newport MJ, Holanda SM, Levin M, Casanova JL (2007). "Trastornos hereditarios del eje gamma de interleucina-12/23-interferón". En Ochs HD, Smith CI, Puck J (eds.). Enfermedades por inmunodeficiencia primaria: un enfoque molecular y genético . Nueva York: Oxford University Press. págs. 390–401. ISBN 978-0-19-514774-2.
- ^ a b Altare F, Durandy A, Lammas D, Emile JF, Lamhamedi S, Le Deist F, et al. (Mayo de 1998). "Deterioro de la inmunidad micobacteriana en la deficiencia del receptor de interleucina-12 humana". Ciencia . 280 (5368): 1432–5. doi : 10.1126 / science.280.5368.1432 . PMID 9603732 .
- ^ van de Veerdonk FL, Plantinga TS, Hoischen A, Smeekens SP, Joosten LA, Gilissen C, et al. (Julio de 2011). "Mutaciones STAT1 en candidiasis mucocutánea crónica autosómica dominante". La Revista de Medicina de Nueva Inglaterra . 365 (1): 54–61. doi : 10.1056 / NEJMoa1100102 . PMID 21714643 .
Lectura adicional [ editar ]
- Guenova E, Volz T, Sauer K, Kaesler S, Müller MR, Wölbing F y col. (Noviembre de 2008). "Ajuste fino mediado por IL-4 de la producción de IL-12p70 por DC humanas". Revista europea de inmunología . 38 (11): 3138–49. doi : 10.1002 / eji.200838463 . PMID 18924208 .