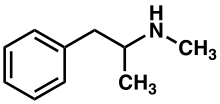
 | |
| Datos clinicos | |
|---|---|
| Pronunciación | / ˌ m ɛ theta æ m f ɛ t əm i n / |
| Nombres comerciales | Desoxyn, Methedrine |
| Otros nombres | N - metilanfetamina , N , α- dimetilfenetilamina , desoxiefedrina |
| AHFS / Drugs.com | Monografía |
| Datos de licencia |
|
| Responsabilidad por dependencia | Físico: Ninguno; Psicológico: Alto |
| Responsabilidad por adicción | Elevado |
| Vías de administración | Médico: oral (ingestión) Recreativo: oral , intravenoso , intramuscular , subcutáneo , inhalación de vapor , insuflación , rectal , vaginal |
| Código ATC | |
| Estatus legal | |
| Estatus legal |
|
| Datos farmacocinéticos | |
| Biodisponibilidad | Oral: 70% [1] IV: 100% [1] |
| Enlace proteico | Varía ampliamente [2] |
| Metabolismo | CYP2D6 [5] [6] y FMO3 [7] [8] |
| Inicio de acción | Rápido [3] |
| Vida media de eliminación | 5 a 30 horas [4] |
| Duración de la acción | 10-20 horas [3] |
| Excreción | Principalmente riñón |
| Identificadores | |
| |
| Número CAS |
|
| PubChem CID | |
| IUPHAR / BPS | |
| DrugBank | |
| ChemSpider | |
| UNII |
|
| KEGG |
|
| CHEBI |
|
| CHEMBL |
|
| Ligando PDB |
|
| Tablero CompTox ( EPA ) |
|
| Tarjeta de información ECHA | 100.007.882 |
| Datos químicos y físicos | |
| Fórmula | C 10 H 15 N |
| Masa molar | 149,237 g · mol −1 |
| Modelo 3D ( JSmol ) |
|
| Quiralidad | Mezcla racémica |
| Punto de fusion | 170 ° C (338 ° F) [9] |
| Punto de ebullición | 212 ° C (414 ° F) a 760 mmHg [9] |
Sonrisas
| |
InChI
| |
| (verificar) | |
La metanfetamina [nota 1] (contraída de N - metilanfetamina ) es un potente sistema nervioso central (CNS) estimulante que se utiliza principalmente como una droga recreativa y menos comúnmente como un tratamiento de segunda línea para el trastorno de hiperactividad por déficit de atención y la obesidad . [15] La metanfetamina se descubrió en 1893 y existe como dos enantiómeros : levo-metanfetamina y dextrometanfetamina. [nota 2] Metanfetamina se refiere propiamente a una sustancia química específica, el racémico base libre , que es una mezcla igual de levometanfetamina y dextrometanfetamina en sus formas de amina pura. Rara vez se prescribe por preocupaciones relacionadas con la neurotoxicidad humana y el potencial de uso recreativo como afrodisíaco y euforizante , entre otras preocupaciones, así como por la disponibilidad de medicamentos sustitutos más seguros con una eficacia de tratamiento comparable. La dextrometanfetamina es un estimulante del SNC más fuerte que la levometanfetamina.
Tanto la metanfetamina racémica como la dextrometanfetamina se trafican y venden ilícitamente debido a su potencial para uso recreativo. La mayor prevalencia del uso ilegal de metanfetamina se produce en partes de Asia y Oceanía, y en los Estados Unidos, donde la metanfetamina racémica y la dextrometanfetamina se clasifican como sustancias controladas de la lista II . La levometanfetamina está disponible como un medicamento de venta libre (OTC) para su uso como descongestionante nasal inhalado en los Estados Unidos. [nota 3] A nivel internacional, la producción, distribución, venta y posesión de metanfetamina está restringida o prohibida en muchos países debido a su inclusión en el anexo II de la Convención de las Naciones Unidas sobre Sustancias Psicotrópicas.tratado. Si bien la dextrometanfetamina es una droga más potente, la metanfetamina racémica se produce ilícitamente con mayor frecuencia debido a la relativa facilidad de síntesis y los límites regulatorios de la disponibilidad de precursores químicos .
En dosis bajas a moderadas, la metanfetamina puede elevar el estado de ánimo , aumentar el estado de alerta, la concentración y la energía en personas fatigadas, reducir el apetito y promover la pérdida de peso. En dosis muy altas, puede inducir psicosis , degradación del músculo esquelético , convulsiones y hemorragia en el cerebro . El uso crónico de dosis altas puede precipitar cambios de humor rápidos e impredecibles , psicosis estimulante (p. Ej., Paranoia , alucinaciones , delirio y delirios ) y comportamiento violento . Recreativamente, la capacidad de la metanfetamina para aumentar la energíaSe ha informado que mejora el estado de ánimo y aumenta el deseo sexual hasta tal punto que los usuarios pueden participar en actividades sexuales de forma continua durante varios días mientras ingieren la droga. [19] Se sabe que la metanfetamina posee un alto riesgo de adicción (es decir, una alta probabilidad de que el uso prolongado o en dosis altas conduzca al uso compulsivo de drogas) y un alto riesgo de dependencia (es decir, una alta probabilidad de que se produzcan síntomas de abstinencia cuando se consume metanfetamina cesa). La abstinencia de metanfetamina después de un uso intensivo puede conducir a un síndrome de abstinencia posaguda , que puede persistir durante meses más allá del período de abstinencia típico. La metanfetamina esneurotóxico para las neuronas dopaminérgicas del mesencéfalo humano en dosis altas. Se ha demostrado que la metanfetamina tiene una mayor afinidad y, como resultado, una mayor toxicidad hacia las neuronas serotoninérgicas que la anfetamina . [20] [21] La neurotoxicidad de la metanfetamina causa cambios adversos en la estructura y función del cerebro, como reducciones en el volumen de materia gris en varias regiones del cerebro, así como cambios adversos en los marcadores de integridad metabólica. [21]
La metanfetamina pertenece a las clases químicas de fenetilamina sustituida y anfetamina sustituida . Está relacionado con las otras dimetilfenetilaminas como isómero posicional de estos compuestos, que comparten la fórmula química común : C 10 H 15 N 1.
Usos
Médico
En los Estados Unidos, el clorhidrato de dextrometanfetamina, bajo el nombre comercial Desoxyn , ha sido aprobado por la FDA para tratar el TDAH y la obesidad tanto en adultos como en niños; [22] [23] sin embargo, la FDA también indica que la utilidad terapéutica limitada de la metanfetamina debe sopesarse con los riesgos inherentes asociados con su uso. [22] En ocasiones, la metanfetamina se prescribe de forma no indicada para la narcolepsia y la hipersomnia idiopática . [24] [25] En los Estados Unidos, forma levógiro de la metanfetamina está disponible en algunos over-the-counter(OTC) descongestionantes nasales . [nota 3]
Como la metanfetamina está asociada con un alto potencial de uso indebido, la droga está regulada por la Ley de Sustancias Controladas y está incluida en el Anexo II en los Estados Unidos. [22] Se requiere que el clorhidrato de metanfetamina dispensado en los Estados Unidos incluya una advertencia en un recuadro con respecto a su potencial de abuso recreativo y responsabilidad por adicción . [22]
Recreativo
La metanfetamina se usa a menudo de forma recreativa por sus efectos como potente euforizante y estimulante, así como por sus cualidades afrodisíacas . [26]
Según un documental de National Geographic TV sobre la metanfetamina, toda una subcultura conocida como fiesta y juego se basa en la actividad sexual y el uso de metanfetamina. [26] Los participantes de esta subcultura, que consiste casi en su totalidad en usuarios de metanfetamina hombres homosexuales, normalmente se encontrarán a través de sitios de citas en Internet y tendrán relaciones sexuales. [26] Debido a sus fuertes efectos estimulantes y afrodisíacos y al efecto inhibidor de la eyaculación , con el uso repetido, estos encuentros sexuales a veces ocurren continuamente durante varios días seguidos. [26] El accidente que sigue al uso de metanfetamina de esta manera es muy a menudo grave, con una marcadahipersomnia (somnolencia diurna excesiva). [26] La subcultura de la fiesta y el juego prevalece en las principales ciudades de Estados Unidos, como San Francisco y Nueva York. [26] [27]
Contraindicaciones
La metanfetamina está contraindicada en personas con antecedentes de trastorno por uso de sustancias , enfermedad cardíaca o agitación o ansiedad severas , o en personas que actualmente padecen arteriosclerosis , glaucoma , hipertiroidismo o hipertensión grave . [22] La FDA establece que las personas que hayan experimentado reacciones de hipersensibilidad a otros estimulantes en el pasado o que estén tomando inhibidores de la monoaminooxidasa no deben tomar metanfetamina. [22] La FDA también aconseja a las personas con trastorno bipolar, depresión , presión arterial elevada , problemas hepáticos o renales, manía , psicosis , fenómeno de Raynaud , convulsiones , problemas de tiroides , tics o síndrome de Tourette para controlar sus síntomas mientras toma metanfetamina. [22] Debido al potencial de retraso en el crecimiento, la FDA aconseja controlar la altura y el peso de los niños y adolescentes en crecimiento durante el tratamiento. [22]
Efectos adversos

Físico
Los efectos físicos de la metanfetamina pueden incluir pérdida de apetito , hiperactividad, pupilas dilatadas , piel enrojecida , sudoración excesiva , aumento de movimiento , sequedad de boca y rechinar de dientes (que conduce a la " boca de metanfetamina "), dolor de cabeza, latidos cardíacos irregulares (generalmente como latidos cardíacos acelerados o más lentos). latidos del corazón ), respiración rápida , presión arterial alta , presión arterial baja , temperatura corporal alta , diarrea, estreñimiento, visión borrosa , mareos ,espasmos , entumecimiento , temblores , piel seca, acné y apariencia pálida . [22] [29] Los consumidores de metanfetamina a largo plazo pueden tener llagas en la piel; [30] [31] [32] estos pueden ser causados por rascarse debido a picazón [31] o la creencia de que los insectos se arrastran debajo de su piel, [30] y el daño se ve agravado por una mala alimentación e higiene. [32] También se han informado numerosas muertes relacionadas con sobredosis de metanfetamina. [33] [34]
Boca de metanfetamina
Los usuarios y adictos a la metanfetamina pueden perder los dientes de manera anormalmente rápida, independientemente de la vía de administración, debido a una afección conocida informalmente como boca de metanfetamina . [35] La afección generalmente es más grave en los usuarios que se inyectan la droga, en lugar de tragarla, fumarla o inhalarla. [35] Según la Asociación Dental Estadounidense , la boca de metanfetamina "probablemente es causada por una combinación de cambios psicológicos y fisiológicos inducidos por medicamentos que resultan en xerostomía (boca seca), períodos prolongados de mala higiene bucal , consumo frecuente de bebidas carbonatadas altas en calorías bebidas y bruxismo (rechinar y apretar los dientes) ". [35] [36]Dado que la boca seca también es un efecto secundario común de otros estimulantes, que no se sabe que contribuyan a la caries dental severa, muchos investigadores sugieren que la caries dental asociada a la metanfetamina se debe más a las otras opciones de los usuarios. Sugieren que el efecto secundario se ha exagerado y estilizado para crear un estereotipo de usuarios actuales como disuasión para los nuevos. [23]
Infección transmitida sexualmente
Se descubrió que el uso de metanfetamina está relacionado con frecuencias más altas de relaciones sexuales sin protección tanto en parejas casuales con VIH como en parejas casuales desconocidas, una asociación más pronunciada en participantes con VIH. [37] Estos hallazgos sugieren que el uso de metanfetamina y la participación en el coito anal sin protección son conductas de riesgo concurrentes, conductas que potencialmente aumentan el riesgo de transmisión del VIH entre hombres homosexuales y bisexuales. [37] El uso de metanfetamina permite a los usuarios de ambos sexos participar en una actividad sexual prolongada, lo que puede causar llagas y abrasiones genitales, así como priapismo en los hombres. [22] [38] La metanfetamina también puede causar llagas y abrasiones en la boca a través del bruxismo., aumentando el riesgo de infecciones de transmisión sexual. [22] [38]
Además de la transmisión sexual del VIH, también puede transmitirse entre usuarios que comparten una misma aguja . [39] El nivel de uso compartido de agujas entre los usuarios de metanfetamina es similar al de otros usuarios de drogas inyectables. [39]
Fatal
Las dosis de 200 mg o más de metanfetamina se consideran fatales. [40]
Psicológico
Los efectos psicológicos de la metanfetamina pueden incluir euforia , disforia , cambios en la libido , estado de alerta , aprensión y concentración , disminución de la sensación de fatiga, insomnio o vigilia , autoconfianza , sociabilidad, irritabilidad, inquietud, grandiosidad y conductas repetitivas y obsesivas . [22] [29] [41] Peculiar a la metanfetamina y estimulantes relacionados se " actos compulsivos ", actividad repetitiva no dirigido a un objetivo persistente. [42]El consumo de metanfetamina también tiene una alta asociación con la ansiedad , la depresión , la psicosis anfetamínica , el suicidio y los comportamientos violentos. [43]
Neurotóxico y neuroinmunológico
La metanfetamina es directamente neurotóxica para las neuronas dopaminérgicas tanto en animales de laboratorio como en humanos. [20] [21] La excitotoxicidad , el estrés oxidativo , el compromiso metabólico, la disfunción del UPS, la nitración de proteínas, el estrés del retículo endoplásmico , la expresión de p53 y otros procesos contribuyeron a esta neurotoxicidad. [47] [48] [49] De acuerdo con su neurotoxicidad dopaminérgica, el uso de metanfetamina se asocia con un riesgo más alto de enfermedad de Parkinson . [50] Además de su neurotoxicidad dopaminérgica, una revisión de la evidencia en humanos indicó que el uso de metanfetamina en dosis altas también puede ser neurotóxico paraneuronas serotoninérgicas . [21] Se ha demostrado que una temperatura central alta se correlaciona con un aumento de los efectos neurotóxicos de la metanfetamina. [51] La abstinencia de metanfetamina en personas dependientes puede llevar a una abstinencia posaguda que persiste meses más allá del período de abstinencia típico. [49]
Los estudios de imágenes por resonancia magnética en usuarios humanos de metanfetamina también han encontrado evidencia de neurodegeneración o cambios neuroplásticos adversos en la estructura y función del cerebro. [21] En particular, la metanfetamina parece causar hiperintensidad e hipertrofia de la sustancia blanca , marcada contracción del hipocampo y reducción de la materia gris en la corteza cingulada , la corteza límbica y la corteza paralímbica en usuarios recreativos de metanfetamina. [21] Además, la evidencia sugiere que los cambios adversos en el nivel de biomarcadoresde la integridad metabólica y la síntesis ocurren en usuarios recreativos, como una reducción en los niveles de N -acetilaspartato y creatina y niveles elevados de colina y mioinositol . [21]
Se ha demostrado que la metanfetamina activa TAAR1 en astrocitos humanos y genera cAMP como resultado. [50] La activación de TAAR1 localizada en astrocitos parece funcionar como un mecanismo por el cual la metanfetamina atenúa los niveles de EAAT2 unida a la membrana (SLC1A2) y funciona en estas células. [50]
La metanfetamina se une y activa ambos subtipos de receptores sigma , σ 1 y σ 2 , con afinidad micromolar. [46] [52] La activación del receptor sigma puede promover la neurotoxicidad inducida por la metanfetamina al facilitar la hipertermia , aumentar la síntesis y liberación de dopamina, influir en la activación microglial y modular las cascadas de señalización apoptótica y la formación de especies reactivas de oxígeno. [46] [52]
Adictivo
| Glosario de adicciones y dependencia [53] [54] [55] [56] | |
|---|---|
| |
Cascada de señalización en el núcleo accumbens que resulta en adicción a psicoestimulantes |
Los modelos actuales de adicción por consumo crónico de drogas implican alteraciones en la expresión génica en ciertas partes del cerebro, particularmente en el núcleo accumbens . [64] [65] Los factores de transcripción más importantes [nota 4] que producen estas alteraciones son ΔFosB , proteína de unión al elemento de respuesta al cAMP ( CREB ) y factor nuclear kappa B ( NFκB ). [65] ΔFosB juega un papel crucial en el desarrollo de adicciones a las drogas, ya que su sobreexpresión en neuronas espinosas medianas de tipo D1 en el núcleo accumbens es necesaria y suficiente [nota 5]para la mayoría de las adaptaciones conductuales y neuronales que surgen de la adicción. [54] [65] [67] Una vez que ΔFosB se sobreexpresa suficientemente, induce un estado adictivo que se vuelve cada vez más grave con aumentos adicionales en la expresión de ΔFosB. [54] [67] Se ha relacionado con adicciones al alcohol , cannabinoides , cocaína , metilfenidato , nicotina , opioides , fenciclidina , propofol y anfetaminas sustituidas , entre otros. [65] [67] [68] [69] [70]
ΔJunD , un factor de transcripción, y G9a , una enzima histona metiltransferasa , ambos se oponen directamente a la inducción de ΔFosB en el núcleo accumbens (es decir, se oponen a aumentos en su expresión). [54] [65] [71] La sobreexpresión suficiente de ΔJunD en el núcleo accumbens con vectores virales puede bloquear por completo muchas de las alteraciones neuronales y conductuales observadas en el uso crónico de drogas (es decir, las alteraciones mediadas por ΔFosB). [65] ΔFosB también juega un papel importante en la regulación de las respuestas conductuales a las recompensas naturales , como la comida apetecible, el sexo y el ejercicio. [65] [68] [72]Dado que tanto las recompensas naturales como las drogas adictivas inducen la expresión de ΔFosB (es decir, hacen que el cerebro produzca más), la adquisición crónica de estas recompensas puede resultar en un estado patológico similar de adicción. [65] [68] ΔFosB es el factor más importante involucrado tanto en la adicción a las anfetaminas como en las adicciones sexuales inducidas por anfetaminas , que son conductas sexuales compulsivas que resultan de la actividad sexual excesiva y el uso de anfetaminas. [nota 6] [68] [73] Estas adicciones sexuales (es decir, conductas sexuales compulsivas inducidas por drogas) están asociadas con un síndrome de desregulación de la dopamina que ocurre en algunos pacientes que toman drogas dopaminérgicas, como anfetamina o metanfetamina. [68] [72] [73]
Factores epigenéticos
La adicción a la metanfetamina es persistente para muchas personas, y el 61% de las personas tratadas por adicción recaen dentro de un año. [74] Aproximadamente la mitad de las personas con adicción a la metanfetamina continúan con el uso durante un período de diez años, mientras que la otra mitad reduce el uso a partir de uno a cuatro años después del uso inicial. [75]
La persistencia frecuente de la adicción sugiere que pueden ocurrir cambios duraderos en la expresión genética en regiones particulares del cerebro y pueden contribuir de manera importante al fenotipo de adicción. Recientemente, se ha descubierto que los mecanismos epigenéticos tienen un papel crucial en la conducción de cambios duraderos en la expresión génica en el cerebro. [76]
Una revisión de 2015 [77] resumió una serie de estudios sobre el uso crónico de metanfetamina en roedores. Se observaron alteraciones epigenéticas en las vías de recompensa del cerebro , incluidas áreas como el área tegmental ventral , el núcleo accumbens y el cuerpo estriado dorsal , el hipocampo y la corteza prefrontal . El uso crónico de metanfetamina provocó acetilaciones, desacetilaciones y metilaciones de histonas específicas de genes . También se observaron metilaciones de ADN específicas de genes en regiones particulares del cerebro. Las diversas alteraciones epigenéticas causaron regulaciones a la baja o al alza.de genes específicos importantes en la adicción. Por ejemplo, el uso crónico de metanfetamina provocó la metilación de la lisina en la posición 4 de la histona 3 ubicada en los promotores de los genes c-fos y del receptor de quimiocinas CC 2 (ccr2) , activando esos genes en el núcleo accumbens (NAc). [77] Se sabe que c-fos es importante en la adicción . [78] El gen ccr2 también es importante en la adicción, ya que la inactivación mutacional de este gen afecta la adicción. [77]
En ratas adictas a la metanfetamina, la regulación epigenética a través de la acetilación reducida de histonas, en las neuronas estriatales del cerebro, provocó una transcripción reducida de los receptores de glutamato . [79] Los receptores de glutamato desempeñan un papel importante en la regulación de los efectos reforzadores del uso indebido de drogas ilícitas. [80]
Tratamiento y manejo
Una revisión sistemática de 2018 y un metanálisis en red de 50 ensayos que incluían 12 intervenciones psicosociales diferentes para la adicción a las anfetaminas, metanfetaminas o cocaína encontraron que la terapia combinada con el manejo de contingencias y el enfoque de refuerzo comunitario tuvo la mayor eficacia (es decir, tasa de abstinencia) y aceptabilidad ( es decir, la tasa de deserción más baja). [81] Otras modalidades de tratamiento examinadas en el análisis incluyeron monoterapia con manejo de contingencias o enfoque de refuerzo comunitario, terapia cognitivo-conductual , programas de 12 pasos , terapias basadas en recompensas no contingentes, terapia psicodinámicay otras terapias combinadas que los involucran. [81]
A diciembre de 2019 [update], no existe una farmacoterapia eficaz para la adicción a la metanfetamina. [82] [83] [84] Una revisión sistemática y un metanálisis de 2019 evaluaron la eficacia de 17 farmacoterapias diferentes utilizadas en ECA para la adicción a las anfetaminas y metanfetaminas; [83] encontró solo evidencia de baja concentración de que el metilfenidato podría reducir la autoadministración de anfetaminas o metanfetaminas. [83] Hubo evidencia de concentración baja a moderada de ningún beneficio para la mayoría de los otros medicamentos utilizados en los ECA, que incluían antidepresivos (bupropión, mirtazapina , sertralina ), antipsicóticos ( aripiprazol ), anticonvulsivos (topiramato , baclofeno , gabapentina ), naltrexona , vareniclina , citicolina , ondansetrón , prometa , riluzol , atomoxetina , dextroanfetamina y modafinilo . [83]
Dependencia y abstinencia
Se espera que la tolerancia se desarrolle con el uso regular de metanfetamina y, cuando se usa de forma recreativa, esta tolerancia se desarrolla rápidamente. [85] [86] En los consumidores dependientes, los síntomas de abstinencia se correlacionan positivamente con el nivel de tolerancia al fármaco. [87] La depresión por abstinencia de metanfetamina dura más y es más grave que la de abstinencia de cocaína . [88]
Según la revisión Cochrane actual sobre dependencia y abstinencia de drogas en consumidores recreativos de metanfetamina, "cuando los consumidores crónicos intensos interrumpen abruptamente el uso de [metanfetamina], muchos informan de un síndrome de abstinencia por tiempo limitado que se produce dentro de las 24 horas posteriores a la última dosis". [87] Los síntomas de abstinencia en usuarios crónicos de dosis altas son frecuentes, ocurren en hasta 87,6% de los casos y persisten durante tres a cuatro semanas con una fase marcada de "choque" que ocurre durante la primera semana. [87] Los síntomas de abstinencia de la metanfetamina pueden incluir ansiedad, ansia por las drogas , estado de ánimo disfórico , fatiga , aumento del apetito , aumento del movimientoo disminución del movimiento , falta de motivación , insomnio o somnolencia y sueños vívidos o lúcidos . [87]
La metanfetamina que está presente en el torrente sanguíneo de la madre puede pasar a través de la placenta al feto y ser secretada en la leche materna . [88] Los bebés nacidos de madres que abusan de la metanfetamina pueden experimentar un síndrome de abstinencia neonatal , con síntomas que incluyen patrones de sueño anormales, mala alimentación, temblores e hipertonía . [88] Este síndrome de abstinencia es relativamente leve y solo requiere intervención médica en aproximadamente el 4% de los casos. [88]
| Forma de neuroplasticidad o plasticidad conductual. | Tipo de reforzador | Fuentes | |||||
|---|---|---|---|---|---|---|---|
| Opiáceos | Psicoestimulantes | Alimentos ricos en grasas o azúcares | Relaciones sexuales | Ejercicio físico (aeróbico) | Enriquecimiento ambiental | ||
| Expresión de ΔFosB en MSN de tipo D1 del núcleo accumbens | ↑ | ↑ | ↑ | ↑ | ↑ | ↑ | [68] |
| Plasticidad conductual | |||||||
| Escalada de ingesta | sí | sí | sí | [68] | |||
| Sensibilización cruzada con psicoestimulantes | sí | No aplica | sí | sí | Atenuado | Atenuado | [68] |
| Psicoestimulantes autoadministración | ↑ | ↑ | ↓ | ↓ | ↓ | [68] | |
| Preferencia de lugar condicionada por psicoestimulantes | ↑ | ↑ | ↓ | ↑ | ↓ | ↑ | [68] |
| Restablecimiento del comportamiento de búsqueda de drogas | ↑ | ↑ | ↓ | ↓ | [68] | ||
| Plasticidad neuroquímica | |||||||
| Fosforilación de CREB en el núcleo accumbens | ↓ | ↓ | ↓ | ↓ | ↓ | [68] | |
| Respuesta de dopamina sensibilizada en el núcleo accumbens | No | sí | No | sí | [68] | ||
| Señalización de dopamina estriatal alterada | ↓ DRD2 , ↑ DRD3 | ↑ DRD1 , ↓ DRD2 , ↑ DRD3 | ↑ DRD1 , ↓ DRD2 , ↑ DRD3 | ↑ DRD2 | ↑ DRD2 | [68] | |
| Señalización de opioides estriatal alterada | Sin cambios o con ↑ μ-receptores opioides | ↑ receptores μ-opioides ↑ receptores κ-opioides | ↑ receptores μ-opioides | ↑ receptores μ-opioides | Ningún cambio | Ningún cambio | [68] |
| Cambios en los péptidos opioides estriatales | ↑ dinorfina Sin cambios: encefalina | ↑ dinorfina | ↓ encefalina | ↑ dinorfina | ↑ dinorfina | [68] | |
| Plasticidad sináptica mesocorticolímbica | |||||||
| Número de dendritas en el núcleo accumbens | ↓ | ↑ | ↑ | [68] | |||
| Densidad de la columna dendrítica en el núcleo accumbens | ↓ | ↑ | ↑ | [68] | |||
Neonatal
A diferencia de otras drogas, los bebés con exposición prenatal a las metanfetaminas no muestran signos inmediatos de abstinencia. En cambio, los problemas cognitivos y de comportamiento comienzan a surgir cuando los niños llegan a la edad escolar. [89]
Un estudio de cohorte prospectivo de 330 niños mostró que a la edad de 3 años, los niños con exposición a la metanfetamina mostraban una mayor reactividad emocional, así como más signos de ansiedad y depresión; y a la edad de 5, los niños mostraron tasas más altas de externalización y trastornos de déficit de atención / hiperactividad. Un estudio de cohorte prospectivo de 330 niños mostró que a la edad de 3, los niños con exposición a la metanfetamina mostraron una mayor reactividad emocional, así como más signos de ansiedad y depresión; ya la edad de 5 años, los niños mostraron tasas más altas de trastornos por déficit de atención e hiperactividad y externalización . [90]
Sobredosis
Una sobredosis de metanfetamina puede provocar una amplia gama de síntomas. [4] [22] Una sobredosis moderada de metanfetamina puede provocar síntomas como: ritmo cardíaco anormal , confusión, dificultad para orinar o dolor al orinar , presión arterial alta o baja, temperatura corporal alta , reflejos hiperactivos o hiperactivos , dolores musculares , agitación intensa , respiración rápida , temblores , dificultad para orinar e incapacidad para orinar . [4] [29] Una sobredosis extremadamente grande puede producir síntomas como tormenta adrenérgica, psicosis de metanfetamina , producción de orina sustancialmente reducida o nula , shock cardiogénico , sangrado en el cerebro , colapso circulatorio , hiperpirexia (es decir, temperatura corporal peligrosamente alta), hipertensión pulmonar , insuficiencia renal , degradación rápida de los músculos , síndrome serotoninérgico y una forma de estereotipia ("retocar"). [fuentes 1] Una sobredosis de metanfetamina probablemente también resultará en daño cerebral leve debido a la neurotoxicidad dopaminérgica y serotoninérgica .[94] [21] La muerte por intoxicación por metanfetamina suele estar precedida por convulsiones y coma . [22]
Psicosis
El uso de metanfetamina puede resultar en una psicosis estimulante que puede presentarse con una variedad de síntomas (p. Ej., Paranoia , alucinaciones , delirio y delirios ). [4] [95] Una revisión de la Colaboración Cochrane sobre el tratamiento de la psicosis inducida por el uso de anfetaminas, dextroanfetaminas y metanfetaminas indica que alrededor del 5 al 15% de los usuarios no se recuperan por completo. [95] [96] La misma revisión afirma que, según al menos un ensayo, los medicamentos antipsicóticos resuelven eficazmente los síntomas de la psicosis anfetamínica aguda. [95] Psicosis anfetamínicatambién puede desarrollarse ocasionalmente como un efecto secundario emergente del tratamiento. [97]
Tratamiento de emergencia
La intoxicación aguda por metanfetamina se maneja en gran medida mediante el tratamiento de los síntomas y los tratamientos pueden incluir inicialmente la administración de carbón activado y sedación . [4] No hay suficiente evidencia sobre hemodiálisis o diálisis peritoneal en casos de intoxicación por metanfetamina para determinar su utilidad. [22] La diuresis ácida forzada (p. Ej., Con vitamina C ) aumentará la excreción de metanfetamina, pero no se recomienda ya que puede aumentar el riesgo de agravar la acidosis o causar convulsiones o rabdomiólisis. [4] La hipertensión presenta un riesgo de hemorragia intracraneal.(es decir, hemorragia en el cerebro) y, si es grave, normalmente se trata con fentolamina o nitroprusiato por vía intravenosa . [4] La presión arterial a menudo desciende gradualmente después de una sedación suficiente con una benzodiazepina y proporciona un ambiente relajante. [4]
Los antipsicóticos como el haloperidol son útiles para tratar la agitación y la psicosis por sobredosis de metanfetamina. [98] [99] Los betabloqueantes con propiedades lipofílicas y penetración en el SNC, como el metoprolol y el labetalol, pueden ser útiles para tratar la toxicidad cardiovascular y del SNC. [100] El bloqueador alfa y beta mixto labetalol es especialmente útil para el tratamiento de la taquicardia concomitante y la hipertensión inducida por metanfetamina. [98] No se ha informado del fenómeno de "estimulación alfa sin oposición" con el uso de betabloqueantes para el tratamiento de la toxicidad de la metanfetamina. [98]
Interacciones
La metanfetamina es metabolizada por la enzima hepática CYP2D6 , por lo que los inhibidores de CYP2D6 prolongarán la vida media de eliminación de la metanfetamina. [101] La metanfetamina también interactúa con los inhibidores de la monoaminooxidasa (IMAO), ya que tanto los IMAO como la metanfetamina aumentan las catecolaminas plasmáticas; por lo tanto, el uso simultáneo de ambos es peligroso. [22] La metanfetamina puede disminuir los efectos de los sedantes y depresores y también aumentar los efectos de los antidepresivos y otros estimulantes . [22] La metanfetamina puede contrarrestar los efectos deantihipertensivos y antipsicóticos debido a sus efectos sobre el sistema cardiovascular y la cognición, respectivamente. [22] El pH del contenido gastrointestinal y la orina afecta la absorción y excreción de metanfetamina. [22] Específicamente, las sustancias ácidas reducirán la absorción de metanfetamina y aumentarán la excreción urinaria, mientras que las sustancias alcalinas harán lo contrario. [22] Debido al efecto que tiene el pH sobre la absorción , se sabe que los inhibidores de la bomba de protones , que reducen el ácido gástrico , interactúan con la metanfetamina. [22]
Farmacología

Farmacodinamia
La metanfetamina ha sido identificada como un potente agonista completo del receptor 1 asociado a trazas de amina (TAAR1), un receptor acoplado a proteína G (GPCR) que regula los sistemas de catecolaminas cerebrales . [102] [103] La activación de TAAR1 aumenta la producción de monofosfato de adenosina cíclico (cAMP) e inhibe por completo o invierte la dirección de transporte del transportador de dopamina (DAT), transportador de norepinefrina (NET) y transportador de serotonina (SERT). [102] [104] Cuando la metanfetamina se une a TAAR1, desencadena la fosforilación del transportadora través de la señalización de la proteína quinasa A (PKA) y la proteína quinasa C (PKC), lo que finalmente da como resultado la internalización o función inversa de los transportadores de monoamina . [102] [105] También se sabe que la metanfetamina aumenta el calcio intracelular, un efecto que se asocia con la fosforilación de DAT a través de una vía de señalización dependiente de la proteína quinasa dependiente de Ca2 + / calmodulina (CAMK), que a su vez produce un flujo de salida de dopamina. [106] [107] [108] TAAR1 se ha demostrado para reducir la tasa de disparo de las neuronas a través de la activación directa de G acoplados a proteínas canales de potasio hacia el interior de rectificación .[109] [110] [111] La activación de TAAR1 por la metanfetamina en los astrocitos parece modular negativamente la expresión y función de la membrana de EAAT2 , un tipo de transportador de glutamato . [50]
Además de su efecto sobre los transportadores de monoaminas de la membrana plasmática, la metanfetamina inhibe la función de las vesículas sinápticas al inhibir VMAT2 , lo que evita la captación de monoaminas en las vesículas y promueve su liberación. [112] Esto da como resultado la salida de monoaminas de las vesículas sinápticas al citosol (líquido intracelular) de la neurona presináptica y su posterior liberación a la hendidura sináptica por los transportadores fosforilados. [113] Otros transportadores que se sabe que inhibe la metanfetamina son SLC22A3 y SLC22A5 . [112]SLC22A3 es un transportador de monoamina extraneuronal que está presente en los astrocitos y SLC22A5 es un transportador de carnitina de alta afinidad . [103] [114]
La metanfetamina también es un agonista de los receptores alfa-2 adrenérgicos y de los receptores sigma con mayor afinidad por σ 1 que por σ 2 , e inhibe la monoamino oxidasa A (MAO-A) y la monoamino oxidasa B (MAO-B). [46] [103] [52] La activación del receptor sigma por la metanfetamina puede facilitar sus efectos estimulantes del sistema nervioso central y promover la neurotoxicidad dentro del cerebro. [46] [52] La dextrometanfetamina es un psicoestimulante más fuerte , pero la levometanfetamina tieneefectos periféricos , una vida media más prolongada y efectos percibidos más prolongados entre los adictos. [115] [116] [117] En dosis altas, ambos enantiómeros de metanfetamina pueden inducir estereotipias y psicosis de metanfetamina similares , [116] pero la levometanfetamina tiene efectos psicodinámicos más breves. [117]
Farmacocinética
Después de la administración oral, la metanfetamina se absorbe bien en el torrente sanguíneo y las concentraciones plasmáticas máximas de metanfetamina se alcanzan en aproximadamente 3,13 a 6,3 horas después de la ingestión. [118] La metanfetamina también se absorbe bien después de la inhalación y después de la administración intranasal. [4] Debido a la alta lipofilia de la metanfetamina, puede atravesar fácilmente la barrera hematoencefálica más rápido que otros estimulantes, donde es más resistente a la degradación por la monoamino oxidasa . [4] [118] El metabolito de la anfetamina alcanza su punto máximo entre las 10 y las 24 horas. [4] La metanfetamina se excreta por los riñones, y la velocidad de excreción en la orina está muy influenciada por el pH urinario.[22] [118] Cuando se toma por vía oral, 30 a 54% de la dosis se excreta en la orina como metanfetamina y 10 a 23% como anfetamina. [118] Después de las dosis intravenosas, alrededor del 45% se excreta como metanfetamina y el 7% como anfetamina. [118] La vida media de la metanfetamina es variable con un rango de 5 a 30 horas. [4]
CYP2D6 , dopamina β-hidroxilasa , monooxigenasa 3 que contiene flavina , butirato-CoA ligasa y glicina N-aciltransferasa son las enzimas conocidas por metabolizar la metanfetamina o sus metabolitos en humanos. [fuentes 2] Los metabolitos primarios son anfetamina y 4-hidroximetanfetamina ; [118] Otros metabolitos menores incluyen: 4-hidroxianfetamina , 4-hidroxinorrefedrina , 4-hidroxifenilacetona , ácido benzoico , ácido hipúrico , norefedrina y fenilacetona., los metabolitos de la anfetamina. [6] [118] [119] Entre estos metabolitos, los simpaticomiméticos activos son anfetamina, 4-hidroxianfetamina , [125] 4-hidroxinorrefedrina , [126] 4-hidroximetanfetamina , [118] y norefedrina. [127] La metanfetamina es un inhibidor de CYP2D6. [101]
Las principales vías metabólicas implican parahidroxilación aromática, alfa y beta hidroxilación alifática, N-oxidación, N-desalquilación y desaminación. [6] [118] [128] Las vías metabólicas conocidas incluyen:
Vías metabólicas de la metanfetamina en humanos [fuentes 2] |
Detección en fluidos biológicos
La metanfetamina y la anfetamina a menudo se miden en orina o sangre como parte de una prueba de drogas para deportes, empleo, diagnóstico de intoxicaciones y análisis forense. [131] [132] [133] [134] Se pueden emplear técnicas quirales para ayudar a distinguir la fuente de la droga y determinar si se obtuvo de manera ilícita o legal mediante prescripción médica o profármaco. [135] La separación quiral es necesaria para evaluar la posible contribución de la levometanfetamina , que es un ingrediente activo en algunos descongestionantes nasales de venta libre, [nota 3] hacia un resultado positivo de la prueba. [135] [136] [137]Los suplementos dietéticos de zinc pueden enmascarar la presencia de metanfetamina y otros medicamentos en la orina. [138]
Química
La metanfetamina es un compuesto quiral con dos enantiómeros, dextrometanfetamina y levometanfetamina. A temperatura ambiente, la base libre de la metanfetamina es un líquido transparente e incoloro con un olor característico de las hojas de geranio . [9] Es soluble en éter dietílico y etanol , así como miscible con cloroformo . [9]
Por el contrario, la sal de clorhidrato de metanfetamina es inodoro y tiene un sabor amargo. [9] Tiene un punto de fusión entre 170 y 175 ° C (338 y 347 ° F) y, a temperatura ambiente, se presenta como cristales blancos o un polvo cristalino blanco . [9] La sal de clorhidrato también es libremente soluble en etanol y agua. [9] Su estructura cristalina es monoclínica con grupo espacial P2 1 ; a 90 K (-183,2 ° C; -297,7 ° F), tiene parámetros de red a = 7,10 Å , b = 7,29 Å, c = 10,81 Å y β = 97,29 °. [139]
Degradación
Un estudio de 2011 sobre la destrucción de metanfetamina usando lejía mostró que la efectividad está correlacionada con el tiempo de exposición y la concentración. [140] Un estudio de un año (también de 2011) mostró que la metanfetamina en el suelo es un contaminante persistente. [141] En un estudio de 2013 de biorreactores en aguas residuales , se descubrió que la metanfetamina se degradaba en gran medida en 30 días bajo exposición a la luz. [142]
Síntesis
La metanfetamina racémica puede prepararse partiendo de fenilacetona mediante el método de aminación de Leuckart [143] o reductivo . [144] En la reacción de Leuckart, un equivalente de fenilacetona se hace reaccionar con dos equivalentes de N -methylformamide para producir el formil amida de metanfetamina, más dióxido de carbono y metilamina como productos secundarios. [144] En esta reacción, se forma un catión iminio como intermedio que se reduce con el segundo equivalente de N -metilformamida . [144]La formilamida intermedia se hidroliza luego en condiciones acuosas ácidas para producir metanfetamina como producto final. [144] Alternativamente, la fenilacetona se puede hacer reaccionar con metilamina en condiciones reductoras para producir metanfetamina. [144]


Historia, sociedad y cultura
La anfetamina, descubierta antes que la metanfetamina, fue sintetizada por primera vez en 1887 en Alemania por el químico rumano Lazăr Edeleanu, quien la llamó fenilisopropilamina . [147] [148] Poco después, la metanfetamina fue sintetizada a partir de efedrina en 1893 por el químico japonés Nagai Nagayoshi . [149] Tres décadas más tarde, en 1919, el farmacólogo Akira Ogata sintetizó el clorhidrato de metanfetamina mediante la reducción de efedrina utilizando fósforo rojo y yodo . [150]
Desde 1938, la metanfetamina se comercializó a gran escala en Alemania como medicamento de venta libre bajo la marca Pervitin , producido por la compañía farmacéutica Temmler con sede en Berlín . [151] [152] Fue utilizado por todas las ramas de las fuerzas armadas combinadas de la Wehrmacht del Tercer Reich , por sus efectos estimulantes y para inducir una vigilia prolongada . [153] [154] Pervitin se hizo conocido coloquialmente entre las tropas alemanas como " Stuka -Tablets" ( Stuka-Tabletten ) y " Herman-Göring -Pills" ( Hermann-Göring-Pillen). Los efectos secundarios fueron tan graves que el ejército redujo drásticamente su uso en 1940. [155] Para 1941, el uso estaba restringido a la prescripción médica y el ejército controlaba estrictamente su distribución. Los soldados solo recibirían un par de tabletas a la vez y se les disuadió de usarlas en combate. El historiador Lukasz Kamienski dice: "Un soldado que iba a la batalla en Pervitin generalmente se encontraba incapaz de desempeñarse de manera efectiva durante uno o dos días. Sufría de una resaca de drogas y parecía más un zombi que un gran guerrero, tuvo que recuperarse de los efectos secundarios. . " Algunos soldados se volvieron muy violentos y cometieron crímenes de guerra contra civiles; otros atacaron a sus propios oficiales. [155]
Al final de la guerra, se usó como parte de una nueva droga: D-IX .
Obetrol , patentado por Obetrol Pharmaceuticals en la década de 1950 e indicado para el tratamiento de la obesidad , fue una de las primeras marcas de productos farmacéuticos de metanfetamina. [156] Debido a los efectos psicológicos y estimulantes de la metanfetamina, Obetrol se convirtió en una píldora de dieta popular en Estados Unidos en las décadas de 1950 y 1960. [156] Finalmente, cuando se conocieron las propiedades adictivas de la droga, los gobiernos comenzaron a regular estrictamente la producción y distribución de metanfetamina. [148] Por ejemplo, a principios de la década de 1970 en los Estados Unidos, la metanfetamina se convirtió en una sustancia controlada de la Lista II en virtud de la Ley de Sustancias Controladas . [157]Actualmente, la metanfetamina se vende bajo el nombre comercial Desoxyn , marca registrada de la compañía farmacéutica danesa Lundbeck . [158] En enero de 2013, la marca registrada Desoxyn se había vendido a la empresa farmacéutica italiana Recordati. [159]
Tráfico
El Triángulo Dorado (sudeste asiático) , específicamente el estado de Shan , Myanmar, es el principal productor mundial de metanfetamina, ya que la producción se ha trasladado a Yaba y metanfetamina cristalina, incluso para la exportación a los Estados Unidos y a todo el este y sudeste de Asia y el Pacífico. [160]
En cuanto a la acelerada producción de drogas sintéticas en la región, se entiende que el sindicato chino cantonés Sam Gor , también conocido como The Company, es el principal sindicato internacional del crimen responsable de este cambio. [161] Está formado por miembros de cinco tríadas diferentes. Sam Gor está principalmente involucrado en el tráfico de drogas, ganando al menos $ 8 mil millones por año. [162] Se alega que Sam Gor controla el 40% del mercado de metanfetamina de Asia y el Pacífico, mientras que también trafica heroína y ketamina.. La organización está activa en una variedad de países, incluidos Myanmar, Tailandia, Nueva Zelanda, Australia, Japón, China y Taiwán. Sam Gor anteriormente producía metanfetamina en el sur de China y ahora se cree que fabrica principalmente en el Triángulo Dorado , específicamente en el estado de Shan, Myanmar, responsable de gran parte del aumento masivo de metanfetamina cristalina en los últimos años. [163] Se entiende que el grupo está encabezado por Tse Chi Lop , un gángster nacido en Guangzhou , China , que también tiene un pasaporte canadiense.
Estatus legal
La producción, distribución, venta y posesión de metanfetamina está restringida o es ilegal en muchas jurisdicciones . [164] [165] La metanfetamina se ha incluido en la lista II del tratado de la Convención de las Naciones Unidas sobre Sustancias Sicotrópicas . [165]
Investigar
Se ha sugerido, en base a la investigación con animales, que el calcitriol, el metabolito activo de la vitamina D , puede proporcionar una protección significativa contra los efectos de reducción de DA y 5-HT de las dosis neurotóxicas de metanfetamina. [166]
Ver también
- 18-MC
- Breaking Bad , una serie de televisión centrada en la síntesis ilícita de metanfetaminas
- Faces of Meth , un proyecto de prevención de drogas
- Metanfetamina en Australia
- Metanfetamina en Bangladesh
- Metanfetamina en Filipinas
- Metanfetamina en los Estados Unidos
- Montana Meth Project , una organización con sede en Montana que tiene como objetivo reducir el uso de metanfetamina entre los adolescentes
- Rolling meth lab , un laboratorio transportable que se utiliza para producir metanfetamina ilegalmente
- Ya ba , tabletas del sudeste asiático que contienen una mezcla de metanfetamina y cafeína
Notas explicatorias
- ^ Los sinónimos y las grafías alternativas incluyen: N -metilanfetamina, desoxiefedrina, Syndrox, Methedrine y Desoxyn. [10] [11] [12] Los términos del argot común para la metanfetamina incluyen: speed , meth , crystal , crystal meth , glass , shards , ice y tic [13] y, en Nueva Zelanda, "P". [14]
- ^ Los enantiómeros son moléculas que son imágenes especulares entre sí; son estructuralmente idénticos, pero de orientación opuesta.
La levometanfetamina y la dextrometanfetamina también se conocen como L-metanfetamina , ( R ) -metanfetamina o levmetamfetamina ( denominación común internacional [DCI]) y D-metanfetamina , ( S ) -metanfetamina o metanfetamina ( DCI ), respectivamente. [10] [16] - ^ a b c El ingrediente activo en algunos inhaladores de venta libre en los Estados Unidos está listado como levmetamfetamina , el INN y USAN de la levometanfetamina. [17] [18]
- ^ Los factores de transcripción son proteínas que aumentan o disminuyen la expresión de genes específicos. [66]
- ^ En términos más simples, esta relación necesaria y suficiente significa que la sobreexpresión de ΔFosB en el núcleo accumbens y las adaptaciones conductuales y neuronales relacionadas con la adicción siempre ocurren juntas y nunca ocurren solas.
- ^ La investigación asociada solo involucró anfetamina, no metanfetamina; sin embargo, esta declaración se incluye aquí debido a la similitud entre la farmacodinámica y los efectos afrodisíacos de la anfetamina y la metanfetamina.
- Leyenda de la imagen
- ^ Canal de ionesProteínas G y receptores ligados(Color del texto) Factores de transcripción
Notas de referencia
- ^ [4] [22] [29] [41] [91] [92] [93]
- ^ a b [5] [6] [7] [8] [118] [119] [120] [121] [122] [123] [124]
Referencias
- ↑ a b Rau T, Ziemniak J, Poulsen D (2015). "El potencial neuroprotector de la metanfetamina en dosis bajas en modelos preclínicos de accidente cerebrovascular y lesión cerebral traumática" . Prog. Neuropsychopharmacol. Biol. Psiquiatría . 64 : 231–6. doi : 10.1016 / j.pnpbp.2015.02.013 . PMID 25724762 .
En los seres humanos, la biodisponibilidad oral de la metanfetamina es aproximadamente del 70%, pero aumenta al 100% después de la administración intravenosa (IV) (Ares-Santos et al., 2013).
- ^ "Toxicidad" . Metanfetamina . Compuesto PubChem . Centro Nacional de Información Biotecnológica.
- ↑ a b Riviello RJ (2010). Manual de medicina forense de emergencia: una guía para médicos . Sudbury, Mass .: Jones and Bartlett Publishers. pag. 41. ISBN 978-0-7637-4462-5. Archivado desde el original el 18 de marzo de 2017 . Consultado el 4 de septiembre de 2017 .
- ^ a b c d e f g h i j k l m Schep LJ, Slaughter RJ, Beasley DM (agosto de 2010). "La toxicología clínica de la metamfetamina". Toxicología clínica . 48 (7): 675–694. doi : 10.3109 / 15563650.2010.516752 . ISSN 1556-3650 . PMID 20849327 . S2CID 42588722 .
- ↑ a b Sellers EM, Tyndale RF (2000). "Imitación de defectos genéticos para tratar la drogodependencia". Ana. NY Acad. Sci . 909 (1): 233–246. Código bibliográfico : 2000NYASA.909..233S . doi : 10.1111 / j.1749-6632.2000.tb06685.x . PMID 10911933 . S2CID 27787938 .
La metanfetamina, una droga estimulante del sistema nervioso central, es p-hidroxilada por CYP2D6 a p-OH-metanfetamina menos activa.
- ^ a b c d "Información de prescripción de Adderall XR" (PDF) . Administración de Drogas y Alimentos de los Estados Unidos . Shire US Inc. Diciembre de 2013. págs. 12–13. Archivado (PDF) desde el original el 30 de diciembre de 2013 . Consultado el 30 de diciembre de 2013 .
- ↑ a b Krueger SK, Williams DE (junio de 2005). "Monooxigenasas que contienen flavina de mamíferos: estructura / función, polimorfismos genéticos y papel en el metabolismo de fármacos" . Pharmacol. Ther . 106 (3): 357–387. doi : 10.1016 / j.pharmthera.2005.01.001 . PMC 1828602 . PMID 15922018 .
Tabla 5: Medicamentos que contienen N y xenobióticos oxigenados por FMO Archivado el 16 de septiembre de 2018 en Wayback Machine - ↑ a b Cashman JR, Xiong YN, Xu L, Janowsky A (marzo de 1999). "N-oxigenación de anfetamina y metanfetamina por la monooxigenasa que contiene flavina humana (forma 3): papel en la bioactivación y desintoxicación". J. Pharmacol. Exp. Ther . 288 (3): 1251-1260. PMID 10027866 .
- ^ a b c d e f g "Propiedades químicas y físicas" . Metanfetamina . Compuesto PubChem . Centro Nacional de Información Biotecnológica.
- ^ a b "Metanfetamina" . Perfiles de fármacos . Observatorio Europeo de las Drogas y las Toxicomanías (OEDT). 8 de enero de 2015. Archivado desde el original el 15 de abril de 2016 . Consultado el 27 de noviembre de 2018 .
El término metanfetamina (la denominación común internacional: DCI) se relaciona estrictamente con el enantiómero específico (S) -N, α-dimetilbencenoetanamina.
- ^ "Identificación" . Metanfetamina . DrugBank . Universidad de Alberta. 8 de febrero de 2013.
- ^ "Metedrina (clorhidrato de metanfetamina): usos, síntomas, signos y tratamiento de la adicción" . Addictionlibrary.org . Archivado desde el original el 4 de marzo de 2016 . Consultado el 16 de enero de 2016 .
- ^ "Nombres de jerga de metanfetamina" . MethhelpOnline . Archivado desde el original el 7 de diciembre de 2013 . Consultado el 1 de enero de 2014 .
- ^ "Metanfetamina y la ley" . Archivado desde el original el 28 de enero de 2015 . Consultado el 30 de diciembre de 2014 .
- ^ Yu S, Zhu L, Shen Q, Bai X, Di X (marzo de 2015). "Avances recientes en los mecanismos de neurotoxicidad de la metanfetamina y su fisiopatología molecular" . Behav. Neurol . 2015 : 103969. doi : 10.1155 / 2015/103969 . PMC 4377385 . PMID 25861156 .
En 1971, la ley de EE. UU. Restringió la METH, aunque la METH oral (Ovation Pharmaceuticals) sigue utilizándose hoy en EE. UU. Como tratamiento de segunda línea para una serie de afecciones médicas, incluido el trastorno por déficit de atención con hiperactividad (TDAH) y la obesidad refractaria [ 3].
- ^ "Levometanfetamina" . Compuesto Pubchem . Centro Nacional de Información Biotecnológica. Archivado desde el original el 6 de octubre de 2014 . Consultado el 27 de noviembre de 2018 .
- ^ "Parte 341 - productos para el resfriado, tos, alergias, broncodilatadores y antiasmáticos para uso humano sin receta" . Código de Regulaciones Federales Título 21: Subcapítulo D - Medicamentos para uso humano . Administración de Drogas y Alimentos de los Estados Unidos . Abril de 2015.
Descongestionantes nasales tópicos: (i) Para productos que contienen levmetamfetamina identificados en 341.20 (b) (1) cuando se usan en forma de dosis inhalantes.
El producto entrega en cada 800 mililitros de aire de 0.04 a 0.150 miligramos de levmetamfetamina.
- ^ "Identificación" . Levometanfetamina . Compuesto Pubchem . Centro Nacional de Información Biotecnológica.
- ^ "El efecto afrodisíaco de la metanfetamina aumenta el atractivo de la droga" . NBC News . Associated Press. 3 de diciembre de 2004. Archivado desde el original el 12 de agosto de 2013 . Consultado el 12 de septiembre de 2019 .
- ↑ a b Yu S, Zhu L, Shen Q, Bai X, Di X (2015). "Avances recientes en los mecanismos de neurotoxicidad de la metanfetamina y su fisiopatología molecular" . Behav Neurol . 2015 : 1–11. doi : 10.1155 / 2015/103969 . PMC 4377385 . PMID 25861156 .
- ↑ a b c d e f g h Krasnova IN, Cadet JL (mayo de 2009). "Toxicidad de la metanfetamina y mensajeros de la muerte" . Brain Res. Rev . 60 (2): 379–407. doi : 10.1016 / j.brainresrev.2009.03.002 . PMC 2731235 . PMID 19328213 .
Los estudios de neuroimagen han revelado que METH de hecho puede causar cambios neurodegenerativos en el cerebro de los adictos humanos (Aron y Paulus, 2007; Chang et al., 2007). Estas anomalías incluyen disminuciones persistentes en los niveles de transportadores de dopamina (DAT) en la corteza orbitofrontal, la corteza prefrontal dorsolateral y el caudado-putamen (McCann et al., 1998, 2008; Sekine et al., 2003; Volkow et al., 2001a, 2001c). La densidad de los transportadores de serotonina (5-HTT) también está disminuida en el mesencéfalo, el caudado, el putamen, el hipotálamo, el tálamo, las cortezas orbitofrontal, temporal y cingulada de los individuos dependientes de METH (Sekine et al., 2006) ...
Neuropsicológico Los estudios han detectado déficits en la atención, la memoria de trabajo y la toma de decisiones en adictos crónicos a METH ...
Existe evidencia convincente de que las consecuencias neuropsiquiátricas negativas del abuso de METH se deben, al menos en parte, a cambios neuropatológicos inducidos por fármacos en los cerebros de estos individuos expuestos a METH ...
Los estudios de imágenes de resonancia magnética estructural (IRM) en adictos a METH han revelado cambios morfológicos sustanciales en sus cerebros. Estos incluyen pérdida de materia gris en las cortezas cingulada, límbica y paralímbica, encogimiento significativo del hipocampo e hipertrofia de la sustancia blanca (Thompson et al., 2004). Además, los cerebros de los abusadores de METH muestran evidencia de hiperintensidades en la sustancia blanca (Bae et al., 2006; Ernst et al., 2000), disminuciones en el marcador neuronal, N-acetylaspartate (Ernst et al., 2000; Sung et al., 2000). al., 2007), reducciones en un marcador de integridad metabólica, creatina (Sekine et al., 2002) y aumentos en un marcador de activación glial, mioinositol (Chang et al., 2002; Ernst et al., 2000; Sung et al., 2000). al., 2007; Yen et al., 1994). Niveles elevados de colina,que son indicativos de una mayor síntesis y renovación de la membrana celular también son evidentes en la materia gris frontal de los abusadores de METH (Ernst et al., 2000; Salo et al., 2007; Taylor et al., 2007). - ^ a b c d e f g h i j k l m n o p q r s t u v w "Información de prescripción de Desoxyn" (PDF) . Administración de Drogas y Alimentos de los Estados Unidos . Diciembre de 2013. Archivado (PDF) desde el original el 2 de enero de 2014 . Consultado el 6 de enero de 2014 .
- ^ a b Hart CL, Marvin CB, Silver R, Smith EE (febrero de 2012). "¿El funcionamiento cognitivo está alterado en los usuarios de metanfetamina? Una revisión crítica" . Neuropsicofarmacología . 37 (3): 586–608. doi : 10.1038 / npp.2011.276 . PMC 3260986 . PMID 22089317 .
- ^ Mitler MM, Hajdukovic R, Erman MK (1993). "Tratamiento de la narcolepsia con metanfetamina" . Duerme . 16 (4): 306–317. PMC 2267865 . PMID 8341891 .
- ^ Morgenthaler TI, Kapur VK, Brown T, Swick TJ, Alessi C, Aurora RN, Boehlecke B, Chesson AL Jr, Friedman L, Maganti R, Owens J, Pancer J, Zak R, Comité de Estándares de Práctica de la Academia Americana de Medicina del sueño (2007). "Parámetros de práctica para el tratamiento de la narcolepsia y otras hipersomnias de origen central" . Duerme . 30 (12): 1705-11. doi : 10.1093 / sleep / 30.12.1705 . PMC 2276123 . PMID 18246980 .
- ^ a b c d e f San Francisco Meth Zombies (documental de televisión). Canal de National Geographic. Agosto de 2013. ASIN B00EHAOBAO . Archivado desde el original el 8 de julio de 2016 . Consultado el 7 de julio de 2016 .
- ^ Nelson LS, Lewin NA, Howland MA, Hoffman RS, Goldfrank LR, Flomenbaum NE (2011). Emergencias toxicológicas de Goldfrank (9ª ed.). Nueva York: McGraw-Hill Medical. pag. 1080. ISBN 978-0-07-160593-9.
- ^ Nutt DJ, King LA, Phillips LD (noviembre de 2010). "Daños por drogas en el Reino Unido: un análisis de decisión multicriterio". Lancet . 376 (9752): 1558–65. CiteSeerX 10.1.1.690.1283 . doi : 10.1016 / S0140-6736 (10) 61462-6 . PMID 21036393 . S2CID 5667719 .
- ↑ a b c d Westfall DP, Westfall TC (2010). "Agonistas simpaticomiméticos diversos" . En Brunton LL, Chabner BA, Knollmann BC (eds.). Bases farmacológicas de la terapéutica de Goodman & Gilman (12ª ed.). Nueva York: McGraw-Hill. ISBN 978-0-07-162442-8.
- ^ a b "¿Cuáles son los efectos a largo plazo del uso indebido de metanfetamina?" . Instituto Nacional de Abuso de Drogas . Institutos Nacionales de Salud , Departamento de Salud y Servicios Humanos de EE. UU. Octubre de 2019 . Consultado el 15 de marzo de 2020 .
- ^ a b "Metanfetamina: lo que debe saber" . Noticias médicas hoy . Brighton, Reino Unido: Healthline Media UK Ltd. nd . Consultado el 15 de marzo de 2020 .
- ^ a b Elkins C (27 de febrero de 2020). "Metanfetamina" . DrugRehab.com . Sistemas de recuperación avanzados . Consultado el 15 de marzo de 2020 .
- ^ "Síntomas, efectos y tratamiento de sobredosis de metanfetamina | BlueCrest" . Centro de recuperación de Bluecrest . 17 de junio de 2019.
- ^ Abuso, Instituto Nacional de Drogas (29 de enero de 2021). "Tasas de muerte por sobredosis" . Instituto Nacional de Abuso de Drogas .
- ↑ a b c Hussain F, Frare RW, Py Berrios KL (2012). "Identificación del abuso de drogas y manejo del dolor en pacientes dentales: un estudio de caso y revisión de la literatura". Gen. Dent . 60 (4): 334–345. PMID 22782046 .
- ^ "Uso de metanfetamina (boca de metanfetamina)" . Asociación Dental Americana. Archivado desde el original en junio de 2008 . Consultado el 15 de diciembre de 2006 .
- ↑ a b Halkitis PN, Pandey Mukherjee P, Palamar JJ (2008). "Modelado longitudinal del uso de metanfetamina y conductas de riesgo sexual en hombres homosexuales y bisexuales" . SIDA y comportamiento . 13 (4): 783–791. doi : 10.1007 / s10461-008-9432-y . PMC 4669892 . PMID 18661225 .
- ↑ a b Patrick Moore (junio de 2005). "No estamos bien" . VillageVoice. Archivado desde el original el 4 de junio de 2011 . Consultado el 15 de enero de 2011 .
- ^ a b "Uso de metanfetamina y salud | UNSW: Universidad de Nueva Gales del Sur - Facultad de Medicina" (PDF) . Archivado desde el original (PDF) el 16 de agosto de 2008 . Consultado el 15 de enero de 2011 .
- ^ Sribanditmongkol P, Chokjamsai M, Thampitak S (2000). "Sobredosis de metanfetamina y fatalidad: informe de 2 casos" . Revista de la Asociación Médica de Tailandia = Chotmaihet Thangphaet . 83 (9): 1120–3. PMID 11075983 .
- ^ a b O'Connor PG (febrero de 2012). "Anfetaminas" . Manual Merck para profesionales de la salud . Merck. Archivado desde el original el 6 de mayo de 2012 . Consultado el 8 de mayo de 2012 .
- ^ Rusinyak DE (2011). "Manifestaciones neurológicas del abuso crónico de metanfetamina" . Clínicas neurológicas . 29 (3): 641–655. doi : 10.1016 / j.ncl.2011.05.004 . PMC 3148451 . PMID 21803215 .
- ^ Darke S, Kaye S, McKetin R, Duflou J (mayo de 2008). "Principales daños físicos y psicológicos del uso de metanfetamina". Rev drogas alcohol . 27 (3): 253–262. doi : 10.1080 / 09595230801923702 . PMID 18368606 .
- ↑ a b Beardsley PM, Hauser KF (2014). "Moduladores gliales como posibles tratamientos del abuso de psicoestimulantes". Objetivos emergentes y terapias en el tratamiento del abuso de psicoestimulantes . Adv. Pharmacol . Avances en farmacología. 69 . págs. 1-69. doi : 10.1016 / B978-0-12-420118-7.00001-9 . ISBN 9780124201187. PMC 4103010 . PMID 24484974 .
La glía (incluidos los astrocitos, la microglía y los oligodendrocitos), que constituyen la mayoría de las células del cerebro, tienen muchos de los mismos receptores que las neuronas, secretan neurotransmisores y factores neurotróficos y neuroinflamatorios, controlan la eliminación de los neurotransmisores de las hendiduras sinápticas y están íntimamente involucradas en plasticidad sináptica. A pesar de su prevalencia y espectro de funciones, la apreciación de su potencial importancia general ha sido esquiva desde su identificación a mediados del siglo XIX, y solo hace relativamente poco tiempo que han ganado el debido respeto. Este desarrollo de apreciación se ha nutrido de la creciente conciencia de que las drogas de abuso, incluidos los psicoestimulantes, afectan la actividad glial y, a su vez, se ha descubierto que la actividad glial modula los efectos de los psicoestimulantes.
- ^ Loftis JM, Janowsky A (2014). "Base neuroinmune de la toxicidad de la metanfetamina". Señalización neuroinmune en acciones y adicciones a fármacos . En t. Rev. Neurobiol . Revista Internacional de Neurobiología. 118 . págs. 165–197. doi : 10.1016 / B978-0-12-801284-0.00007-5 . ISBN 9780128012840. PMC 4418472 . PMID 25175865 .
En conjunto, estos procesos patológicos contribuyen a la neurotoxicidad (p. Ej., Aumento de la permeabilidad de la BHE, inflamación, degeneración neuronal, muerte celular) y deterioros neuropsiquiátricos (p. Ej., Déficits cognitivos, trastornos del estado de ánimo)
" Figura 7.1: Mecanismos neuroinmunes de la toxicidad del SNC inducida por metanfetamina Archivado el 16 de septiembre de 2018 en Wayback Machine " - ↑ a b c d e Kaushal N, Matsumoto RR (marzo de 2011). "Papel de los receptores sigma en la neurotoxicidad inducida por metanfetamina" . Curr Neuropharmacol . 9 (1): 54–57. doi : 10.2174 / 157015911795016930 . PMC 3137201 . PMID 21886562 .
σ Los receptores parecen jugar un papel importante en muchos de los efectos de METH. Están presentes en los órganos que median las acciones de METH (por ejemplo, cerebro, corazón, pulmones) [5]. En el cerebro, METH actúa principalmente sobre el sistema dopaminérgico para producir efectos estimulantes locomotores agudos, sensibilización subcrónica y neurotóxicos. σ Los receptores están presentes en las neuronas dopaminérgicas y su activación estimula la síntesis y liberación de dopamina [11-13]. Los receptores σ-2 modulan la DAT y la liberación de dopamina a través de la proteína quinasa C (PKC) y los sistemas Ca2 + -calmodulina [14].
Se ha demostrado que los antagonistas y antisentido del receptor σ-1 bloquean los efectos estimulantes locomotores agudos de METH [4]. Se ha demostrado que la administración repetida o autoadministración de METH regula al alza la proteína del receptor σ-1 y el ARNm en varias regiones del cerebro, incluida la sustancia negra, la corteza frontal, el cerebelo, el mesencéfalo y el hipocampo [15, 16]. Además, los antagonistas del receptor σ ... previenen el desarrollo de sensibilización conductual a METH [17, 18]. ...
Se ha demostrado que los agonistas del receptor σ facilitan la liberación de dopamina, a través de los receptores σ-1 y σ-2 [11-14]. - ↑ Yu S, Zhu L, Shen Q, Bai X, Di X (2015). "Avances recientes en los mecanismos de neurotoxicidad de la metanfetamina y su fisiopatología molecular" . Neurología del comportamiento . 2015 : 103969. doi : 10.1155 / 2015/103969 . PMC 4377385 . PMID 25861156 .
- ^ Carvalho M, Carmo H, Costa VM, Capela JP, Pontes H, Remião F, Carvalho F, Bastos Mde L (agosto de 2012). "Toxicidad de las anfetaminas: una actualización". Arco. Toxicol . 86 (8): 1167-1231. doi : 10.1007 / s00204-012-0815-5 . PMID 22392347 . S2CID 2873101 .
- ↑ a b Cruickshank CC, Dyer KR (julio de 2009). "Una revisión de la farmacología clínica de la metanfetamina". Adicción . 104 (7): 1085–1099. doi : 10.1111 / j.1360-0443.2009.02564.x . PMID 19426289 .
- ^ a b c d • Cisneros IE, Ghorpade A (octubre de 2014). "Metanfetamina y neurotoxicidad inducida por VIH-1: papel de la señalización de AMPc del receptor 1 asociado a trazas de amina en astrocitos" . Neurofarmacología . 85 : 499–507. doi : 10.1016 / j.neuropharm.2014.06.011 . PMC 4315503 . PMID 24950453 .
La sobreexpresión de TAAR1 disminuyó significativamente los niveles de EAAT-2 y el aclaramiento de glutamato ... El tratamiento con METH activó el TAAR1 que condujo a cAMP intracelular en los astrocitos humanos y moduló la capacidad de aclaramiento del glutamato. Además, las alteraciones moleculares en los niveles de TAAR1 de los astrocitos corresponden a cambios en los niveles y la función de EAAT-2 de los astrocitos.
• Jing L, Li JX (agosto de 2015). "Traza el receptor asociado a aminas 1: un objetivo prometedor para el tratamiento de la adicción a los psicoestimulantes" . EUR. J. Pharmacol . 761 : 345–352. doi : 10.1016 / j.ejphar.2015.06.019 . PMC 4532615 . PMID 26092759 .TAAR1 se localiza principalmente en los compartimentos intracelulares tanto en neuronas (Miller, 2011), en células gliales (Cisneros y Ghorpade, 2014) como en tejidos periféricos (Grandy, 2007)
- ^ Yuan J, Hatzidimitriou G, Suthar P, Mueller M, McCann U, Ricaurte G (marzo de 2006). "Relación entre la temperatura, la neurotoxicidad dopaminérgica y las concentraciones plasmáticas de fármacos en monos ardilla tratados con metanfetamina" . La Revista de Farmacología y Terapéutica Experimental . 316 (3): 1210-1218. doi : 10.1124 / jpet.105.096503 . PMID 16293712 . S2CID 11909155 .
- ↑ a b c d Rodvelt KR, Miller DK (septiembre de 2010). "¿Podrían los ligandos del receptor sigma ser un tratamiento para la adicción a la metanfetamina?". Curr Abuso de Drogas Rev . 3 (3): 156–162. doi : 10.2174 / 1874473711003030156 . PMID 21054260 .
- ^ Malenka RC, Nestler EJ, Hyman SE (2009). "Capítulo 15: Refuerzo y trastornos adictivos". En Sydor A, Brown RY (eds.). Neurofarmacología molecular: una base para la neurociencia clínica (2ª ed.). Nueva York: McGraw-Hill Medical. págs. 364–375. ISBN 9780071481274.
- ^ a b c d Nestler EJ (diciembre de 2013). "Base celular de la memoria para la adicción" . Diálogos en neurociencia clínica . 15 (4): 431–443. PMC 3898681 . PMID 24459410 .
A pesar de la importancia de numerosos factores psicosociales, en su esencia, la adicción a las drogas implica un proceso biológico: la capacidad de la exposición repetida a una droga de abuso para inducir cambios en un cerebro vulnerable que impulsa la búsqueda y el consumo compulsivo de drogas, y la pérdida de control. sobre el consumo de drogas, que definen un estado de adicción. ... Una gran cantidad de literatura ha demostrado que tal inducción de ΔFosB en neuronas de tipo D1 [núcleo accumbens] aumenta la sensibilidad de un animal al fármaco, así como a las recompensas naturales y promueve la autoadministración del fármaco, presumiblemente a través de un proceso de refuerzo positivo. Otro objetivo de ΔFosB es cFos: a medida que ΔFosB se acumula con la exposición repetida al fármaco, reprime el c-Fos y contribuye al cambio molecular mediante el cual ΔFosB se induce selectivamente en el estado crónico de tratamiento con fármaco. 41. ... Además, existe una creciente evidencia de que, a pesar de una variedad de riesgos genéticos de adicción en la población, la exposición a dosis suficientemente altas de una droga durante largos períodos de tiempo puede transformar a alguien que tiene una carga genética relativamente menor en un adicto.
- ^ "Glosario de términos" . Escuela de Medicina Mount Sinai . Departamento de Neurociencia . Consultado el 9 de febrero de 2015 .
- ^ Volkow ND, Koob GF, McLellan AT (enero de 2016). "Avances neurobiológicos del modelo de adicción a la enfermedad cerebral" . Revista de Medicina de Nueva Inglaterra . 374 (4): 363–371. doi : 10.1056 / NEJMra1511480 . PMC 6135257 . PMID 26816013 .
Trastorno por uso de sustancias: término de diagnóstico en la quinta edición del Manual diagnóstico y estadístico de trastornos mentales (DSM-5) que se refiere al uso recurrente de alcohol u otras drogas que causa un deterioro clínicamente y funcionalmente significativo, como problemas de salud, discapacidad, y no cumplir con las principales responsabilidades en el trabajo, la escuela o el hogar. Según el nivel de gravedad, este trastorno se clasifica como leve, moderado o grave.
Adicción: término que se utiliza para indicar la etapa crónica más grave del trastorno por uso de sustancias, en la que hay una pérdida sustancial de autocontrol, como lo indica el consumo compulsivo de drogas a pesar del deseo de dejar de tomarlas. En el DSM-5, el término adicción es sinónimo de la clasificación de trastorno grave por uso de sustancias. - ^ a b c Renthal W, Nestler EJ (septiembre de 2009). "Regulación de la cromatina en la adicción a las drogas y la depresión" . Diálogos en neurociencia clínica . 11 (3): 257–268. PMC 2834246 . PMID 19877494 .
Los [psicoestimulantes] aumentan los niveles de AMPc en el cuerpo estriado, lo que activa la proteína quinasa A (PKA) y conduce a la fosforilación de sus objetivos. Esto incluye la proteína de unión al elemento de respuesta a AMPc (CREB), cuya fosforilación induce su asociación con la histona acetiltransferasa, proteína de unión a CREB (CBP) para acetilar histonas y facilitar la activación de genes. Se sabe que esto ocurre en muchos genes, incluidos fosB y
c-fos.
en respuesta a la exposición a psicoestimulantes. ΔFosB también se regula positivamente mediante tratamientos psicoestimulantes crónicos, y se sabe que activa ciertos genes (p. Ej., Cdk5) y reprime otros (p. Ej., C-fos ) donde recluta HDAC1 como correpresor. ... La exposición crónica a psicoestimulantes aumenta la [señalización] glutamatérgica de la corteza prefrontal a la NAc. La señalización glutamatérgica eleva los niveles de Ca2 + en los elementos postsinápticos NAc donde activa la señalización de CaMK (calcio / calmodulina proteína quinasas) que, además de fosforilar CREB, también fosforila HDAC5.
Figura 2: Eventos de señalización inducidos por psicoestimulantes - ^ Broussard JI (enero de 2012). "Co-transmisión de dopamina y glutamato" . La Revista de Fisiología General . 139 (1): 93–96. doi : 10.1085 / jgp.201110659 . PMC 3250102 . PMID 22200950 .
La entrada coincidente y convergente a menudo induce plasticidad en una neurona postsináptica. El NAc integra información procesada sobre el entorno de la amígdala basolateral, el hipocampo y la corteza prefrontal (PFC), así como proyecciones de las neuronas dopaminérgicas del mesencéfalo. Estudios anteriores han demostrado cómo la dopamina modula este proceso integrador. Por ejemplo, la estimulación de alta frecuencia potencia las entradas del hipocampo al NAc mientras simultáneamente deprime las sinapsis de PFC (Goto y Grace, 2005). También se demostró que lo contrario era cierto; la estimulación en PFC potencia las sinapsis PFC-NAc pero deprime las sinapsis del hipocampo-NAc. A la luz de la nueva evidencia funcional de la co-transmisión de dopamina / glutamato en el mesencéfalo (referencias arriba),Los nuevos experimentos de la función NAc tendrán que probar si las entradas glutamatérgicas del mesencéfalo sesgan o filtran las entradas límbicas o corticales para guiar el comportamiento dirigido a objetivos.
- ^ Laboratorios Kanehisa (10 de octubre de 2014). "Anfetamina - Homo sapiens (humano)" . Camino KEGG . Consultado el 31 de octubre de 2014 .
La mayoría de las drogas adictivas aumentan las concentraciones extracelulares de dopamina (DA) en el núcleo accumbens (NAc) y la corteza prefrontal medial (mPFC), áreas de proyección de neuronas DA mesocorticolímbicas y componentes clave del "circuito de recompensa cerebral". La anfetamina logra esta elevación en los niveles extracelulares de DA al promover la salida de las terminales sinápticas. ... La exposición crónica a la anfetamina induce un factor de transcripción único delta FosB, que juega un papel esencial en los cambios adaptativos a largo plazo en el cerebro.
- ^ Cadete JL, Brannock C, Jayanthi S, Krasnova IN (2015). "Sustratos transcripcionales y epigenéticos de la adicción y abstinencia de metanfetamina: evidencia de un modelo de autoadministración de acceso prolongado en la rata" . Neurobiología molecular . 51 (2): 696–717. doi : 10.1007 / s12035-014-8776-8 . PMC 4359351 . PMID 24939695 .
Figura 1
- ^ a b c Robison AJ, Nestler EJ (noviembre de 2011). "Mecanismos transcripcionales y epigenéticos de la adicción" . Nature Reviews Neurociencia . 12 (11): 623–637. doi : 10.1038 / nrn3111 . PMC 3272277 . PMID 21989194 .
ΔFosB sirve como una de las proteínas de control maestras que gobiernan esta plasticidad estructural. ... ΔFosB también reprime la expresión de G9a, lo que conduce a una metilación de histonas represiva reducida en el gen cdk5. El resultado neto es la activación de genes y una mayor expresión de CDK5. ... Por el contrario, ΔFosB se une a la
c-fos
gen y recluta varios correpresores, incluyendo HDAC1 (histona desacetilasa 1) y SIRT 1 (sirtuina 1). ... El resultado neto es la represión del gen c-fos .
Figura 4: Base epigenética de la regulación farmacológica de la expresión génica. - ^ a b c Nestler EJ (diciembre de 2012). "Mecanismos transcripcionales de la adicción a las drogas" . Psicofarmacología Clínica y Neurociencia . 10 (3): 136–143. doi : 10.9758 / cpn.2012.10.3.136 . PMC 3569166 . PMID 23430970 .
Las isoformas de ΔFosB de 35-37 kD se acumulan con la exposición crónica al fármaco debido a sus vidas medias extraordinariamente largas. ... Como resultado de su estabilidad, la proteína ΔFosB persiste en las neuronas durante al menos varias semanas después del cese de la exposición al fármaco. ... La sobreexpresión de ΔFosB en el núcleo accumbens induce NFκB ... En contraste, la capacidad de ΔFosB para reprimir la
El gen c-Fos ocurre en concierto con el reclutamiento de una histona desacetilasa y presumiblemente varias otras proteínas represivas como una histona metiltransferasa represiva
- ^ Nestler EJ (octubre de 2008). "Mecanismos transcripcionales de la adicción: papel de ΔFosB" . Transacciones filosóficas de la Royal Society B: Ciencias biológicas . 363 (1507): 3245–3255. doi : 10.1098 / rstb.2008.0067 . PMC 2607320 . PMID 18640924 .
Evidencia reciente ha demostrado que ΔFosB también reprime el
gen
c-fos
que ayuda a crear el cambio molecular, desde la inducción de varias proteínas de la familia Fos de vida corta después de una exposición aguda al fármaco hasta la acumulación predominante de ΔFosB después de la exposición crónica al fármaco.
- ^ Hyman SE, Malenka RC, Nestler EJ (julio de 2006). "Mecanismos neuronales de la adicción: el papel del aprendizaje y la memoria relacionados con la recompensa" (PDF) . Annu. Rev. Neurosci . 29 : 565–598. doi : 10.1146 / annurev.neuro.29.051605.113009 . PMID 16776597 . S2CID 15139406 . Archivado desde el original (PDF) el 19 de septiembre de 2018.
- ^ a b c d e f g h Robison AJ, Nestler EJ (noviembre de 2011). "Mecanismos transcripcionales y epigenéticos de la adicción" . Nat. Rev. Neurosci . 12 (11): 623–637. doi : 10.1038 / nrn3111 . PMC 3272277 . PMID 21989194 .
ΔFosB se ha relacionado directamente con varios comportamientos relacionados con la adicción ... Es importante destacar que la sobreexpresión genética o viral de ΔJunD, un mutante dominante negativo de JunD que antagoniza la actividad transcripcional mediada por ΔFosB y otras AP-1, en los bloques NAc o OFC estos efectos clave de la exposición a las drogas
14,22-24 . Esto indica que ΔFosB es necesario y suficiente para muchos de los cambios producidos en el cerebro por la exposición crónica a fármacos. ΔFosB también se induce en las NEM de NAc de tipo D1 por el consumo crónico de varias recompensas naturales, como sacarosa, alimentos ricos en grasas, sexo, correr ruedas, donde promueve ese consumo 14,26-30 . Esto implica a ΔFosB en la regulación de las recompensas naturales en condiciones normales y quizás durante estados patológicos de tipo adictivo.
- ^ Malenka RC, Nestler EJ, Hyman SE (2009). "Capítulo 4: Transducción de señales en el cerebro". En Sydor A, Brown RY (eds.). Neurofarmacología molecular: una base para la neurociencia clínica (2ª ed.). Nueva York, Estados Unidos: McGraw-Hill Medical. pag. 94. ISBN 978-0-07-148127-4.
- ^ a b c Ruffle JK (noviembre de 2014). "Neurobiología molecular de la adicción: ¿de qué se trata todo el (Δ) FosB?". Soy. J. Abuso de drogas y alcohol . 40 (6): 428–437. doi : 10.3109 / 00952990.2014.933840 . PMID 25083822 . S2CID 19157711 .
ΔFosB es un factor de transcripción esencial implicado en las vías moleculares y conductuales de la adicción después de la exposición repetida a las drogas.
- ^ a b c d e f g h i j k l m n o p q r Olsen CM (diciembre de 2011). "Recompensas naturales, neuroplasticidad y adicciones a las drogas" . Neurofarmacología . 61 (7): 1109–1122. doi : 10.1016 / j.neuropharm.2011.03.010 . PMC 3139704 . PMID 21459101 .
De manera similar al enriquecimiento ambiental, los estudios han encontrado que el ejercicio reduce la autoadministración y la recaída en las drogas de abuso (Cosgrove et al., 2002; Zlebnik et al., 2010). También hay alguna evidencia de que estos hallazgos preclínicos se traducen en poblaciones humanas, ya que el ejercicio reduce los síntomas de abstinencia y la recaída en fumadores abstinentes (Daniel et al., 2006; Prochaska et al., 2008), y un programa de recuperación de fármacos ha tenido éxito en los participantes. que entrenan y compiten en un maratón como parte del programa (Butler, 2005). ... En los seres humanos, el papel de la señalización de la dopamina en los procesos de sensibilización al incentivo se ha destacado recientemente por la observación de un síndrome de desregulación de la dopamina en algunos pacientes que toman fármacos dopaminérgicos.Este síndrome se caracteriza por un aumento (o compulsivo) inducido por medicamentos en la participación en recompensas no relacionadas con las drogas, como el juego, las compras o el sexo (Evans et al., 2006; Aiken, 2007; Lader, 2008).
- ^ Laboratorios Kanehisa (29 de octubre de 2014). "Alcoholismo - Homo sapiens (humano)" . Camino KEGG . Archivado desde el original el 13 de octubre de 2014 . Consultado el 31 de octubre de 2014 .
- ^ Kim Y, Teylan MA, Baron M, Sands A, Nairn AC, Greengard P (febrero de 2009). "Formación de columna dendrítica inducida por metilfenidato y expresión de DeltaFosB en núcleo accumbens" . Proc. Natl. Acad. Sci. USA . 106 (8): 2915-2920. Código Bibliográfico : 2009PNAS..106.2915K . doi : 10.1073 / pnas.0813179106 . PMC 2650365 . PMID 19202072 .
- ^ Nestler EJ (enero de 2014). "Mecanismos epigenéticos de la drogadicción" . Neurofarmacología . 76 Pt B: 259-268. doi : 10.1016 / j.neuropharm.2013.04.004 . PMC 3766384 . PMID 23643695 .
- ↑ a b Blum K, Werner T, Carnes S, Carnes P, Bowirrat A, Giordano J, Oscar-Berman M, Gold M (marzo de 2012). "Sexo, drogas y rock 'n' roll: hipotetizar la activación mesolímbica común en función de los polimorfismos del gen de recompensa" . Revista de Drogas Psicoactivas . 44 (1): 38–55. doi : 10.1080 / 02791072.2012.662112 . PMC 4040958 . PMID 22641964 .
Se ha descubierto que el gen deltaFosB en el NAc es fundamental para reforzar los efectos de la recompensa sexual. Pitchers y sus colegas (2010) informaron que se demostró que la experiencia sexual causa la acumulación de DeltaFosB en varias regiones límbicas del cerebro, incluidas NAc, corteza prefrontal medial, VTA, caudado y putamen, pero no el núcleo preóptico medial. ... estos hallazgos apoyan un papel crítico para la expresión de DeltaFosB en el NAc en los efectos reforzantes del comportamiento sexual y la facilitación del desempeño sexual inducida por la experiencia sexual. ... tanto la adicción a las drogas como la adicción sexual representan formas patológicas de neuroplasticidad junto con la aparición de comportamientos aberrantes que involucran una cascada de cambios neuroquímicos principalmente en los circuitos gratificantes del cerebro.
- ^ a b Jarras KK, Vialou V, Nestler EJ, Laviolette SR, Lehman MN, Coolen LM (febrero de 2013). "Las recompensas naturales y de drogas actúan sobre mecanismos de plasticidad neuronal comunes con ΔFosB como mediador clave" . J. Neurosci . 33 (8): 3434–3442. doi : 10.1523 / JNEUROSCI.4881-12.2013 . PMC 3865508 . PMID 23426671 .
Las drogas de abuso inducen neuroplasticidad en la vía de recompensa natural, específicamente en el núcleo accumbens (NAc), lo que provoca el desarrollo y la expresión de la conducta adictiva. ... Juntos, estos hallazgos demuestran que las drogas de abuso y las conductas de recompensa natural actúan sobre los mecanismos moleculares y celulares comunes de plasticidad que controlan la vulnerabilidad a la adicción a las drogas, y que esta mayor vulnerabilidad está mediada por ΔFosB y sus objetivos transcripcionales posteriores. ... El comportamiento sexual es muy gratificante (Tenk et al., 2009), y la experiencia sexual provoca comportamientos sensibilizados relacionados con las drogas, incluida la sensibilización cruzada a la actividad locomotora inducida por anfetaminas (Amph) (Bradley y Meisel, 2001; Pitchers et al. ., 2010a) y recompensa Amph mejorada (Pitchers et al., 2010a). Es más,La experiencia sexual induce una plasticidad neuronal en el NAc similar a la inducida por la exposición a psicoestimulantes, incluido un aumento de la densidad de la columna dendrítica (Meisel y Mullins, 2006; Pitchers et al., 2010a), tráfico alterado del receptor de glutamato y disminución de la fuerza sináptica en la respuesta de la corteza prefrontal. Neuronas de caparazón NAc (Pitchers et al., 2012). Finalmente, se encontró que los períodos de abstinencia de la experiencia sexual eran críticos para mejorar la recompensa de Amph, la espinogénesis de NAc (Pitchers et al., 2010a) y el tráfico de receptores de glutamato (Pitchers et al., 2012). Estos hallazgos sugieren que las experiencias de recompensa natural y de drogas comparten mecanismos comunes de plasticidad neuronal.y disminución de la fuerza sináptica en las neuronas de capa de NAc que responden a la corteza prefrontal (Pitchers et al., 2012). Finalmente, se encontró que los períodos de abstinencia de la experiencia sexual eran críticos para mejorar la recompensa de Amph, la espinogénesis de NAc (Pitchers et al., 2010a) y el tráfico de receptores de glutamato (Pitchers et al., 2012). Estos hallazgos sugieren que las experiencias de recompensa natural y de drogas comparten mecanismos comunes de plasticidad neuronal.y disminución de la fuerza sináptica en las neuronas de capa de NAc que responden a la corteza prefrontal (Pitchers et al., 2012). Finalmente, se encontró que los períodos de abstinencia de la experiencia sexual eran críticos para mejorar la recompensa de Amph, la espinogénesis de NAc (Pitchers et al., 2010a) y el tráfico de receptores de glutamato (Pitchers et al., 2012). Estos hallazgos sugieren que las experiencias de recompensa natural y de drogas comparten mecanismos comunes de plasticidad neuronal.
- ^ Brecht ML, Herbeck D (junio de 2014). "Tiempo de recaída después del tratamiento por uso de metanfetamina: una perspectiva a largo plazo sobre patrones y predictores" . Depende del alcohol de drogas . 139 : 18-25. doi : 10.1016 / j.drugalcdep.2014.02.702 . PMC 4550209 . PMID 24685563 .
- ^ Brecht ML, Lovinger K, Herbeck DM, Urada D (2013). "Patrones de utilización del tratamiento y uso de metanfetamina durante los primeros 10 años después del inicio de la metanfetamina" . J Trato por abuso de sustancias . 44 (5): 548–56. doi : 10.1016 / j.jsat.2012.12.006 . PMC 3602162 . PMID 23313146 .
- ^ Nestler EJ (enero de 2014). "Mecanismos epigenéticos de la drogadicción" . Neurofarmacología . 76 Pt B: 259–68. doi : 10.1016 / j.neuropharm.2013.04.004 . PMC 3766384 . PMID 23643695 .
- ↑ a b c Godino A, Jayanthi S, Cadet JL (2015). "Paisaje epigenético de la adicción a las anfetaminas y metanfetaminas en roedores" . Epigenética . 10 (7): 574–80. doi : 10.1080 / 15592294.2015.1055441 . PMC 4622560 . PMID 26023847 .
- ^ Cruz FC, Javier Rubio F, Hope BT (diciembre de 2015). "Uso de c-fos para estudiar conjuntos neuronales en circuitos corticostriatales de adicción" . Brain Res . 1628 (Parte A): 157–73. doi : 10.1016 / j.brainres.2014.11.005 . PMC 4427550 . PMID 25446457 .
- ^ Jayanthi S, McCoy MT, Chen B, Britt JP, Kourrich S, Yau HJ, Ladenheim B, Krasnova IN, Bonci A, Cadet JL (julio de 2014). "La metanfetamina regula negativamente los receptores de glutamato estriatal a través de diversos mecanismos epigenéticos" . Biol. Psiquiatría . 76 (1): 47–56. doi : 10.1016 / j.biopsych.2013.09.034 . PMC 3989474 . PMID 24239129 .
- ^ Kenny PJ, Markou A (mayo de 2004). "Los altibajos de la adicción: papel de los receptores de glutamato metabotrópicos". Trends Pharmacol. Sci . 25 (5): 265–72. doi : 10.1016 / j.tips.2004.03.009 . PMID 15120493 .
- ^ Se inclina WW, Rush CR (mayo de 2014). "Farmacoterapias combinadas para el trastorno por uso de estimulantes: una revisión de los hallazgos clínicos y recomendaciones para futuras investigaciones" . Experto Rev Clin Pharmacol . 7 (3): 363–374. doi : 10.1586 / 17512433.2014.909283 . PMC 4017926 . PMID 24716825 .
A pesar de los esfuerzos concertados para identificar una farmacoterapia para controlar los trastornos por uso de estimulantes, no se han aprobado medicamentos ampliamente eficaces.
- ^ a b c d Chan B, Freeman M, Kondo K, Ayers C, Montgomery J, Paynter R, Kansagara D (diciembre de 2019). "Farmacoterapia para el trastorno por uso de metanfetamina / anfetamina: una revisión sistemática y un metanálisis". Adicción (Abingdon, Inglaterra) . 114 (12): 2122–2136. doi : 10.1111 / add.14755 . PMID 31328345 .
- ^ Forray A, Sofuoglu M (febrero de 2014). "Futuros tratamientos farmacológicos para los trastornos por uso de sustancias" . Br. J. Clin. Pharmacol . 77 (2): 382–400. doi : 10.1111 / j.1365-2125.2012.04474.x . PMC 4014020 . PMID 23039267 .
- ^ O'Connor P. "Anfetaminas: uso y abuso de drogas" . Manual Merck Manual de salud en el hogar . Merck. Archivado desde el original el 17 de febrero de 2007 . Consultado el 26 de septiembre de 2013 .
- ^ Pérez-Mañá C, Castells X, Torrens M, Capellà D, Farre M (2013). Pérez-Mañá C (ed.). "Eficacia de los psicoestimulantes para el abuso o dependencia de anfetaminas". Cochrane Database Syst. Rev . 9 (9): CD009695. doi : 10.1002 / 14651858.CD009695.pub2 . PMID 23996457 .
- ↑ a b c d Shoptaw SJ, Kao U, Heinzerling K, Ling W (2009). Shoptaw SJ (ed.). "Tratamiento para la abstinencia de anfetaminas" . Cochrane Database Syst. Rev. (2): CD003021. doi : 10.1002 / 14651858.CD003021.pub2 . PMC 7138250 . PMID 19370579 .
La prevalencia de este síndrome de abstinencia es extremadamente común (Cantwell 1998; Gossop 1982) con 87,6% de 647 individuos con dependencia de anfetaminas que informan seis o más signos de abstinencia de anfetaminas enumerados en el DSM cuando el fármaco no está disponible (Schuckit 1999) ... Los síntomas de abstinencia generalmente se presentan dentro de las 24 horas posteriores al último uso de anfetamina, con un síndrome de abstinencia que involucra dos fases generales que pueden durar 3 semanas o más. La primera fase de este síndrome es el "colapso" inicial que se resuelve en aproximadamente una semana (Gossop 1982; McGregor 2005)
- ↑ a b c d Winslow BT, Voorhees KI, Pehl KA (2007). "Abuso de metanfetamina". Médico de familia estadounidense . 76 (8): 1169-1174. PMID 17990840 .
- ^ Los bebés nacidos de madres afectadas por la metanfetamina parecen portarse bien, pero su naturaleza pasiva enmascara un problema grave , Elicia Kennedy, ABC News Online , 2020-01-03
- ^ LaGasse LL, Derauf C, Smith LM, Newman E, Shah R, Neal C, et al. (Abril de 2012). "Exposición prenatal a la metanfetamina y problemas de conducta infantil a los 3 y 5 años de edad" . Pediatría . Academia Americana de Pediatría. 129 (4): 681–8. doi : 10.1542 / peds.2011-2209 . PMC 3313637 . PMID 22430455 .
- ^ Albertson TE (2011). "Anfetaminas". En Olson KR, Anderson IB, Benowitz NL, Blanc PD, Kearney TE, Kim-Katz SY, Wu AH (eds.). Envenenamiento y sobredosis de drogas (6ª ed.). Nueva York: McGraw-Hill Medical. págs. 77–79. ISBN 978-0-07-166833-0.
- ^ Oskie SM, Rhee JW (11 de febrero de 2011). "Intoxicación por anfetaminas" . Central de Emergencias . Medicina sin consolidar. Archivado desde el original el 26 de septiembre de 2013 . Consultado el 11 de junio de 2013 .
- ^ Isbister GK, Buckley NA, Whyte IM (septiembre de 2007). "Toxicidad de la serotonina: un enfoque práctico para el diagnóstico y el tratamiento" (PDF) . Medicina. J. Aust . 187 (6): 361–365. doi : 10.5694 / j.1326-5377.2007.tb01282.x . PMID 17874986 . S2CID 13108173 . Archivado (PDF) desde el original el 4 de julio de 2014 . Consultado el 2 de enero de 2014 .
- ^ Malenka RC, Nestler EJ, Hyman SE (2009). "15". En Sydor A, Brown RY (eds.). Neurofarmacología molecular: una base para la neurociencia clínica (2ª ed.). Nueva York: McGraw-Hill Medical. pag. 370. ISBN 978-0-07-148127-4.
A diferencia de la cocaína y la anfetamina, la metanfetamina es directamente tóxica para las neuronas dopaminérgicas del mesencéfalo.
- ↑ a b c Shoptaw SJ, Kao U, Ling W (2009). Shoptaw SJ, Ali R (eds.). "Tratamiento para la psicosis anfetamínica" . Cochrane Database Syst. Rev. (1): CD003026. doi : 10.1002 / 14651858.CD003026.pub3 . PMC 7004251 . PMID 19160215 .
Una minoría de personas que usan anfetaminas desarrollan psicosis en toda regla que requieren atención en departamentos de emergencia u hospitales psiquiátricos. En tales casos, los síntomas de la psicosis anfetamínica suelen incluir delirios paranoicos y persecutorios, así como alucinaciones auditivas y visuales en presencia de agitación extrema. Más común (alrededor del 18%) es que los consumidores frecuentes de anfetaminas reporten síntomas psicóticos que son subclínicos y que no requieren una intervención de alta intensidad ...
Alrededor del 5 al 15% de los consumidores que desarrollan una psicosis anfetamínica no se recuperan por completo (Hofmann 1983) ...
Los resultados de un ensayo indican que el uso de fármacos antipsicóticos resuelve eficazmente los síntomas de la psicosis anfetamínica aguda. - ^ Hofmann FG (1983). Un manual sobre el abuso de drogas y alcohol: los aspectos biomédicos (2ª ed.). Nueva York: Oxford University Press. pag. 329 . ISBN 978-0-19-503057-0.
- ^ Berman SM, Kuczenski R, McCracken JT, London ED (febrero de 2009). "Posibles efectos adversos del tratamiento con anfetaminas en el cerebro y el comportamiento: una revisión" . Mol. Psiquiatría . 14 (2): 123-142. doi : 10.1038 / mp.2008.90 . PMC 2670101 . PMID 18698321 .
- ↑ a b c Richards JR, Albertson TE, Derlet RW, Lange RA, Olson KR, Horowitz BZ (mayo de 2015). "Tratamiento de la toxicidad de las anfetaminas, derivados relacionados y análogos: una revisión clínica sistemática". Depende del alcohol de drogas . 150 : 1-13. doi : 10.1016 / j.drugalcdep.2015.01.040 . PMID 25724076 .
- ^ Richards JR, Derlet RW, Duncan DR (septiembre de 1997). "Toxicidad de la metanfetamina: tratamiento con una benzodiazepina versus una butirofenona". EUR. J. Emerg. Med . 4 (3): 130-135. doi : 10.1097 / 00063110-199709000-00003 . PMID 9426992 .
- ^ Richards JR, Derlet RW, Albertson TE. "Tratamiento y manejo" . Toxicidad de la metanfetamina . Medscape . WebMD. Archivado desde el original el 9 de abril de 2016 . Consultado el 20 de abril de 2016 .
- ^ a b "Enzimas" . Metanfetamina . DrugBank . Universidad de Alberta. 8 de febrero de 2013.
- ^ a b c Miller GM (enero de 2011). "El papel emergente del receptor 1 asociado a trazas de amina en la regulación funcional de los transportadores de monoamina y la actividad dopaminérgica" . J. Neurochem . 116 (2): 164-176. doi : 10.1111 / j.1471-4159.2010.07109.x . PMC 3005101 . PMID 21073468 .
- ^ a b c "Objetivos" . Metanfetamina . DrugBank . Universidad de Alberta. 8 de febrero de 2013.
- ^ Borowsky B, Adham N, Jones KA, Raddatz R, Artymyshyn R, Ogozalek KL, Durkin MM, Lakhlani PP, Bonini JA, Pathirana S, Boyle N, Pu X, Kouranova E, Lichtblau H, Ochoa FY, Branchek TA, Gerald C (julio de 2001). "Trazas de aminas: identificación de una familia de receptores acoplados a proteína G de mamíferos" . Proc. Natl. Acad. Sci. USA . 98 (16): 8966–8971. Código Bibliográfico : 2001PNAS ... 98.8966B . doi : 10.1073 / pnas.151105198 . PMC 55357 . PMID 11459929 .
- ^ Xie Z, Miller GM (julio de 2009). "Un mecanismo receptor de la acción de la metanfetamina en la regulación del transportador de dopamina en el cerebro" . J. Pharmacol. Exp. Ther . 330 (1): 316–325. doi : 10.1124 / jpet.109.153775 . PMC 2700171 . PMID 19364908 .
- ^ Maguire JJ, Davenport AP (2 de diciembre de 2014). " Receptor TA 1 " . Base de datos IUPHAR . Unión Internacional de Farmacología Básica y Clínica. Archivado desde el original el 29 de junio de 2015 . Consultado el 8 de diciembre de 2014 .
- ^ Underhill SM, Wheeler DS, Li M, Watts SD, Ingram SL, Amara SG (julio de 2014). "La anfetamina modula la neurotransmisión excitadora a través de la endocitosis del transportador de glutamato EAAT3 en neuronas de dopamina" . Neurona . 83 (2): 404–416. doi : 10.1016 / j.neuron.2014.05.043 . PMC 4159050 . PMID 25033183 .
El AMPH también aumenta el calcio intracelular (Gnegy et al., 2004) que está asociado con la activación de calmodulina / CamKII (Wei et al., 2007) y la modulación y tráfico del DAT (Fog et al., 2006; Sakrikar et al., 2012). ).
- ^ Vaughan RA, Foster JD (septiembre de 2013). "Mecanismos de regulación del transportador de dopamina en estados normales y patológicos" . Trends Pharmacol. Sci . 34 (9): 489–496. doi : 10.1016 / j.tips.2013.07.005 . PMC 3831354 . PMID 23968642 .
AMPH y METH también estimulan la salida de DA, que se cree que es un elemento crucial en sus propiedades adictivas [80], aunque los mecanismos no parecen ser idénticos para cada fármaco [81]. Estos procesos son dependientes de PKCβ y CaMK [72, 82], y los ratones knock-out para PKCβ muestran una disminución del flujo de salida inducido por AMPH que se correlaciona con una reducción de la locomoción inducida por AMPH [72].
- ^ Ledonne A, Berretta N, Davoli A, Rizzo GR, Bernardi G, Mercuri NB (julio de 2011). "Efectos electrofisiológicos de trazas de aminas en neuronas dopaminérgicas mesencefálicas" . Parte delantera. Syst. Neurosci . 5 : 56. doi : 10.3389 / fnsys.2011.00056 . PMC 3131148 . PMID 21772817 .
inhibición del disparo debido a una mayor liberación de dopamina; (b) reducción de las respuestas inhibidoras mediadas por el receptor D2 y GABAB (efectos excitadores debidos a la desinhibición); y (c) una activación directa mediada por el receptor TA1 de los canales GIRK que producen hiperpolarización de la membrana celular.
- ^ mct (28 de enero de 2012). "TAAR1" . GenAtlas . Universidad de Paris. Archivado desde el original el 29 de mayo de 2014 . Consultado el 29 de mayo de 2014 .
• activa tónicamente los canales de K (+) rectificadores hacia adentro, lo que reduce la frecuencia de disparo basal de las neuronas de dopamina (DA) del área tegmental ventral (VTA)
- ^ Revel FG, Moreau JL, Gainetdinov RR, Bradaia A, Sotnikova TD, Mory R, Durkin S, Zbinden KG, Norcross R, Meyer CA, Metzler V, Chaboz S, Ozmen L, Trube G, Pouzet B, Bettler B, Caron MG, Wettstein JG, Hoener MC (mayo de 2011). "La activación de TAAR1 modula la neurotransmisión monoaminérgica, previniendo la actividad hiperdopaminérgica e hipoglutamatérgica" . Proc. Natl. Acad. Sci. USA . 108 (20): 8485–8490. Código bibliográfico : 2011PNAS..108.8485R . doi : 10.1073 / pnas.1103029108 . PMC 3101002 . PMID 21525407 .
- ^ a b "Transportadores" . Metanfetamina . DrugBank . Universidad de Alberta. 8 de febrero de 2013.
- ^ Eiden LE, Weihe E (enero de 2011). "VMAT2: un regulador dinámico de la función neuronal monoaminérgica del cerebro que interactúa con las drogas de abuso" . Ana. NY Acad. Sci . 1216 (1): 86–98. Código bibliográfico : 2011NYASA1216 ... 86E . doi : 10.1111 / j.1749-6632.2010.05906.x . PMC 4183197 . PMID 21272013 .
- ^ Inazu M, Takeda H, Matsumiya T (agosto de 2003). "[El papel de los transportadores de monoamina gliales en el sistema nervioso central]". Nihon Shinkei Seishin Yakurigaku Zasshi (en japonés). 23 (4): 171-178. PMID 13677912 .
- ^ Melega WP, Cho AK, Schmitz D, Kuczenski R, Segal DS (febrero de 1999). "Farmacocinética y farmacodinámica de la l-metanfetamina para la evaluación de la l-metanfetamina derivada de deprenilo in vivo". J. Pharmacol. Exp. Ther . 288 (2): 752–758. PMID 9918585 .
- ↑ a b Kuczenski R, Segal DS, Cho AK, Melega W (febrero de 1995). "Norepinefrina hipocampo, dopamina caudada y serotonina, y respuestas conductuales a los estereoisómeros de anfetamina y metanfetamina" . J. Neurosci . 15 (2): 1308-1317. doi : 10.1523 / jneurosci.15-02-01308.1995 . PMC 6577819 . PMID 7869099 .
- ^ a b Mendelson J, Uemura N, Harris D, Nath RP, Fernandez E, Jacob P, Everhart ET, Jones RT (octubre de 2006). "Farmacología humana de los estereoisómeros de metanfetamina". Clin. Pharmacol. Ther . 80 (4): 403–420. doi : 10.1016 / j.clpt.2006.06.013 . PMID 17015058 . S2CID 19072636 .
- ^ a b c d e f g h i j k "Farmacología" . Metanfetamina . DrugBank . Universidad de Alberta. 2 de octubre de 2017 . Consultado el 5 de octubre de 2017 .
La metanfetamina se absorbe rápidamente en el tracto gastrointestinal y las concentraciones máximas de metanfetamina se producen entre 3,13 y 6,3 horas después de la ingestión. La metanfetamina también se absorbe bien después de la inhalación y después de la administración intranasal. Se distribuye a la mayor parte del cuerpo. Debido a que la metanfetamina tiene una alta lipofilia, se distribuye a través de la barrera hematoencefálica y atraviesa la placenta. ...
El sitio principal de metabolismo es el hígado por hidroxilación aromática, N-desalquilación y desaminación. Se han identificado al menos siete metabolitos en la orina, siendo los principales metabolitos la anfetamina (activa) y la 4-hidroximetanfetamina. Otros metabolitos menores incluyen 4-hidroxianfetamina, norefedrina y 4-hidroxinorrefedrina. - ↑ a b Santagati NA, Ferrara G, Marrazzo A, Ronsisvalle G (septiembre de 2002). "Determinación simultánea de anfetamina y uno de sus metabolitos por HPLC con detección electroquímica". J. Pharm. Biomed. Anal . 30 (2): 247-255. doi : 10.1016 / S0731-7085 (02) 00330-8 . PMID 12191709 .
- ^ Glennon RA (2013). "Estimulantes de fenilisopropilamina: agentes relacionados con las anfetaminas" . En Lemke TL, Williams DA, Roche VF, Zito W (eds.). Principios de química medicinal de Foye (7ª ed.). Filadelfia, Estados Unidos: Wolters Kluwer Health / Lippincott Williams & Wilkins. págs. 646–648. ISBN 978-1-60913-345-0.
La fenilisopropilamina no sustituida más simple, el 1-fenil-2-aminopropano o anfetamina, sirve como plantilla estructural común para los alucinógenos y psicoestimulantes. La anfetamina produce acciones estimulantes centrales, anoréxicas y simpaticomiméticas, y es el miembro prototipo de esta clase (39). ... El metabolismo de fase 1 de los análogos de anfetaminas está catalizado por dos sistemas: el citocromo P450 y la flavina monooxigenasa. ... La anfetamina también puede sufrir hidroxilación aromática a p -hidroxianfetamina. ... La oxidación posterior en la posición bencílica por DA β-hidroxilasa produce p -hidroxinorefedrina. Alternativamente, la oxidación directa de anfetamina por DA β-hidroxilasa puede producir norefedrina.
- ^ Taylor KB (enero de 1974). "Dopamina-beta-hidroxilasa. Curso estereoquímico de la reacción" (PDF) . J. Biol. Chem . 249 (2): 454–458. doi : 10.1016 / S0021-9258 (19) 43051-2 . PMID 4809526 . Archivado (PDF) desde el original el 7 de octubre de 2018 . Consultado el 6 de noviembre de 2014 .
La dopamina-β-hidroxilasa catalizó la eliminación del átomo de hidrógeno pro-R y la producción de 1-norefedrina, (2S, 1R) -2-amino-1-hidroxil-1-fenilpropano, a partir de d-anfetamina.
- ^ Sjoerdsma A, von Studnitz W (abril de 1963). "Actividad de la dopamina-beta-oxidasa en el hombre, utilizando hidroxianfetamina como sustrato" . Br. J. Pharmacol. Chemother . 20 (2): 278–284. doi : 10.1111 / j.1476-5381.1963.tb01467.x . PMC 1703637 . PMID 13977820 .
Se administró hidroxianfetamina por vía oral a cinco sujetos humanos ... Dado que la conversión de hidroxianfetamina en hidroxinorefedrina se produce in vitro por la acción de la dopamina-β-oxidasa, se sugiere un método simple para medir la actividad de esta enzima y el efecto de sus inhibidores en el hombre . ... La falta de efecto de la administración de neomicina a un paciente indica que la hidroxilación se produce en los tejidos corporales. ... una parte importante de la β-hidroxilación de la hidroxianfetamina se produce en el tejido no suprarrenal. Desafortunadamente, en la actualidad no se puede estar completamente seguro de que la hidroxilación de la hidroxianfetamina in vivo se lleve a cabo mediante la misma enzima que convierte la dopamina en noradrenalina.
- ^ "Sustrato / Producto" . butirato-CoA ligasa . BRENDA . Technische Universität Braunschweig.
- ^ "Sustrato / Producto" . glicina N-aciltransferasa . BRENDA . Technische Universität Braunschweig.
- ^ "Resumen compuesto" . p-hidroxianfetamina . Compuesto PubChem . Centro Nacional de Información Biotecnológica.
- ^ "Resumen compuesto" . p-hidroxinorefedrina . Compuesto PubChem . Centro Nacional de Información Biotecnológica.
- ^ "Resumen compuesto" . Fenilpropanolamina . Compuesto PubChem . Centro Nacional de Información Biotecnológica.
- ^ "Anfetamina" . Compuesto Pubchem . Centro Nacional de Información Biotecnológica. Archivado desde el original el 13 de octubre de 2013 . Consultado el 12 de octubre de 2013 .
- ^ Haiser HJ, Turnbaugh PJ (marzo de 2013). "Desarrollar una visión metagenómica del metabolismo xenobiótico" . Pharmacol. Res . 69 (1): 21–31. doi : 10.1016 / j.phrs.2012.07.009 . PMC 3526672 . PMID 22902524 .
Tabla 2: Xenobióticos metabolizados por la microbiota intestinal humana - ^ Caldwell J, Hawksworth GM (mayo de 1973). "La desmetilación de la metanfetamina por la microflora intestinal". J. Pharm. Pharmacol . 25 (5): 422–424. doi : 10.1111 / j.2042-7158.1973.tb10043.x . PMID 4146404 . S2CID 34050001 .
- ^ Liddle DG, Connor DJ (junio de 2013). "Suplementos nutricionales y SIDA ergogénico". Remilgado. Cuidado . 40 (2): 487–505. doi : 10.1016 / j.pop.2013.02.009 . PMID 23668655 .
- ^ Kraemer T, Maurer HH (agosto de 1998). "Determinación de anfetaminas, metanfetaminas y medicamentos de diseño derivados de anfetaminas o medicamentos en sangre y orina". J. Chromatogr. B . 713 (1): 163–187. doi : 10.1016 / S0378-4347 (97) 00515-X . PMID 9700558 .
- ^ Kraemer T, Paul LD (agosto de 2007). "Procedimientos bioanalíticos para la determinación de drogas de abuso en sangre". Anal. Bioanal. Chem . 388 (7): 1415-1435. doi : 10.1007 / s00216-007-1271-6 . PMID 17468860 . S2CID 32917584 .
- ^ Goldberger BA, Cone EJ (julio de 1994). "Pruebas confirmatorias de fármacos en el lugar de trabajo mediante cromatografía de gases-espectrometría de masas". J. Chromatogr. Una . 674 (1–2): 73–86. doi : 10.1016 / 0021-9673 (94) 85218-9 . PMID 8075776 .
- ↑ a b Paul BD, Jemionek J, Lesser D, Jacobs A, Searles DA (septiembre de 2004). "Separación enantiomérica y cuantificación de (+/-) - anfetamina, (+/-) - metanfetamina, (+/-) - MDA, (+/-) - MDMA y (+/-) - MDEA en muestras de orina por GC-EI-MS después de derivatizar con (R) - (-) - o (S) - (+) - cloruro de alfa-metoxi-alfa- (trifluorometil) fenilacetilo (MTPA) " . J. Anal. Toxicol . 28 (6): 449–455. doi : 10.1093 / jat / 28.6.449 . PMID 15516295 .
- ↑ de la Torre R, Farré M, Navarro M, Pacifici R, Zuccaro P, Pichini S (2004). "Farmacocinética clínica de la anfetamina y sustancias afines: seguimiento en matrices convencionales y no convencionales". Clin Pharmacokinet . 43 (3): 157-185. doi : 10.2165 / 00003088-200443030-00002 . PMID 14871155 . S2CID 44731289 .
- ^ Baselt RC (2020). Disposición de fármacos y productos químicos tóxicos en el hombre . Seal Beach, Ca .: Publicaciones biomédicas. págs. 1277–1280. ISBN 978-0-578-57749-4.
- ^ Venkatratnam A, Lents NH (julio de 2011). "El zinc reduce la detección de cocaína, metanfetamina y THC mediante pruebas de orina ELISA" . J. Anal. Toxicol . 35 (6): 333–340. doi : 10.1093 / anatox / 35.6.333 . PMID 21740689 .
- ^ Hakey P, Ouellette W, Zubieta J, Korter T (abril de 2008). "Redeterminación de (+) - clorhidrato de metanfetamina a 90 K" . Acta Crystallographica. Sección E, Estructura de los informes en línea . 64 (Pt 5): o940. doi : 10.1107 / S1600536808011550 . PMC 2961146 . PMID 21202421 .
- ^ Nakayama, MT. "Interacción química de lejía y metanfetamina: un estudio de efectos de degradación y transformación" . trabajos de graduación . UNIVERSIDAD DE CALIFORNIA, DAVIS. Archivado desde el original el 19 de octubre de 2014 . Consultado el 17 de octubre de 2014 .
- ^ Pal R, Megharaj M, Kirkbride KP, Heinrich T, Naidu R (octubre de 2011). "Degradación biótica y abiótica de drogas ilícitas, su precursor y subproductos en el suelo". Chemosphere . 85 (6): 1002–9. Código Bibliográfico : 2011Chmsp..85.1002P . doi : 10.1016 / j.chemosphere.2011.06.102 . PMID 21777940 .
- ^ Bagnall J, Malia L, Lubben A, Kasprzyk-Hordern B (octubre de 2013). "Biodegradación estereoselectiva de anfetaminas y metanfetaminas en microcosmos fluviales" . Agua Res . 47 (15): 5708-18. doi : 10.1016 / j.watres.2013.06.057 . PMID 23886544 .
- ^ Crossley FS, Moore ML (noviembre de 1944). "Estudios sobre la reacción de Leuckart". La Revista de Química Orgánica . 9 (6): 529–536. doi : 10.1021 / jo01188a006 .
- ↑ a b c d e Kunalan V, Nic Daéid N, Kerr WJ, Buchanan HA, McPherson AR (septiembre de 2009). "Caracterización de las impurezas específicas de ruta que se encuentran en la metanfetamina sintetizada por los métodos de aminación reductiva y Leuckart" . Anal. Chem . 81 (17): 7342–7348. doi : 10.1021 / ac9005588 . PMC 3662403 . PMID 19637924 .
- ^ Tasas de muerte por sobredosis Archivado el 13 de diciembre de 2017 en Wayback Machine . Por el Instituto Nacional sobre el Abuso de Drogas (NIDA).
- ^ "Las muertes por sobredosis de fentanilo y opioides sintéticos en Estados Unidos se duplicaron en 2016" . The Guardian . 3 de septiembre de 2017. Archivado desde el original el 17 de agosto de 2018 . Consultado el 17 de agosto de 2018 .
- ^ Rassool GH (2009). Uso indebido de alcohol y drogas: manual para estudiantes y profesionales de la salud . Londres: Routledge. pag. 113. ISBN 978-0-203-87117-1.
- ^ a b "Reseña histórica de la metanfetamina" . Departamento de Salud de Vermont . Gobierno de Vermont. Archivado desde el original el 26 de junio de 2012 . Consultado el 29 de enero de 2012 .
- ^ Grobler SR, Chikte U, Westraat J (2011). "Los niveles de pH de diferentes muestras de drogas de metanfetamina en el mercado callejero de Ciudad del Cabo" . Odontología ISRN . 2011 : 1–4. doi : 10.5402 / 2011/974768 . PMC 3189445 . PMID 21991491 .
- ^ "Reseña histórica de la metanfetamina" . Departamento de Salud de Vermont. Archivado desde el original el 26 de junio de 2012 . Consultado el 15 de enero de 2012 .
- ^ Pervitin (en alemán), Berlín: CHEMIE.DE Information Service GmbH , consultado el 16 de septiembre de 2015
- ^ Freye E (2009). Farmacología y abuso de cocaína, anfetaminas, éxtasis y drogas de diseño relacionadas . Universidad de Düsseldorf, Alemania: Springer. pag. 110. ISBN 978-90-481-2447-3.
- ^ Ulrich A (6 de mayo de 2005). "La máquina de muerte nazi: soldados drogados de Hitler" . Spiegel en línea . Der Spiegel, 6 de mayo de 2005. Archivado desde el original el 19 de diciembre de 2017 . Consultado el 12 de agosto de 2014 .
- ^ Defalque RJ, Wright AJ (abril de 2011). "Metanfetamina para la Alemania de Hitler: 1937 a 1945". Toro. Anesth. Hist . 29 (2): 21-24, 32. doi : 10.1016 / s1522-8649 (11) 50016-2 . PMID 22849208 .
- ↑ a b Lukasz Kamienski (2016). Disparos: una breve historia de las drogas y la guerra . Prensa de la Universidad de Oxford. págs. 111-13. ISBN 9780190263478. Archivado desde el original el 23 de marzo de 2017 . Consultado el 23 de octubre de 2016 .
- ↑ a b Rasmussen N (marzo de 2008). On Speed: The Many Lives of Amphetamine (1 ed.). Prensa de la Universidad de Nueva York. pag. 148. ISBN 978-0-8147-7601-8.
- ^ "Ley de sustancias controladas" . Administración de Drogas y Alimentos de los Estados Unidos . 11 de junio de 2009. Archivado desde el original el 5 de abril de 2017 . Consultado el 4 de noviembre de 2013 .
- ^ "Desoxyn" . Lundbeck: Desoxyn. Archivado desde el original el 30 de noviembre de 2012 . Consultado el 15 de diciembre de 2012 .
- ^ "Recordati: Desoxyn" . Recordati SP. Archivado desde el original el 7 de julio de 2013 . Consultado el 15 de mayo de 2013 .
- ^ "Delincuencia organizada transnacional en el sudeste asiático: evolución, crecimiento y desafíos" . Junio de 2019.
- ^ "El hombre acusado de dirigir el sindicato de tráfico de drogas más grande en la historia de Asia ha sido revelado: esto es lo que debe suceder a continuación" . CNN . 24 de octubre de 2019.
- ^ Smith N (14 de octubre de 2019). "Los investigadores de drogas se acercan al asiático 'El Chapo' en el centro de un vasto anillo de metanfetamina" . El telégrafo .
- ^ "Dentro de la caza del hombre conocido como 'El Chapo de Asia ' " . New York Post . 14 de octubre de 2019.
- ^ Oficina de las Naciones Unidas contra la Droga y el Delito (2007). Prevención del uso de estimulantes de tipo anfetamínico entre los jóvenes: guía de políticas y programación (PDF) . Nueva York: Naciones Unidas. ISBN 978-92-1-148223-2. Archivado (PDF) desde el original el 16 de octubre de 2013 . Consultado el 11 de noviembre de 2013 .
- ^ a b "Lista de sustancias psicotrópicas sometidas a fiscalización internacional" (PDF) . Junta Internacional de Fiscalización de Estupefacientes . Naciones Unidas. Agosto de 2003. Archivado desde el original (PDF) el 5 de diciembre de 2005 . Consultado el 19 de noviembre de 2005 .
- ^ Cass WA, Smith MP, Peters LE (2006). "El calcitriol protege contra los efectos de agotamiento de la dopamina y la serotonina de las dosis neurotóxicas de metanfetamina". Anales de la Academia de Ciencias de Nueva York . 1074 (1): 261–71. Código bibliográfico : 2006NYASA1074..261C . doi : 10.1196 / annals.1369.023 . PMID 17105922 . S2CID 8537458 .
Otras lecturas
- Szalavitz M. "Por qué el mito del cerebro dañado por metanfetamina puede obstaculizar la recuperación" . Time.com . Time USA, LLC.
- Hart CL, Marvin CB, Silver R, Smith EE (febrero de 2012). "¿El funcionamiento cognitivo está alterado en los usuarios de metanfetamina? Una revisión crítica" . Neuropsicofarmacología . 37 (3): 586–608. doi : 10.1038 / npp.2011.276 . ISSN 0893-133X . PMC 3260986 . PMID 22089317 . Resumen de Lay - Time.com .
enlaces externos
- Entrada de toxina de metanfetamina
- Monografía de información sobre el envenenamiento por metanfetamina
- Tráfico de drogas: Operación de metanfetamina de la Hermandad Aria desmantelada , FBI
- Manifestaciones neurológicas del abuso crónico de metanfetamina

