Síntesis de quinolina de Niementowski
| Síntesis de quinolina de Niementowski | |
|---|---|
| Lleva el nombre de | Stefan Niementowski |
| Tipo de reacción | Reacción de formación de anillo |
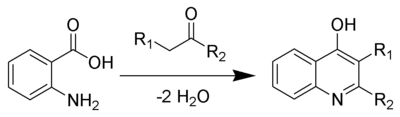
La síntesis de quinolina de Niementowski es la reacción química de ácidos antranílicos y cetonas (o aldehídos ) para formar derivados de γ-hidroxiquinolina. [1] [2] [3] [4]
Visión general
En 1894, Niementowski informó que se formó 2-fenil-4-hidroxiquinolina cuando el ácido antranílico y la acetofenona se calentaron a 120-130 ° C. Más tarde descubrió que a temperaturas más altas, 200 ° C, el ácido antranílico y el heptaldehído formaban rendimientos mínimos de 4-hidroxi-3-pentaquinolina. [5] Se han publicado varias revisiones. [6] [7]
Variaciones
Las temperaturas requeridas para esta reacción la hacen menos popular que otros procedimientos sintéticos de quinolina . Sin embargo, se han propuesto variaciones para hacer de esta una reacción más pragmática y útil. La adición de oxicloruro de fósforo a la mezcla de reacción media una condensación para producir ambos isómeros de un precursor importante de un importante antagonista de los receptores adrenérgicos α 1 . [8] Cuando se sustituye la posición 3 de una arilcetona, se ha demostrado que una reacción de tipo Niementowski con ácido propiónico puede producir una 4-hidroxiquinolina con un sustituto de 2-tiometilo. [9] El método también se ha modificado para que ocurra con una cantidad catalítica de base, [10] o en presencia de ácido polifosfórico. [11]
Mecanismo
Debido a la similitud de estos con los reactivos en la síntesis de quinolonas de Friedlander , un benzaldehído con un aldehído o cetona , el mecanismo de síntesis de quinolinas de Niementowski es mínimamente diferente al de la síntesis de Friedländer. Aunque se estudian en profundidad, son posibles dos vías de reacción y ambas cuentan con un apoyo significativo. [5]Se cree que la reacción comienza con la formación de una base de Schiff y luego procede a través de una condensación intramolecular para producir un intermedio de imina (ver más abajo). Luego hay una pérdida de agua que conduce al cierre del anillo y a la formación del derivado de quinolina. La mayoría de la evidencia apoya esto como el mecanismo en condiciones normales de 120-130 ° C. Alternativamente, la reacción comienza con una condensación intermolecular y la formación subsiguiente del intermedio de imina. [12] Se ha demostrado que este último es más común en condiciones ácidas o básicas. Se ha propuesto una vía similar para la síntesis de quinazolina de Niementowski . [13]
Referencias
- ^ Niementowski, S. v. (1894). "Synthesen der Chinolinderivate" . Chemische Berichte . 27 (2): 1394–1403. doi : 10.1002 / cber.18940270242 .
- ^ Niementowski, S. v .; Orzechowski, B. (1895). "Synthesen der Chinolinderivate aus Anthranilsäure und Aldehyden" . Chemische Berichte . 28 (3): 2809-2822. doi : 10.1002 / cber.18950280393 .
- ^ Niementowski, S. v. (1905). "Ueber die Einwirkung des Benzoylessigesters auf Anthranilsäure (III. Mittheilung über Synthesen der Chinolinderivate)" . Chemische Berichte . 38 (2): 2044–2051. doi : 10.1002 / cber.190503802142 .
- ^ Niementowski, S. v. (1907). "Über die Einwirkung des Benzoylessigesters auf Anthranilsäure auf Anthrailsäure" . Chemische Berichte . 40 (4): 4285–4294. doi : 10.1002 / cber.19070400444 .
- ↑ a b Hartz, págs. 376–384
- ^ Manske, RH (1942). "La química de las quinolinas". Chem. Rev. 30 : 127. doi : 10.1021 / cr60095a006 .
- ^ Hisano, T. (1973). "Estudios recientes sobre la síntesis de 4-quinazolona de Niementowski modificada. Una revisión". Org. Deberes. Proced. En t. 5 (4): 145-193. doi : 10.1080 / 00304947309355565 .
- ^ Rosini, M .; Anontello, A .; Cavalli, A .; Bolognesi, M .; Minarini, A .; Marucci, G .; Poggesi, E .; Melchiorre, C. (2003). "Compuestos relacionados con la prazosina. Efecto de la transformación de la fracción de piperazinilquinazolina en un sistema de aminometiltetrahidroacridina sobre la afinidad por los receptores adrenérgicos α1". J. Med. Chem. 46 (23): 4895–4903. doi : 10.1021 / jm030952q . PMID 14584940 .
- ^ Wang, M. -X., Liu, Y., Huang, Z, -T .; Liu; Huang (2001). "Síntesis novedosa y conveniente de quinolinas polifuncionalizadas, quinolonas y sus reacciones de anulación". Letras de tetraedro . 42 (13): 2553-2555. doi : 10.1016 / S0040-4039 (01) 00231-3 .CS1 maint: varios nombres: lista de autores ( enlace )
- ^ Chong, RJ; Siddiqui, MA; Sneickus, V. (1983). "La síntesis de 1,4,7-triazaciclononanos de anillo quiral". Letras de tetraedro . 43 (21): 3795–3798. doi : 10.1016 / S0040-4039 (02) 00705-0 .
- ↑ Nahnda Kumar, R., Suresh, T., Mylithi, A., Mohan, PS; Suresh; Mythili; Mohan (2001). "Una entrada fácil a las pirimido [4,5-b] quinolinas y sus análogos de tio" . Heterocycl. Comun . 7 (2): 193-198. doi : 10.1515 / HC.2001.7.2.193 .CS1 maint: varios nombres: lista de autores ( enlace )
- ^ Marco-Contelles, José; PéRez-Mayoral, Elena; Samadi, Abdelouahid; Carreiras, María do Carmo; Soriano, Elena (2009). "Avances recientes en la reacción de Friedländer". Revisiones químicas . 109 (6): 2652–2671. doi : 10.1021 / cr800482c . PMID 19361199 .
- ^ Hartz, págs. 440–453
Bibliografía
- Hartz, R. (2011) en Name Reactions in Heterocyclic Chemistry II , Jie Jack Li, EJ Corey (eds.), Wiley, ISBN 978-0-470-08508-0 .
Ver también
- Síntesis de quinolina de Camps
- Síntesis de Friedländer
- Reacción de Pfitzinger
- Reacciones de formación de anillos
- Reacciones de condensación
- Reacciones de formación de quinolina
- Reacciones de nombres