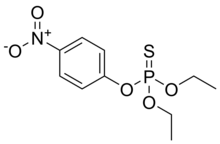
Paratión
 | |
 | |
| Nombres | |
|---|---|
| Nombre IUPAC preferido O , O- dietil O - (4-nitrofenil) fosforotioato | |
| Otros nombres E605 | |
| Identificadores | |
Modelo 3D ( JSmol ) | |
| 2059093 | |
| CHEBI | |
| CHEMBL | |
| ChemSpider | |
| Tarjeta de información ECHA | 100.000.247 |
| Número CE |
|
| KEGG | |
PubChem CID | |
| Número RTECS |
|
| UNII | |
| un numero | 3018 2783 |
Tablero CompTox ( EPA ) | |
| |
| |
| Propiedades | |
| C 10 H 14 N O 5 P S | |
| Masa molar | 291,26 g · mol −1 |
| Apariencia | Cristales blancos (forma pura) |
| Punto de fusion | 6 ° C (43 ° F; 279 K) |
| 24 mg / L | |
| Solubilidad en otros disolventes. | alta solubilidad |
| Riesgos | |
| Ficha de datos de seguridad | [1] |
| Pictogramas GHS |    |
| Palabra de señal GHS | Advertencia |
| H300 , H311 , H330 , H372 , H410 | |
| P260 , P264 , P270 , P271 , P273 , P280 , P284 , P301 + P310 , P302 + P352 , P304 + P340 , P310 , P312 , P314 , P320 , P321 , P322 , P330 , P361 , P363 , P391 , P403 + P233 , P405 , P501 | |
| NFPA 704 (diamante de fuego) |  4 1 2 |
| punto de inflamabilidad | 120 ° C (248 ° F; 393 K) |
| Dosis o concentración letal (LD, LC): | |
LD 50 ( dosis media ) | 5 mg / kg (ratón, oral) 10 mg / kg (conejo, oral) 3 mg / kg (perro, oral) 0,93 mg / kg (gato, oral) 5 mg / kg (caballo, oral) 8 mg / kg ( conejillo de indias, oral) 2 mg / kg (rata, oral) [3] |
LC 50 ( concentración media ) | 84 mg / m 3 (rata, 4 h) [3] |
LC Lo ( menor publicado ) | 50 mg / m 3 (conejo, 2 h) 14 mg / m 3 (conejillo de indias, 2 h) 15 mg / m 3 (ratón) [3] |
| NIOSH (límites de exposición a la salud de EE. UU.): | |
PEL (permitido) | ninguno (metil paratión), [1] TWA 0,1 mg / m 3 [piel] (etil paratión) [2] |
REL (recomendado) | TWA 0,2 mg / m 3 [piel] (metil paratión) [1] TWA 0,05 mg / m3 [piel] (etil paratión) [2] |
IDLH (peligro inmediato) | ND (metil paratión) [1] 10 mg / m 3 (etil paratión) [2] |
Salvo que se indique lo contrario, los datos se proporcionan para materiales en su estado estándar (a 25 ° C [77 ° F], 100 kPa). | |
| Referencias de Infobox | |
El paratión , también llamado paratión-etilo o dietil paratión y localmente [ clarificación necesaria ] conocido como " Folidol ", es un insecticida y acaricida organofosforado . Fue desarrollado originalmente por IG Farben en la década de 1940. Es altamente tóxico para los organismos no objetivo, incluidos los humanos, por lo que su uso ha sido prohibido o restringido en la mayoría de los países. La estructura básica la comparte el paratión metilo . [5]
Historia
El paratión fue desarrollado por Gerhard Schrader para el fideicomiso alemán IG Farben en la década de 1940. Después de la Segunda Guerra Mundial y el colapso de IG Farben debido a los juicios por crímenes de guerra, los aliados occidentales se apoderaron de la patente y el paratión fue comercializado en todo el mundo por diferentes compañías y bajo diferentes marcas. La marca alemana más común fue E605 (prohibida en Alemania después de 2002); este no era un " número E " de aditivo alimentario como el que se utiliza hoy en la UE. "E" significa Entwicklungsnummer (alemán para "número de desarrollo"). Es un inhibidor irreversible de la acetilcolinesterasa .
Los problemas de seguridad han llevado más tarde al desarrollo de paratión metilo , que es algo menos tóxico.
En la UE , el paratión se prohibió después de 2001. [6] En Suiza , la sustancia ya no está aprobada como plaguicida.
Propiedades de manipulación
El paratión puro es un sólido cristalino blanco. Se distribuye comúnmente como un líquido marrón que huele a huevos podridos o ajo . El insecticida es algo estable, aunque se oscurece cuando se expone a la luz solar.
Síntesis industrial
El paratión se sintetiza a partir del ácido dietil ditiofosfórico (C 2 H 5 O) 2 PS 2 H mediante cloración para generar cloruro de dietiltiofosforilo ((C 2 H 5 O) 2 P (S) Cl), y luego el cloruro se trata con sodio 4- nitrofenolato (la sal sódica del 4-nitrofenol ). [7]
- 2 (C 2 H 5 O) 2 P (S) SH + 3 Cl 2 → 2 (C 2 H 5 O) 2 P (S) Cl + S 2 Cl 2 + 2 HCl
- (C 2 H 5 O) 2 P (S) Cl + NaOC 6 H 4 NO 2 → (C 2 H 5 O) 2 P (S) OC 6 H 4 NO 2 + NaCl
Aplicaciones
Como plaguicida, el paratión se aplica generalmente por aspersión. A menudo se aplica al algodón , el arroz y los árboles frutales . Las concentraciones habituales de las soluciones listas para usar son del 0,05 al 0,1%. El producto químico está prohibido para su uso en muchos cultivos alimentarios.
Actividad insecticida
El paratión actúa indirectamente sobre la enzima acetilcolinesterasa . Después de que un insecto (o un ser humano) ingiera paratión, una oxidasa reemplaza el azufre de doble enlace con oxígeno para producir paraoxón . [8]
- (C 2 H 5 O) 2 P (S) OC 6 H 4 NO 2 + 1/2 O 2 → (C 2 H 5 O) 2 P (O) OC 6 H 4 NO 2 + S
El éster de fosfato es más reactivo en los organismos que el éster de fosforotiolato, ya que los átomos de fósforo se vuelven mucho más electropositivos. [8]
Degradación
La degradación del paratión conduce a productos más solubles en agua. La hidrólisis , que desactiva la molécula, se produce en el enlace del éster de arilo , lo que da como resultado tiofosfato de dietilo y 4-nitrofenol . [8]
- (C 2 H 5 O) 2 P (S) OC 6 H 4 NO 2 + H 2 O → HOC 6 H 4 NO 2 + (C 2 H 5 O) 2 P (S) OH
La degradación se produce de forma diferente en condiciones anaeróbicas : el grupo nitro del paratión se reduce a la amina .
- (C 2 H 5 O) 2 P (S) OC 6 H 4 NO 2 + 6 H → (C 2 H 5 O) 2 P (S) OC 6 H 4 NH 2 + 2 H 2 O
La seguridad
El paratión es un inhibidor de la colinesterasa . Por lo general, altera el sistema nervioso al inhibir la acetilcolinesterasa . Se absorbe a través de la piel, las membranas mucosas y por vía oral. El paratión absorbido se metaboliza rápidamente a paraoxón, como se describe en Actividad insecticida . La exposición al paraoxón puede provocar dolores de cabeza , convulsiones , mala visión, vómitos , dolor abdominal, diarrea intensa , pérdida del conocimiento , temblores , disnea y, finalmente , edema pulmonar.así como paro respiratorio. Se sabe que los síntomas de intoxicación duran períodos prolongados, a veces meses. El antídoto más común y muy específico es la atropina , en dosis de hasta 100 mg diarios. Debido a que la atropina también puede ser tóxica, se recomienda que se utilicen pequeñas dosis repetidas con frecuencia en el tratamiento. Si la intoxicación humana se detecta a tiempo y el tratamiento es rápido (atropina y respiración artificial), las muertes son poco frecuentes. La insuficiencia de oxígeno provocará hipoxia cerebral y daño cerebral permanente. La neuropatía periférica, incluida la parálisis, se observa como secuelas tardías.después de la recuperación de una intoxicación aguda. El paratión y los plaguicidas organofosforados relacionados se utilizan en cientos de miles de intoxicaciones al año, especialmente en suicidios. [9] Se conoce como Schwiegermuttergift (veneno para suegra) en Alemania. Por esta razón, la mayoría de las formulaciones contienen un tinte azul que advierte.
El paratión fue utilizado como agente de guerra química , sobre todo por un elemento de la Policía Británica de Sudáfrica (BSAP) adjunto a los Exploradores de Selous durante la Guerra de Rhodesia Bush . Lo usaron para envenenar la ropa que luego se entregó a las guerrillas antigubernamentales. Cuando los soldados enemigos se pusieron la ropa, fueron envenenados por absorción a través de la piel. [10] [11] [12]
Según estudios en animales, la Agencia de Protección Ambiental de EE. UU. Considera que el paratión es un posible carcinógeno humano . [13] Los estudios muestran que el paratión es tóxico para los fetos, pero no causa defectos de nacimiento. [14]
Está clasificado por el Programa de las Naciones Unidas para el Medio Ambiente (PNUMA) como un contaminante orgánico persistente [ cita requerida ] y por la Organización Mundial de la Salud (OMS) como Toxicidad Clase Ia (extremadamente peligroso). [ cita requerida ]
El paratión es tóxico para las abejas , los peces , las aves y otras formas de vida silvestre. [14]
Protección contra el envenenamiento
Para proporcionar al usuario final un estándar mínimo de protección, normalmente se usan guantes protectores adecuados, ropa y un respirador con cartuchos para vapores orgánicos. La seguridad industrial durante el proceso de producción requiere una ventilación especial y una medición continua de la contaminación del aire para no superar los niveles de PEL, así como una cuidadosa atención a la higiene personal. El análisis frecuente de la actividad de la acetilcolinesterasa sérica de los trabajadores también es útil con respecto a la seguridad ocupacional, porque la acción del paratión es acumulativa. Además, la atropina se ha utilizado como antídoto específico.
Ver también
- Toxicidad de plaguicidas para las abejas
- Metilo de paratión
Referencias
- ^ a b c Guía de bolsillo de NIOSH sobre peligros químicos. "# 0427" . Instituto Nacional de Seguridad y Salud Ocupacional (NIOSH).
- ^ a b c Guía de bolsillo de NIOSH sobre peligros químicos. "# 0479" . Instituto Nacional de Seguridad y Salud Ocupacional (NIOSH).
- ^ a b c "Paratión" . Concentraciones inmediatamente peligrosas para la vida o la salud (IDLH) . Instituto Nacional de Seguridad y Salud Ocupacional (NIOSH).
- ^ "Copia archivada" . Archivado desde el original el 17 de febrero de 2015 . Consultado el 13 de marzo de 2015 .CS1 maint: copia archivada como título ( enlace )
- ^ "Paratión" . www.fao.org . Consultado el 17 de abril de 2020 .
- ^ No inclusión del paratión en el anexo I de la Directiva del Consejo 91/414 / CEE
- ^ Cuota, DC; Gard, DR; Yang, C. (2005). "Compuestos de fósforo". Enciclopedia Kirk-Othmer de tecnología química . Nueva York: John Wiley & Sons. doi : 10.1002 / 0471238961.16081519060505.a01.pub2 . ISBN 978-0471238966.
- ↑ a b c Metcalf, RL (2002). "Control de insectos". Enciclopedia de química industrial de Ullmann . Nueva York: Wiley-VCH Verlag GmbH & Co. KGaA. doi : 10.1002 / 14356007.a14_263 . ISBN 978-3527306732.
- ^ Litchfield, MH "Estimaciones de intoxicación aguda por plaguicidas en trabajadores agrícolas en países menos desarrollados" Reseñas de toxicología 2005, volumen 24, págs. 271-8. PMID 16499408
- ^ "Veneno en Rhodesia" (PDF) . 31 de enero de 2019. Cite journal requiere
|journal=( ayuda ) - ^ "Guerra sucia: Rhodesia y guerra química biológica 1975-1980 (revisión del libro)" . PRISM | Universidad de Defensa Nacional .
- ^ Cruz, Glenn (2017). Guerra sucia: Rhodesia y la guerra química biológica, 1975–1980 . Solihull, Reino Unido: Helion & Company. ISBN 978-1-911512-12-7.
- ^ "Paratión" . Sistema Integrado de Información de Riesgos . Agencia de Protección Ambiental de EE . UU . 26 de enero de 2007.
- ^ a b "Perfiles de información de plaguicidas - paratión" . Extensión de la Red de Toxicología . Universidad Estatal de Oregon . Septiembre de 1993.
enlaces externos
- Paratión en la base de datos de propiedades de plaguicidas (PPDB)
- ATSDR - Informe del panel de expertos en metilparatión Departamento de Salud y Servicios Humanos de EE . UU . (Dominio público)
- CDC - Guía de bolsillo de NIOSH sobre peligros químicos Departamento de Salud y Servicios Humanos de EE . UU . (Dominio público)
- Etil paratión: Tarjeta internacional de seguridad química 0006
- Metilparatión: Ficha internacional de seguridad química 0626
- Plaguicidas obsoletos
- Insecticidas organofosforados
- Inhibidores de la acetilcolinesterasa
- Fosforotioatos
- Nitrobencenos
- Carcinógenos del Grupo 2B de la IARC
- Ésteres de fenol
- Ésteres etílicos