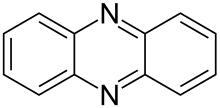
Fenazina
 | |
 | |
| Nombres | |
|---|---|
| Nombre IUPAC preferido Fenazina [1] | |
| Otros nombres Dibenzopirazina 9,10-Diazaantraceno Azofenilen acridizina | |
| Identificadores | |
Modelo 3D ( JSmol ) | |
| CHEBI | |
| CHEMBL | |
| ChemSpider | |
| Tarjeta de información ECHA | 100.001.995 |
PubChem CID | |
| UNII | |
Tablero CompTox ( EPA ) | |
| |
| |
| Propiedades | |
| C 12 H 8 N 2 | |
| Masa molar | 180,21 g / mol |
| Apariencia | polvo cristalino amarillo a marrón |
| Densidad | 1,25 g / cm 3 |
| Punto de fusion | 174–177 ° C (345–351 ° F; 447–450 K) |
| Punto de ebullición | 357,2 ° C (675,0 ° F; 630,3 K) a 760 mmHg |
| insoluble en agua | |
| Riesgos | |
| punto de inflamabilidad | 160,3 ° C (320,5 ° F; 433,4 K) |
Salvo que se indique lo contrario, los datos se proporcionan para materiales en su estado estándar (a 25 ° C [77 ° F], 100 kPa). | |
| Referencias de Infobox | |
La fenazina es un compuesto orgánico con la fórmula (C 6 H 4 ) 2 N 2 . Es un dibenzo annulated pirazina , y la sustancia madre de muchos colorantes , tales como el toluilen rojo , indulines , y safraninas (y los eurhodines estrechamente relacionadas). [2] La fenazina cristaliza en agujas amarillas, que son escasamente solubles en alcohol . El ácido sulfúrico lo disuelve, formando una solución de color rojo oscuro.
Síntesis
Clásicamente, la fenazina se prepara mediante la reacción de nitrobenceno y anilina en la reacción de Wohl-Aue . Otros métodos incluyen:
- pirólisis de la sal de bario de azobenzoato
- oxidación de anilina con óxido de plomo
- oxidación de dihidrofenazina, que se prepara calentando pirocatequina con o-fenilendiamina .
- oxidación de orto-aminodifenilamina con peróxido de plomo .
Derivados
- Los fenazinas más complejos, tales como los naphthophenazines , naphthazines , y naphthotolazines , se pueden preparar por condensación de orto-diaminas con orto-quinonas [3] o por la oxidación de una orto-diamina en presencia de α- naftol , y por el descomposición de orto-anilido - (- toluidido- etcétera) - compuestos azo con ácidos diluidos .
- Si se utilizan alquil o aril-orto-diaminas, se obtienen bases de azonio . Las azinas son en su mayoría de color amarillo, se destilan sin cambios y son estables a los oxidantes . Se añaden fácilmente yoduros de alquilo , formando sales de alquilazonio, teniendo lugar también la formación de anhídrido entre estos grupos hidroxilo . Se disuelve en ácido sulfúrico concentrado con una fluorescencia verde amarillenta .
- Las rodaminas , que están estrechamente relacionadas con las ftaleínas, se forman por condensación de los alquil metaaminofenoles con anhídrido ftálico en presencia de ácido sulfúrico. Sus sales son tintes rojos finos. Por la entrada de grupos amino o hidroxilo en la molécula se forman los colorantes. Los derivados monoamino o eurodinas se obtienen cuando las arilmonaminas se condensan con compuestos ortoaminoazo; condensando quinona diclorimida o para-nitrosodimetil anilina con monaminas que contienen una posición para libre, o oxidando orto-hidroxidiaminodipbenilaminas. Son sólidos de color rojo amarillento, que se comportan como bases débiles, sus sales sufren disociación hidrolítica en solución acuosa . Cuando se calienta con ácido clorhídrico concentrado , el grupo amino se reemplaza por el grupo hidroxilo y se producen los eurodol fenólicos .
Aminofenazina
Muchas aminofenazinas son colorantes prominentes. Dos de los primeros tintes sintéticos son las aminofenazinas, que incluyen indulina y nigrosina . [2]
La diaminofenazina simétrica es la sustancia madre del importante colorante rojo neutro (dimetildiaminotolfenazina). Se obtiene por oxidación de orto-fenilendiamina con cloruro férrico .
En un proceso relacionado, la oxidación de una mezcla fría de para -aminodimetilanilina y meta -toluilendiamina da azul de toluileno. Esta indamina se forma como un producto intermedio y pasa al rojo cuando se hierve; y también por oxidación de dimetilparanfenilendiatina con metatoluilendiamina. Cristaliza en agujas de color rojo anaranjado y su solución alcohólica presenta una fuerte fluorescencia. Tiñe la seda y el algodón mordado de un fino escarlata. Se conoce comercialmente como rojo neutro . Para las sales de fenazonio , vea safranina . La benzo [c] cinolina es un isómerode fenazina, con la que tiene la misma relación que el fenantreno con el antraceno .
Productos naturales
Las únicas fuentes biológicas conocidas de compuestos de fenazina son de naturaleza bacteriana. [4] Algunos de los géneros conocidos por producir fenazinas incluyen Pseudomonas spp., Streptomyces spp. Y Pantoea agglomerans . Estos productos naturales de fenazina se han relacionado con la virulencia y la aptitud competitiva de los organismos productores. Por ejemplo, la fenazina piocianina producida por Pseudomonas aeruginosa contribuye a su capacidad para colonizar los pulmones de pacientes con fibrosis quística . De manera similar, el ácido fenazina-1-carboxílico, producido por una serie de Pseudomonas, aumenta la supervivencia en el suelo y se ha demostrado que es esencial para laactividad de control biológico de determinadas cepas. [5] [6] [7]
Biosíntesis
La biosíntesis de fenazina se ramifica de la vía del ácido shikímico en un punto posterior al ácido corísmico . A continuación, se unen dos moléculas de este intermedio derivado de corismato de forma diagonalmente simétrica para formar el armazón básico de fenazina. Las modificaciones secuenciales conducen luego a una variedad de fenazina con diferentes actividades biológicas . Un ejemplo de alcaloides fenazínicos son la piocianina , el ácido safénico y las esmeraldas .
Referencias
- ^ Nomenclatura de la química orgánica: Recomendaciones de la IUPAC y nombres preferidos 2013 (Libro azul) . Cambridge: La Real Sociedad de Química . 2014. p. 211. doi : 10.1039 / 9781849733069-FP001 . ISBN 978-0-85404-182-4.
- ↑ a b Horst Berneth (2012). "Tintes Azine". Enciclopedia de química industrial de Ullmann . Weinheim: Wiley-VCH. doi : 10.1002 / 14356007.a03_213.pub3 .
- ^ Alexander R. Surrey (1955). "Piocianina" . Síntesis orgánicas .; Volumen colectivo , 3 , p. 753
- ^ Pierson, Leland S .; Pierson, Elizabeth A. (2010). "Metabolismo y función de las fenazinas en bacterias: impactos en el comportamiento de las bacterias en el medio ambiente y procesos biotecnológicos" . Microbiología y Biotecnología Aplicadas . 86 (6): 1659–1670. doi : 10.1007 / s00253-010-2509-3 . ISSN 0175-7598 . PMC 2858273 . PMID 20352425 .
- ^ Turner, JM y AJ Messenger (1986). "Ocurrencia, bioquímica y fisiología de la producción de pigmentos de fenazina". Avances en fisiología microbiana . Avances en fisiología microbiana. 27 : 211-275. doi : 10.1016 / S0065-2911 (08) 60306-9 . ISBN 978-0-12-027727-8.
- ^ McDonald, M., DV Mavrodi; et al. (2001). "Biosíntesis de fenazina en Pseudomonas fluorescens: punto de ramificación de la vía biosintética primaria de shikimato y papel del ácido fenazina-1,6-dicarboxílico". Mermelada. Chem. Soc. 123 (38): 9459–9460. doi : 10.1021 / ja011243 . PMID 11562236 . CS1 maint: varios nombres: lista de autores ( enlace )
- ^ Dietrich LE, Okegbe C, Price-Whelan A, Sakhtah H, Hunter RC, Newman DK (2013). "La morfogénesis de la comunidad bacteriana está íntimamente ligada al estado redox intracelular" (PDF) . Revista de bacteriología . 195 (7): 1371–80. doi : 10.1128 / JB.02273-12 . PMC 3624522 . PMID 23292774 .
Este artículo incorpora texto de una publicación que ahora es de dominio público : Chisholm, Hugh, ed. (1911). " Fenazina ". Encyclopædia Britannica . 21 (11ª ed.). Prensa de la Universidad de Cambridge. págs. 364–365.
- Tintes azin
- Fenazinas