Phi X 174
| Virus de Escherichia ΦX174 | |
|---|---|
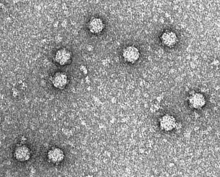 | |
| Micrografía electrónica del fago ΦX174 | |
| Clasificación de virus | |
| (no clasificado): | Virus |
| Reino : | Monodnaviria |
| Reino: | Sangervirae |
| Filo: | Phixviricota |
| Clase: | Malgrandaviricetes |
| Pedido: | Petitvirales |
| Familia: | Microviridae |
| Género: | Sinsheimervirus |
| Especies: | Virus de Escherichia ΦX174 |
El bacteriófago phi X 174 (o ΦX174 ) es un virus de ADN monocatenario ( ssDNA ) que infecta a Escherichia coli y es el primer genoma basado en ADN que se secuencia. Fred Sanger y su equipo completaron este trabajo en 1977. [1] En 1962, Walter Fiers y Robert Sinsheimer ya habían demostrado la circularidad física, covalentemente cerrada, del ADN ΦX174. [2] El ganador del premio Nobel Arthur Kornberg usó ΦX174 como modelo para demostrar primero que el ADN sintetizado en un tubo de ensayo por enzimas purificadas podría producir todas las características de un virus natural, marcando el comienzo de la era debiología sintética . [3] [4] En 1972-1974, Jerard Hurwitz , Sue Wickner y Reed Wickner con colaboradores identificaron los genes necesarios para producir las enzimas para catalizar la conversión de la forma monocatenaria del virus a la forma replicativa bicatenaria. [5] En 2003, el grupo de Craig Venter informó que el genoma de ΦX174 fue el primero en ensamblarse completamente in vitro a partir de oligonucleótidos sintetizados. [6] La partícula del virus ΦX174 también se ha ensamblado con éxito in vitro . [7] En 2012, se demostró que es altamenteel genoma superpuesto puede descomprimirse por completo y seguir siendo funcional. [8]
Genoma
Este bacteriófago tiene un genoma de ADN monocatenario circular con sentido [+] de 5.386 nucleótidos . [9] El contenido de GC del genoma es del 44% y el 95% de los nucleótidos pertenecen a genes codificadores. Debido al patrón de equilibrio de la base del genoma, se utiliza como ADN de control para los secuenciadores de Illumina.
Genes
ΦX174 codifica 11 genes, nombrados como letras consecutivas del alfabeto en el orden en que fueron descubiertos, con la excepción de A *, que es un codón de inicio alternativo dentro de los genes A grandes. Se cree que solo los genes A * y K no son esenciales, aunque existen algunas dudas sobre A * porque su codón de inicio podría cambiarse a ATT pero no a ninguna otra secuencia. [10] Ahora se sabe que el ATT todavía es capaz de producir proteínas [11] dentro de E. coli y, por lo tanto, este gen puede no ser esencial.
El fago ΦX174 se ha utilizado para intentar establecer la ausencia de información genética no descubierta mediante un enfoque de "prueba por síntesis". [12]
Transcriptoma
En 2020, se generó el transcriptoma de ΦX174. [13] Las características notables del transcriptoma ΦX174 es una serie de hasta cuatro promotores relativamente débiles en serie con hasta cuatro terminadores independientes de Rho (intrínsecos) y un terminador dependiente de Rho.
Proteínas
ΦX174 codifica 11 proteínas .
| Proteína | Copias | Función [14] |
|---|---|---|
| A | - | Nicks RF DNA para iniciar la replicación del círculo rodante ; liga los extremos del ADN del fago lineal para formar ADN circular monocatenario |
| A* | - | Inhibe la replicación del ADN de la célula huésped; bloquea los fagos superinfectantes; no esencial |
| B | 60 en procapsid | Proteína de andamiaje interno involucrada en el ensamblaje de procapside |
| C | - | Embalaje de ADN |
| D | 240 en procapsid | Proteína de andamiaje externo involucrada en el ensamblaje de procapside |
| mi | - | Lisis de la célula huésped |
| F | 60 en virión | Proteína de la cápside principal |
| GRAMO | 60 en virión | Proteína de pico principal |
| H | 12 en virión | Proteína piloto de ADN (o proteína de pico menor) |
| J | 60 en virión | Se une a un nuevo ADN de fago monocatenario; acompaña al ADN del fago en la procapsida |
| K | - | Optimiza el tamaño de la ráfaga; no esencial |
Proteoma
Recientemente se ha informado de la identificación de todas las proteínas ΦX174 mediante espectrometría de masas. [15]
Ciclo de infección
La infección comienza cuando la proteína G se une a los lipopolisacáridos en la superficie de la célula huésped bacteriana. Proteína H (o la proteína ADN Pilot) pilotos del genoma viral a través de la membrana bacteriana de E. coli bacterias [16] más probable a través de un predicho N-terminal de dominio transmembrana hélice. [17] Sin embargo, se ha hecho evidente que la proteína H es una proteína multifuncional. [18] Esta es la única proteína de la cápside viral de ΦX174 que carece de estructura cristalina por un par de razones. Tiene bajo contenido aromático y alto contenido de glicina.contenido, lo que hace que la estructura de la proteína sea muy flexible y, además, los átomos de hidrógeno individuales (el grupo R de las glicinas) son difíciles de detectar en la cristalografía de proteínas. Además, la proteína H induce la lisis del huésped bacteriano a altas concentraciones ya que la hélice transmembrana N-terminal predicha fácilmente perfora agujeros a través de la pared bacteriana. Por bioinformática , esta proteína contiene cuatro dominios de espirales en espiral pronosticados que tienen una homología significativa con factores de transcripción conocidos. Además, se determinó que la proteína H de novo era necesaria para la síntesis óptima de otras proteínas virales. [19] Las mutaciones en la proteína H que previenen la incorporación viral pueden superarse cuando se suministran cantidades excesivas de proteína B, la proteína de andamiaje interno.
El ADN se expulsa a través de un canal hidrófilo en el vértice quíntuple. [20] Se entiende que la proteína H reside en esta área, pero la evidencia experimental no ha verificado su ubicación exacta. Una vez dentro de la bacteria huésped, la replicación del genoma de ADNss [+] procede a través de un intermedio de ADN de sentido negativo . Esto se hace cuando el genoma del fago se enrolla y la estructura secundaria formada por dicho superenrollamiento atrae a un primosoma.complejo proteico. Esto se trasloca una vez alrededor del genoma y sintetiza un ADNss [-] del genoma original positivo. [+] Los genomas de ssDNA que se empaquetan en virus se crean a partir de esto mediante un mecanismo de círculo rodante. Este es el mecanismo por el cual el genoma superenrollado de doble hebra es cortado en la hebra positiva por una proteína A codificada por el virus, que también atrae una ADN polimerasa bacteriana (DNAP) al sitio de escisión. DNAP utiliza la hebra negativa como plantilla para dar sentido positivo al ADN. A medida que se desplaza por el genoma, desplaza la hebra externa de ADN ya sintetizado, que inmediatamente se recubre con proteínas SSBP . La proteína A escinde el genoma completo cada vez que reconoce la secuencia de origen.
Como la proteína D es la transcripción génica más abundante, es la más proteína en la procapside viral. De manera similar, las transcripciones de genes para F, J y G son más abundantes que para H, ya que la estequiometría para estas proteínas estructurales es 5: 5: 5: 1. Los primosomas son complejos de proteínas que unen / se unen a la enzima helicasa en la plantilla. Los primosomas proporcionan cebadores de ARN para la síntesis de ADN en hebras.
Filogenia y diversidad
ΦX174 está estrechamente relacionado con otros microviridae , especialmente el fago NC (p. Ej., NC1, NC7, NC11, NC16, NC37, NC5, NC41, NC56, NC51, etc.) y está más distante con los fagos similares a G4 e incluso más distante al fago similar a α3. Rokyta y col. 2006 presentó un árbol filogenético de sus relaciones. [21]
Usos
Evolución experimental
ΦX174 se ha utilizado como organismo modelo en muchos experimentos de evolución. [22]
Biotecnología
ΦX174 se usa regularmente como control positivo en la secuenciación de ADN debido a su tamaño genómico relativamente pequeño en comparación con otros organismos, su contenido de nucleótidos relativamente equilibrado: aproximadamente 23% G, 22% C, 24% A y 31% T, es decir, 45% G + C y 55% A + T, ver la accesión NC_001422.1 [9] para su secuencia larga de 5.386 nucleótidos. Los instrumentos de secuenciación de Illumina utilizan ΦX174 como control positivo, [23] y una sola secuencia de secuenciación de Illumina puede cubrir el genoma de ΦX174 varios millones de veces, lo que hace que este sea probablemente el genoma más secuenciado de la historia. [ cita requerida ]
ΦX174 también se utiliza para probar la resistencia del equipo de protección personal a los virus transmitidos por la sangre. [24]
ΦX174 también se ha modificado para permitir la presentación de péptidos (presentación de fagos) de la proteína G de la cápside viral. [25]
Biología sintética
El genoma de ΦX174 fue el primer fago que se clonó en levadura, [26] lo que proporciona un dique seco conveniente para las modificaciones del genoma. [27] ΦX174 también fue el primer genoma en descomprimirse por completo, habiéndose eliminado todas las superposiciones de genes. El efecto de estos cambios resultó en una reducción significativa de la adhesión al hospedador, desregulación de la expresión de proteínas y sensibilidad al calor. [28]
Ver también
- Bacteriófago MS2
Referencias
- ^ Sanger F, Air GM, Barrell BG, Brown NL, Coulson AR, Fiddes CA, et al. (Febrero de 1977). "Secuencia de nucleótidos del ADN del bacteriófago phi X174". Naturaleza . 265 (5596): 687–95. Código Bibliográfico : 1977Natur.265..687S . doi : 10.1038 / 265687a0 . PMID 870828 . S2CID 4206886 .
- ^ Fiers W, Sinsheimer RL (octubre de 1962). "La estructura del ADN del bacteriófago phi-X174. III. Evidencia ultracentrífuga de una estructura de anillo". Revista de Biología Molecular . 5 (4): 424–34. doi : 10.1016 / S0022-2836 (62) 80031-X . PMID 13945085 .
- ^ Perfiles de la Biblioteca Nacional de Medicina en Ciencias. Los papeles de Arthur Kornberg. "Creando vida en el tubo de ensayo", 1959-1970. enlace [ fuente no primaria necesaria ]
- ^ Goulian M, Kornberg A, Sinsheimer RL (diciembre de 1967). "Síntesis enzimática de ADN, XXIV. Síntesis de ADN del fago phi-X174 infeccioso" . Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 58 (6): 2321–8. Código Bibliográfico : 1967PNAS ... 58.2321G . doi : 10.1073 / pnas.58.6.2321 . JSTOR 58720 . PMC 223838 . PMID 4873588 .
- ^ Wickner S, Hurwitz J (octubre de 1974). "Conversión de ADN viral phiX174 a forma bicatenaria mediante proteínas de Escherichia coli purificadas" . Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 71 (10): 4120–4. doi : 10.1073 / pnas.71.10.4120 . PMC 434340 . PMID 4610569 .
- ^ Smith HO, Hutchison CA, Pfannkoch C, Venter JC (diciembre de 2003). "Generación de un genoma sintético por ensamblaje de genoma completo: bacteriófago phiX174 a partir de oligonucleótidos sintéticos" . Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 100 (26): 15440–5. Código Bib : 2003PNAS..10015440S . doi : 10.1073 / pnas.2237126100 . JSTOR 3149024 . PMC 307586 . PMID 14657399 .
- ^ Cherwa JE, Organtini LJ, Ashley RE, Hafenstein SL, Fane BA (septiembre de 2011). "ENSAMBLE EN VITRO de la procapside øX174 de oligómeros proteicos de andamiaje externo e intermedios de ensamblaje pentamérico temprano". Revista de Biología Molecular . 412 (3): 387–96. doi : 10.1016 / j.jmb.2011.07.070 . PMID 21840317 .
- ^ Jaschke PR, Lieberman EK, Rodriguez J, Sierra A, Endy D (diciembre de 2012). "Un genoma del bacteriófago sintético øX174 completamente descomprimido ensamblado y archivado en levadura" . Virología . 434 (2): 278–84. doi : 10.1016 / j.virol.2012.09.020 . PMID 23079106 .
- ^ a b c Enterobacteria fago phiX174 sensu lato , genoma completo. "Genoma completo: acceso NC_001422" , Centro Nacional de Información Biotecnológica . Consultado el 30 de enero de 2016.
- ^ Baas PD, Liewerink H, van Teeffelen HA, van Mansfeld AD, van Boom JH, Jansz HS (junio de 1987). "La alteración del codón de inicio ATG de la proteína A del bacteriófago phi X174 en un codón ATT produce un fago viable que indica que la proteína A no es esencial para la reproducción phi X174" . Cartas FEBS . 218 (1): 119-25. doi : 10.1016 / 0014-5793 (87) 81030-x . PMID 2954853 . S2CID 24174007 .
- ^ Hecht A, Glasgow J, Jaschke PR, Bawazer LA, Munson MS, Cochran JR, et al. (Abril de 2017). "Medidas de iniciación de la traducción de los 64 codones en E. coli" . Investigación de ácidos nucleicos . 45 (7): 3615–3626. doi : 10.1093 / nar / gkx070 . PMC 5397182 . PMID 28334756 .
- ^ Jaschke PR, Dotson GA, Hung KS, Liu D, Endy D (noviembre de 2019). "Demostración definitiva por síntesis de la completitud de la anotación del genoma" . Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 116 (48): 24206–24213. doi : 10.1073 / pnas.1905990116 . PMC 6883844 . PMID 31719208 .
- ^ Logel DY, Jaschke PR (agosto de 2020). "Un mapa de alta resolución de la transcripción del bacteriófago ϕX174". Virología . 547 : 47–56. doi : 10.1016 / j.virol.2020.05.008 . PMID 32560904 . S2CID 219459208 .
- ^ Fane BA, Brentlinger KL, Burch AD, Chen M, Hafenstein S, Moore E, Novak CR, Uchiyama A (2006). "ɸX174 et al., los Microviridae ". En Calender R (ed.). Los bacteriófagos (2ª ed.). Nueva York: Oxford Univ. Presionar. pag. 130. ISBN 978-0195148503.
- ^ Wright BW, Ruan J, Molloy MP, Jaschke PR (noviembre de 2020). "La modularización del genoma revela que la topología de genes superpuestos es necesaria para una reproducción viral eficiente". Biología sintética ACS . 9 (11): 3079-3090. doi : 10.1021 / acssynbio.0c00323 . PMID 33044064 . S2CID 222300240 .
- ^ Jazwinski SM, Lindberg AA, Kornberg A (julio de 1975). "El receptor de lipopolisacáridos para bacteriófagos phiX174 y S13". Virología . 66 (1): 268–82. doi : 10.1016 / 0042-6822 (75) 90197-x . PMID 1094681 .
- ^ Tusnády GE, Simon I (septiembre de 2001). "El servidor de predicción de topología transmembrana HMMTOP" . Bioinformática . 17 (9): 849–50. doi : 10.1093 / bioinformatics / 17.9.849 . PMID 11590105 .
- ^ Cherwa JE, Young LN, Fane BA (marzo de 2011). "Desacoplamiento de las funciones de una proteína multifuncional: el aislamiento de una proteína piloto de ADN mutante que afecta la morfogénesis de las partículas" . Virología . 411 (1): 9-14. doi : 10.1016 / j.virol.2010.12.026 . PMID 21227478 .
- ^ Ruboyianes MV, Chen M, Dubrava MS, Cherwa JE, Fane BA (octubre de 2009). "La expresión de proteínas piloto de ADN de deleción N-terminal inhibe las primeras etapas de la replicación de phiX174" . Revista de Virología . 83 (19): 9952–6. doi : 10.1128 / JVI.01077-09 . PMC 2748053 . PMID 19640994 .
- ^ McKenna R, Xia D, Willingmann P, Ilag LL, Krishnaswamy S, Rossmann MG, et al. (Enero de 1992). "Estructura atómica del bacteriófago phi X174 de ADN monocatenario y sus implicaciones funcionales" . Naturaleza . 355 (6356): 137–43. Código Bibliográfico : 1992Natur.355..137M . doi : 10.1038 / 355137a0 . PMC 4167681 . PMID 1370343 .
- ^ Rokyta DR, Burch CL, Caudle SB, Wichman HA (febrero de 2006). "Transferencia horizontal de genes y evolución de genomas de colifagos de microviridos" . Revista de bacteriología . 188 (3): 1134–42. doi : 10.1128 / JB.188.3.1134-1142.2006 . PMC 1347346 . PMID 16428417 .
- ^ Wichman HA, Brown CJ (agosto de 2010). "Evolución experimental de virus: Microviridae como sistema modelo" . Transacciones filosóficas de la Royal Society de Londres. Serie B, Ciencias Biológicas . 365 (1552): 2495–501. doi : 10.1098 / rstb.2010.0053 . PMC 2935103 . PMID 20643739 .
- ^ "Uso de un control PhiX para ejecuciones de secuenciación de HiSeq®" . Illumina. Archivado desde el original el 9 de enero de 2019 . Consultado el 8 de enero de 2019 .
- ^ "PPE-Info - Detalles estándar" . wwwn.cdc.gov . Consultado el 8 de febrero de 2019 .
- ^ Christakos KJ, Chapman JA, Fane BA, Campos SK (enero de 2016). "PhiXing-it, mostrando péptidos extraños en el bacteriófago ΦX174" . Virología . 488 : 242–8. doi : 10.1016 / j.virol.2015.11.021 . PMC 6191337 . PMID 26655242 .
- ^ Jaschke PR, Lieberman EK, Rodriguez J, Sierra A, Endy D (diciembre de 2012). "Un genoma del bacteriófago sintético øX174 completamente descomprimido ensamblado y archivado en levadura" . Virología . 434 (2): 278–84. doi : 10.1016 / j.virol.2012.09.020 . PMID 23079106 .
- ^ Ando H, Lemire S, Pires DP, Lu TK (septiembre de 2015). "Ingeniería de andamios virales modulares para la edición de poblaciones bacterianas dirigidas" . Sistemas celulares . 1 (3): 187-196. doi : 10.1016 / j.cels.2015.08.013 . PMC 4785837 . PMID 26973885 .
- ^ Wright BW, Ruan J, Molloy MP, Jaschke PR (noviembre de 2020). "La modularización del genoma revela que la topología de genes superpuestos es necesaria para una reproducción viral eficiente". Biología sintética ACS . 9 (11): 3079-3090. doi : 10.1021 / acssynbio.0c00323 . PMID 33044064 . S2CID 222300240 .
enlaces externos
- Goodsell D (febrero de 2000). "Bacteriófago phiX174" . Molécula del mes . RCSB-PDB.
- Microviridae

