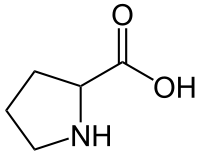
 fórmula esquelética de prolina | |||
| Nombres | |||
|---|---|---|---|
| Nombre IUPAC Prolina | |||
| Nombre IUPAC sistemático Ácido pirrolidina-2-carboxílico [1] | |||
| Identificadores | |||
Modelo 3D ( JSmol ) |
| ||
| 80812 | |||
| CHEBI | |||
| CHEMBL | |||
| ChemSpider | |||
| DrugBank | |||
| Tarjeta de información ECHA | 100.009.264 | ||
| Número CE |
| ||
| 26927 | |||
| KEGG | |||
| Malla | Prolina | ||
PubChem CID | |||
| Número RTECS |
| ||
| UNII |
| ||
Tablero CompTox ( EPA ) |
| ||
InChI
| |||
Sonrisas
| |||
| Propiedades | |||
Fórmula química | C 5 H 9 N O 2 | ||
| Masa molar | 115,132 g · mol −1 | ||
| Apariencia | Cristales transparentes | ||
| Punto de fusion | 205 a 228 ° C (401 a 442 ° F; 478 a 501 K) (se descompone) | ||
| Solubilidad | 1,5 g / 100 g de etanol a 19 ° C [3] | ||
| log P | -0,06 | ||
| Acidez (p K a ) | 1,99 (carboxilo), 10,96 (amino) [4] | ||
| Peligros | |||
| Ficha de datos de seguridad | Ver: página de datos | ||
| Frases S (desactualizadas) | S22 , S24 / 25 | ||
| Página de datos complementarios | |||
Estructura y propiedades | Índice de refracción ( n ), constante dieléctrica (ε r ), etc. | ||
Datos termodinámicos | Comportamiento de fase sólido-líquido-gas | ||
Datos espectrales | UV , IR , RMN , MS | ||
Salvo que se indique lo contrario, los datos se proporcionan para materiales en su estado estándar (a 25 ° C [77 ° F], 100 kPa). | |||
| Referencias de Infobox | |||
La prolina (símbolo Pro o P ) [5] es un ácido orgánico clasificado como aminoácido proteinogénico (utilizado en la biosíntesis de proteínas ), aunque no contiene el grupo amino -NH
2sino que es más bien una amina secundaria . El nitrógeno de la amina secundaria está en la forma NH 2 + protonada en condiciones biológicas, mientras que el grupo carboxi está en la forma -COO - desprotonada . La "cadena lateral" del carbono α se conecta al nitrógeno formando un bucle de pirrolidina , clasificándolo como un aminoácido alifático . No es esencial en los seres humanos, lo que significa que el cuerpo puede sintetizarlo a partir del aminoácido no esencial L - glutamato . Está codificado por todos los codones que comienzan con CC (CCU, CCC, CCA y CCG).
La prolina es el único aminoácido proteinogénico que es una amina secundaria, ya que el átomo de nitrógeno está unido tanto al carbono α como a una cadena de tres carbonos que forma un bucle.
Historia y etimología [ editar ]
La prolina fue aislada por primera vez en 1900 por Richard Willstätter, quien obtuvo el aminoácido mientras estudiaba la N-metilprolina y sintetizó la prolina mediante la reacción de la sal sódica del malonato de dietilo con el 1,3-dibromopropano . Al año siguiente, Emil Fischer aisló prolina a partir de caseína y los productos de descomposición del éster γ-ftalimido-propilmalónico, [6] y publicó la síntesis de prolina a partir del éster ftalimido-propilmalónico. [7]
El nombre prolina proviene de la pirrolidina , uno de sus componentes. [8]
Biosíntesis [ editar ]
La prolina se deriva biosintéticamente del aminoácido L - glutamato . El glutamato-5-semialdehído se forma primero por glutamato-5-quinasa (dependiente de ATP) y glutamato-5-semialdehído deshidrogenasa (que requiere NADH o NADPH). Esto puede luego ciclarse espontáneamente para formar ácido 1-pirrolina-5-carboxílico , que se reduce a prolina por la pirrolina-5-carboxilato reductasa (usando NADH o NADPH), o se convierte en ornitina por la ornitina aminotransferasa , seguida de la ciclación por la ornitina ciclodesaminasa. para formar prolina. [9]
Actividad biológica [ editar ]
Se ha encontrado que la L- prolina actúa como un agonista débil del receptor de glicina y de los receptores de glutamato ionotrópicos tanto NMDA como no NMDA ( AMPA / kainato ) . [10] [11] [12] Se ha propuesto que sea una posible excitotoxina endógena . [10] [11] [12] En las plantas , la acumulación de prolina es una respuesta fisiológica común a varios tipos de estrés, pero también es parte del programa de desarrollo de los tejidos generativos (por ejemplo, el polen ). [13]
Propiedades en la estructura de las proteínas [ editar ]
La estructura cíclica distintiva de la cadena lateral de la prolina le da a la prolina una rigidez conformacional excepcional en comparación con otros aminoácidos. También afecta la tasa de formación de enlaces peptídicos entre la prolina y otros aminoácidos. Cuando la prolina está unida como amida en un enlace peptídico, su nitrógeno no está unido a ningún hidrógeno, lo que significa que no puede actuar como donante de enlaces de hidrógeno , pero puede ser un aceptor de enlaces de hidrógeno.
La formación de enlaces peptídicos con el Pro-tRNA Pro entrante es considerablemente más lenta que con cualquier otro tRNA , que es una característica general de los N-alquilaminoácidos. [14] La formación de enlaces peptídicos también es lenta entre un ARNt entrante y una cadena que termina en prolina; con la creación de enlaces prolina-prolina más lento de todos. [15]
La rigidez conformacional excepcional de la prolina afecta la estructura secundaria de las proteínas cerca de un residuo de prolina y puede explicar la mayor prevalencia de la prolina en las proteínas de los organismos termófilos . La estructura secundaria de la proteína se puede describir en términos de los ángulos diedros φ, ψ y ω del esqueleto proteico. La estructura cíclica de la cadena lateral de prolina bloquea el ángulo φ en aproximadamente -65 °. [dieciséis]
La prolina actúa como un disruptor estructural en medio de los elementos de la estructura secundaria regular , como las hélices alfa y las láminas beta ; sin embargo, la prolina se encuentra comúnmente como el primer residuo de una hélice alfa y también en las hebras de los bordes de las hojas beta . La prolina también se encuentra comúnmente en los giros (otro tipo de estructura secundaria) y ayuda en la formación de giros beta. Esto puede explicar el hecho curioso de que la prolina suele estar expuesta a disolventes, a pesar de tener una cadena lateral completamente alifática .
Múltiples prolina y / o hidroxiprolinas seguidas pueden crear una hélice de poliprolina , la estructura secundaria predominante en el colágeno . La hidroxilación de prolina por prolil hidroxilasa (u otras adiciones de sustituyentes atractores de electrones tales como flúor ) aumenta significativamente la estabilidad conformacional del colágeno . [17] Por lo tanto, la hidroxilación de la prolina es un proceso bioquímico crítico para mantener el tejido conectivo de los organismos superiores. Enfermedades graves como el escorbutopuede resultar de defectos en esta hidroxilación, por ejemplo, mutaciones en la enzima prolil hidroxilasa o falta del cofactor de ascorbato (vitamina C) necesario .
Isomerización cis-trans [ editar ]
Los enlaces peptídicos a la prolina y a otros aminoácidos sustituidos en N (como la sarcosina ) pueden poblar los isómeros cis y trans . La mayoría de los enlaces peptídicos adoptan abrumadoramente el isómero trans (típicamente 99,9% en condiciones no tensas), principalmente porque el hidrógeno de amida ( isómero trans ) ofrece menos repulsión estérica al átomo de C α precedente que el siguiente átomo de C α ( isómero cis ). Por el contrario, cis y translos isómeros del enlace peptídico X-Pro (donde X representa cualquier aminoácido) experimentan choques estéricos con la sustitución vecina y tienen una diferencia de energía mucho menor. Por tanto, la fracción de enlaces peptídicos X-Pro en el isómero cis en condiciones no forzadas es significativamente elevada, con fracciones cis típicamente en el intervalo de 3 a 10%. [18] Sin embargo, estos valores dependen del aminoácido anterior, con los residuos Gly [19] y aromáticos [20] produciendo fracciones aumentadas del isómero cis . Se han identificado fracciones cis de hasta el 40% para enlaces peptídicos Aromatic-Pro. [21]
Desde un punto de vista cinético, la isomerización de prolina cis - trans es un proceso muy lento que puede impedir el progreso del plegamiento de proteínas atrapando uno o más residuos de prolina cruciales para el plegado en el isómero no nativo, especialmente cuando la proteína nativa requiere el isómero cis . Esto se debe a que los residuos de prolina se sintetizan exclusivamente en el ribosoma como forma de isómero trans . Todos los organismos poseen enzimas prolil isomerasa para catalizar esta isomerización, y algunas bacterias tienen prolil isomerasas especializadas asociadas con el ribosoma. Sin embargo, no todas las prolina son esenciales para el plegamiento, y el plegamiento de proteínas puede proceder a una velocidad normal a pesar de tener confórmeros no nativos de muchos enlaces peptídicos X-Pro.
Usos [ editar ]
La prolina y sus derivados se utilizan a menudo como catalizadores asimétricos en reacciones de organocatálisis de prolina . La reducción de CBS y la condensación aldólica catalizada por prolina son ejemplos destacados.
En la elaboración de la cerveza, las proteínas ricas en prolina se combinan con polifenoles para producir neblina (turbidez). [22]
La L- prolina es un osmoprotector y, por tanto, se utiliza en muchas aplicaciones farmacéuticas y biotecnológicas.
El medio de crecimiento utilizado en el cultivo de tejidos vegetales se puede complementar con prolina. Esto puede aumentar el crecimiento, quizás porque ayuda a la planta a tolerar el estrés del cultivo de tejidos. [23] [se necesita una mejor fuente ] Para conocer el papel de la prolina en la respuesta al estrés de las plantas, consulte el § Actividad biológica .
Especialidades [ editar ]
La prolina es uno de los dos aminoácidos que no siguen la gráfica típica de Ramachandran , junto con la glicina . Debido a la formación del anillo conectado al carbono beta, los ángulos ψ y φ alrededor del enlace peptídico tienen menos grados de rotación permitidos. Como resultado, a menudo se encuentra en "giros" de proteínas ya que su entropía libre (ΔS) no es comparativamente grande a otros aminoácidos y, por lo tanto, en forma plegada frente a forma desplegada, el cambio en la entropía es menor. Además, la prolina rara vez se encuentra en las estructuras α y β, ya que reduciría la estabilidad de tales estructuras, porque su cadena lateral α-N solo puede formar un enlace de nitrógeno.
Además, la prolina es el único aminoácido que no forma un color rojo / púrpura cuando se desarrolla rociándolo con ninhidrina para su uso en cromatografía . La prolina, en cambio, produce un color naranja / amarillo.
Síntesis [ editar ]
La prolina racémica se puede sintetizar a partir de malonato de dietilo y acrilonitrilo : [24]
Evolución [ editar ]
Varios estudios evolutivos independientes que utilizan diferentes tipos de datos han sugerido que la prolina pertenece a un grupo de aminoácidos que constituyó el código genético temprano. [25] [26] [27] [28] Por ejemplo, las regiones de baja complejidad (en proteínas), que pueden parecerse a los protopéptidos del código genético temprano , están altamente enriquecidas en prolina. [28]
Ver también [ editar ]
- Hiperprolinemia
- Error innato del metabolismo.
- Deficiencia de prolidasa
- Prolinol
Referencias [ editar ]
- ^ Pubchem. "Prolina" . pubchem.ncbi.nlm.nih.gov . Archivado desde el original el 16 de enero de 2014 . Consultado el 8 de mayo de 2018 .
- ^ "Sonrisas isoméricas de prolina" . PubChem . Centro Nacional de Información Biotecnológica . Consultado el 26 de febrero de 2021 .
- ^ H.-D. Belitz; W. Grosch; P. Schieberle (15 de enero de 2009). Química de los alimentos . pag. 15. ISBN 978-3-540-69933-0. Archivado desde el original el 15 de mayo de 2016.
- ^ Nelson, DL, Cox, MM, Principios de bioquímica. Nueva York: WH Freeman and Company.
- ^ "Nomenclatura y simbolismo de aminoácidos y péptidos" . Comisión Conjunta IUPAC-IUB sobre Nomenclatura Bioquímica. 1983. Archivado desde el original el 9 de octubre de 2008 . Consultado el 5 de marzo de 2018 .
- ^ RHA Plimmer (1912) [1908], RHA Plimmer & FG Hopkins (ed.), La composición química de las proteínas , Monografías sobre bioquímica, Parte I. Análisis (2ª ed.), Londres: Longmans, Green and Co., pag. 130 , consultado el 20 de septiembre de 2010
- ^ "Prolina" . Archivado desde el original el 27 de noviembre de 2015.
- ^ "prolina" . Diccionario de la herencia americana del idioma inglés, cuarta edición . Archivado desde el original el 15 de septiembre de 2015 . Consultado el 6 de diciembre de 2015 .
- ^ Lehninger, Albert L .; Nelson, David L .; Cox, Michael M. (2000). Principios de bioquímica (3ª ed.). Nueva York: W. H. Freeman. ISBN 1-57259-153-6..
- ^ a b Libro de datos sobre canales iónicos: canales extracelulares activados por ligandos . Prensa académica. 16 de noviembre de 1995. págs. 126–. ISBN 978-0-08-053519-7. Archivado desde el original el 26 de abril de 2016.
- ↑ a b Henzi V, Reichling DB, Helm SW, MacDermott AB (1992). "L-prolina activa los receptores de glutamato y glicina en neuronas de cuerno dorsal de rata cultivadas" . Mol. Pharmacol . 41 (4): 793–801. PMID 1349155 .
- ↑ a b Orhan E. Arslan (7 de agosto de 2014). Bases neuroanatómicas de la neurología clínica, segunda edición . Prensa CRC. págs. 309–. ISBN 978-1-4398-4833-3. Archivado desde el original el 14 de mayo de 2016.
- ^ Verbruggen N, Hermans C (2008). "Acumulación de prolina en plantas: una revisión" (PDF) . Aminoácidos . 35 (4): 753–759. doi : 10.1007 / s00726-008-0061-6 . PMID 18379856 . S2CID 21788988 .
- ^ Pavlov, Michael Y; Watts, Richard E; Tan, Zhongping; Cornualles, Virginia W; Ehrenberg, Måns; Forster, Anthony C (2010), "Formación lenta de enlaces peptídicos por prolina y otros N-alquilaminoácidos en la traducción", PNAS , 106 (1): 50–54, doi : 10.1073 / pnas.0809211106 , PMC 2629218 , PMID 19104062 .
- ^ Buskirk, Allen R .; Green, Rachel (2013). "Superar las pausas de la poliprolina" . Ciencia . 339 (6115): 38–39. Código Bibliográfico : 2013Sci ... 339 ... 38B . doi : 10.1126 / science.1233338 . PMC 3955122 . PMID 23288527 .
- ^ Morris, Anne (1992). "Calidad estereoquímica de las coordenadas de la estructura de la proteína". Proteínas: estructura, función y bioinformática . 12 (4): 345–364. doi : 10.1002 / prot.340120407 . PMID 1579569 . S2CID 940786 .
- ^ Szpak, Paul (2011). "Ultraestructura y química de la espina de pescado: implicaciones para la tafonomía y el análisis de isótopos estables" . Revista de Ciencias Arqueológicas . 38 (12): 3358–3372. doi : 10.1016 / j.jas.2011.07.022 . Archivado desde el original el 18 de enero de 2012.
- ^ Alderson, TR; Lee, JH; Charlier, C .; Ying, J. y Bax, A. (2017). "Propensión a la formación de cis-prolina en proteínas desplegadas" . ChemBioChem . 19 (1): 37–42. doi : 10.1002 / cbic.201700548 . PMC 5977977 . PMID 29064600 .
- ^ Sarkar, SK; Joven, educación física; Sullivan, CE y Torchia, DA (1984). "Detección de enlaces peptídicos cis y trans X-Pro en proteínas por 13C NMR: Aplicación al colágeno" . Actas de la Academia Nacional de Ciencias de EE . UU . 81 (15): 4800–4803. Código Bibliográfico : 1984PNAS ... 81.4800S . doi : 10.1073 / pnas.81.15.4800 . PMC 391578 . PMID 6589627 .
- ^ Thomas, KM; Naduthambi, D. y Zondlo, NJ (2006). "Control electrónico de isomería cis-trans amida a través de la interacción aromático-prolilo". Revista de la Sociedad Química Estadounidense . 128 (7): 2216–2217. doi : 10.1021 / ja057901y . PMID 16478167 .
- ^ Gustafson, CL; Parsely, NC; Asimgil, H .; et al. (2017). "Un cambio conformacional lento en el dominio de transactivación BMAL1 modula los ritmos circadianos" . Célula molecular . 66 (4): 447–457.e7. doi : 10.1016 / j.molcel.2017.04.011 . PMC 5484534 . PMID 28506462 .
- ^ KJ Siebert, "Haze and Foam", "Copia archivada" . Archivado desde el original el 11 de julio de 2010 . Consultado el 13 de julio de 2010 .Mantenimiento de CS1: copia archivada como título ( enlace ) Consultado el 12 de julio de 2010.
- ^ Pazuki, A; Asghari, J; Sohani, M; Pessarakli, M y Aflaki, F (2015). "Efectos de algunas fuentes de nitrógeno orgánico y antibióticos sobre el crecimiento de callos de cultivares de arroz índica". Revista de Nutrición Vegetal . 38 (8): 1231-1240. doi : 10.1080 / 01904167.2014.983118 . S2CID 84495391 .
- ^ Vogel, Química orgánica práctica quinta edición
- ^ Trifonov, EN (diciembre de 2000). "Consenso de orden temporal de aminoácidos y evolución del código triplete" . Gene . 261 (1): 139-151. doi : 10.1016 / S0378-1119 (00) 00476-5 . PMID 11164045 .
- ^ Higgs, Paul G .; Pudritz, Ralph E. (junio de 2009). "Una base termodinámica para la síntesis de aminoácidos prebióticos y la naturaleza del primer código genético" . Astrobiología . 9 (5): 483–490. arXiv : 0904.0402 . Código bibliográfico : 2009AsBio ... 9..483H . doi : 10.1089 / ast.2008.0280 . ISSN 1531-1074 . PMID 19566427 . S2CID 9039622 .
- ^ Chaliotis, Anargyros; Vlastaridis, Panayotis; Mossialos, Dimitris; Ibba, Michael; Becker, Hubert D .; Stathopoulos, Constantinos; Amoutzias, Grigorios D. (17 de febrero de 2017). "La compleja historia evolutiva de las aminoacil-tRNA sintetasas" . Investigación de ácidos nucleicos . 45 (3): 1059–1068. doi : 10.1093 / nar / gkw1182 . ISSN 0305-1048 . PMC 5388404 . PMID 28180287 .
- ^ a b Ntountoumi, Chrysa; Vlastaridis, Panayotis; Mossialos, Dimitris; Stathopoulos, Constantinos; Iliopoulos, Ioannis; Promponas, Vasilios; Oliver, Stephen G; Amoutzias, Grigoris D (4 de noviembre de 2019). "Las regiones de baja complejidad en las proteínas de los procariotas desempeñan importantes funciones funcionales y están muy conservadas" . Investigación de ácidos nucleicos . 47 (19): 9998–10009. doi : 10.1093 / nar / gkz730 . ISSN 0305-1048 . PMC 6821194 . PMID 31504783 .
Lectura adicional [ editar ]
- Balbach, J .; Schmid, FX (2000), "Isomerización de prolina y su catálisis en el plegamiento de proteínas", en Pain, RH (ed.), Mechanisms of Protein Folding (2ª ed.), Oxford University Press, págs. 212–49, ISBN 978-0-19-963788-1.
- Para obtener una descripción científica completa de los trastornos del metabolismo de la prolina y la hidroxiprolina, se puede consultar el capítulo 81 de OMMBID Charles Scriver , Beaudet, AL, Valle, D., Sly, WS, Vogelstein, B., Childs, B., Kinzler, KW ( Consultado 2007). Las bases metabólicas y moleculares en línea de las enfermedades hereditarias . Nueva York: McGraw-Hill. - Resúmenes de 255 capítulos, texto completo a través de muchas universidades. También está el blog OMMBID .
Enlaces externos [ editar ]
- Espectro de prolina MS
- Biosíntesis de prolina
- Biosíntesis de prolina