anulación de robinson
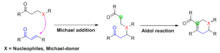
La anulación de Robinson es una reacción química utilizada en química orgánica para la formación de anillos. Fue descubierto por Robert Robinson en 1935 como un método para crear un anillo de seis miembros mediante la formación de tres nuevos enlaces carbono-carbono. [1] El método utiliza una cetona y una metilvinilcetona para formar una cetona α,β-insaturada en un anillo de ciclohexano mediante una adición de Michael seguida de una condensación aldólica . Este procedimiento es uno de los métodos clave para formar sistemas de anillos fusionados.
La formación de ciclohexenona y derivados es importante en química por su aplicación a la síntesis de muchos productos naturales y otros compuestos orgánicos interesantes como antibióticos y esteroides . [2] Específicamente, la síntesis de cortisona se completa mediante el uso de la anulación de Robinson. [3]
El artículo inicial sobre la anulación de Robinson fue publicado por William Rapson y Robert Robinson mientras Rapson estudiaba en Oxford con el profesor Robinson. Antes de su trabajo, las síntesis de ciclohexenona no se derivaban del componente de cetona α, β-insaturada. Los enfoques iniciales acoplaron la metil vinil cetona con un naftol para dar un naftolóxido, pero este procedimiento no fue suficiente para formar la ciclohexenona deseada. Esto se atribuyó a condiciones inadecuadas de la reacción. [1]
Robinson y Rapson encontraron en 1935 que la interacción entre la ciclohexanona y la cetona α, β-insaturada producía la ciclohexenona deseada. Sigue siendo uno de los métodos clave para la construcción de compuestos de anillo de seis miembros. Dado que se usa tan ampliamente, hay muchos aspectos de la reacción que se han investigado, como las variaciones de los sustratos y las condiciones de reacción, como se analiza en la sección de alcance y variaciones. [4] Robert Robinson ganó el Premio Nobel de Química en 1947 por su contribución al estudio de los alcaloides. [5]
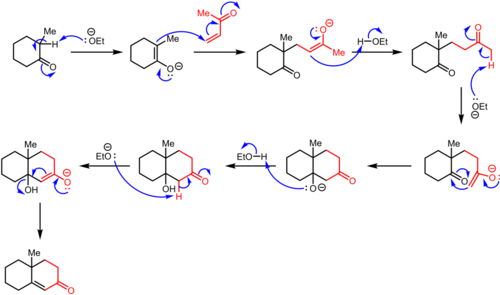
El procedimiento original de la anulación de Robinson comienza con el ataque nucleofílico de una cetona en una reacción de Michael sobre una vinilcetona para producir el aducto intermedio de Michael. El cierre posterior del anillo de tipo aldólico conduce al cetoalcohol, que luego es seguido por deshidratación para producir el producto de anulación.
En la reacción de Michael, la cetona es desprotonada por una base para formar un nucleófilo enolato que ataca al aceptor de electrones (en rojo). Este aceptor es generalmente una cetona α, β-insaturada, aunque también pueden funcionar aldehídos , derivados de ácidos y compuestos similares (ver alcance). En el ejemplo que se muestra aquí, la regioselectividad está dictada por la formación del enolato termodinámico. Alternativamente, la regioselectividad a menudo se controla usando una β-dicetona o β-cetoéster como componente de enolato, ya que se favorece fuertemente la desprotonación en el carbono flanqueado por los grupos carbonilo. La condensación aldólica intramolecularluego se lleva a cabo de tal manera que se instala el anillo de seis miembros. En el producto final, los tres átomos de carbono del sistema α,β-insaturado y el carbono α de su grupo carbonilo forman el puente de cuatro carbonos del anillo recién instalado.