| |||
| Nombres | |||
|---|---|---|---|
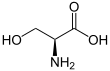
| Nombre IUPAC Serina | |||
| Otros nombres Ácido 2-amino-3-hidroxipropanoico | |||
| Identificadores | |||
Modelo 3D ( JSmol ) | |||
| CHEBI | |||
| CHEMBL | |||
| ChemSpider | |||
| DrugBank | |||
| Tarjeta de información ECHA | 100.000.250 | ||
| Número CE |
| ||
| KEGG | |||
PubChem CID | |||
| UNII |
| ||
Tablero CompTox ( EPA ) | |||
| |||
Sonrisas
| |||
| Propiedades [2] | |||
Fórmula química | C 3 H 7 N O 3 | ||
| Masa molar | 105,093 g · mol −1 | ||
| Apariencia | cristales blancos o polvo | ||
| Densidad | 1,603 g / cm 3 (22 ° C) | ||
| Punto de fusion | 246 ° C (475 ° F; 519 K) se descompone | ||
solubilidad en agua | soluble | ||
| Acidez (p K a ) | 2,21 (carboxilo), 9,15 (amino) [1] | ||
| Página de datos complementarios | |||
Estructura y propiedades | Índice de refracción ( n ), constante dieléctrica (ε r ), etc. | ||
Datos termodinámicos | Comportamiento de fase sólido-líquido-gas | ||
Datos espectrales | UV , IR , RMN , MS | ||
Salvo que se indique lo contrario, los datos se proporcionan para materiales en su estado estándar (a 25 ° C [77 ° F], 100 kPa). | |||
| Referencias de Infobox | |||
La serina (símbolo Ser o S ) [3] [4] es un ɑ- aminoácido que se utiliza en la biosíntesis de proteínas. Contiene un grupo α- amino (que se encuentra en el protonado - NH+
3forma bajo condiciones biológicas), un grupo carboxilo (que está en el desprotonado - COO-
forma en condiciones biológicas), y una cadena lateral que consiste en un grupo hidroximetilo , clasificándolo como un aminoácido polar . Se puede sintetizar en el cuerpo humano en circunstancias fisiológicas normales, lo que lo convierte en un aminoácido no esencial. Está codificado por los codones UCU, UCC, UCA, UCG, AGU y AGC.
Ocurrencia [ editar ]
Este compuesto es uno de los aminoácidos proteinogénicos naturales . Sólo el L - estereoisómero aparece de forma natural en las proteínas. No es esencial para la dieta humana, ya que se sintetiza en el cuerpo a partir de otros metabolitos , incluida la glicina . La serina fue obtenida por primera vez de la proteína de la seda , una fuente particularmente rica, en 1865 por Emil Cramer. [5] Su nombre se deriva del latín para seda, sericum . La estructura de la serina se estableció en 1902. [6] Fuentes de alimentos con alto contenido de L-El contenido de serina entre sus proteínas incluye huevos, edamame, cordero, hígado, cerdo, salmón, sardinas, algas, tofu. [7] [8]
Biosíntesis [ editar ]
La biosíntesis de serina comienza con la oxidación de 3-fosfoglicerato (un intermedio de la glucólisis ) a 3-fosfohidroxipiruvato y NADH por la fosfoglicerato deshidrogenasa ( EC 1.1.1.95 ). La aminación reductora (transaminación) de esta cetona por la fosfoserina transaminasa ( EC 2.6.1.52 ) produce 3-fosfoserina ( O -fosfoserina) que se hidroliza a serina por la fosfoserina fosfatasa ( EC 3.1.3.3 ). [9] [10]
En bacterias como E. coli, estas enzimas están codificadas por los genes serA (EC 1.1.1.95), serC (EC 2.6.1.52) y serB (EC 3.1.3.3). [11]
Biosíntesis de glicina : la serina hidroximetiltransferasa (SHMT = serina transhidroximetilasa) también cataliza las conversiones reversibles de L -serina en glicina (escisión retroaldólica ) y 5,6,7,8-tetrahidrofolato en 5,10-metilentetrahidrofolato (mTHF) (hidrólisis) . [12] SHMT es una enzima dependiente de fosfato de piridoxal (PLP). La glicina también se puede formar a partir de CO 2, NH 4 + y mTHF en una reacción catalizada por la glicina sintasa . [9]
Síntesis y producción industrial [ editar ]
Industrialmente, la L- serina se produce a partir de glicina y metanol catalizados por hidroximetiltransferasa . [13]
La serina racémica se puede preparar en el laboratorio a partir de acrilato de metilo en varios pasos: [14]
Función biológica [ editar ]
Metabólico [ editar ]
La serina es importante en el metabolismo porque participa en la biosíntesis de purinas y pirimidinas . Es el precursor de varios aminoácidos, incluidos la glicina y la cisteína , así como el triptófano en las bacterias. También es el precursor de muchos otros metabolitos, incluidos los esfingolípidos y el folato , que es el principal donante de fragmentos de un carbono en la biosíntesis. [ cita requerida ]
Papel estructural [ editar ]
Esta sección no cita ninguna fuente . ( Enero de 2021 ) ( Obtenga información sobre cómo y cuándo eliminar este mensaje de plantilla ) |
La serina juega un papel importante en la función catalítica de muchas enzimas . Se ha demostrado que ocurre en los sitios activos de quimotripsina , tripsina y muchas otras enzimas. Se ha demostrado que los llamados gases nerviosos y muchas sustancias utilizadas en los insecticidas actúan combinándose con un residuo de serina en el sitio activo de la acetilcolina esterasa , inhibiendo la enzima por completo.
Las cadenas laterales de serina suelen estar unidas por enlaces de hidrógeno; los motivos pequeños más comunes que se forman son giros ST , motivos ST (a menudo al comienzo de las hélices alfa) y grapas ST (normalmente en el medio de las hélices alfa).
Como constituyente (residuo) de las proteínas, su cadena lateral puede sufrir una glicosilación ligada a O , que puede estar relacionada funcionalmente con la diabetes [ aclaración necesaria ] .
Es uno de los tres residuos de aminoácidos que comúnmente son fosforilados por quinasas durante la señalización celular en eucariotas . Los residuos de serina fosforilados a menudo se denominan fosfoserina .
Las serina proteasas son un tipo común de proteasa.
Señalización [ editar ]
La D- serina, sintetizada en las neuronas por la serina racemasa de la L- serina (su enantiómero ), actúa como neuromodulador al coactivar los receptores NMDA , lo que los hace capaces de abrirse si luego también se unen al glutamato . La D- serina es un potente agonista en el sitio de glicina (NR1) del receptor de glutamato de tipo NMDA (NMDAR). Para que el receptor se abra, el glutamato y la glicina o la D- serina deben unirse a él; además, no debe unirse un bloqueador de poros (por ejemplo, Mg 2+ o Zn 2+ ). [15] De hecho, D-serina es un agonista más potente en el sitio de glicina en el NMDAR que la glicina misma. [ cita requerida ]
Se pensaba que la D- serina existía sólo en bacterias hasta hace relativamente poco tiempo; fue el segundo aminoácido D descubierto que existe de forma natural en los seres humanos, presente como una molécula de señalización en el cerebro, poco después del descubrimiento del D- aspartato . Si los aminoácidos D se hubieran descubierto antes en los seres humanos, el sitio de glicina en el receptor de NMDA podría llamarse en cambio sitio de la serina- D . [16] Aparte del sistema nervioso central, la D- serina juega un papel de señalización en tejidos y órganos periféricos como el cartílago, [17] riñón, [18] y cuerpo cavernoso. [19]
Sensación gustativa [ editar ]
La L- serina es dulce con umami menor y sabores ácidos en alta concentración. [ cita requerida ]
Pure D -serine es un polvo cristalino blanquecino con un ligero aroma a humedad. La D- Serina es dulce con un sabor amargo menor adicional en concentraciones medias y altas. [20]
Importancia clínica [ editar ]
Los trastornos por deficiencia de serina son defectos raros en la biosíntesis del aminoácido L- serina. En la actualidad se han informado tres trastornos:
- Deficiencia de 3-fosfoglicerato deshidrogenasa
- Deficiencia de 3-fosfoserina fosfatasa
- Deficiencia de fosfoserina aminotransferasa
Estos defectos enzimáticos conducen a síntomas neurológicos graves como microcefalia congénita y retraso psicomotor grave y, además, en pacientes con deficiencia de 3-fosfoglicerato deshidrogenasa a convulsiones intratables. Estos síntomas responden en un grado variable al tratamiento con L- serina, a veces combinada con glicina. [21] [22] La respuesta al tratamiento es variable y se desconoce el resultado funcional y a largo plazo. Para proporcionar una base para mejorar la comprensión de la epidemiología, la correlación genotipo / fenotipo y el resultado de estas enfermedades, su impacto en la calidad de vida de los pacientes, así como para evaluar las estrategias diagnósticas y terapéuticas, se estableció un registro de pacientes por parte de la organización no comercial.Grupo de trabajo internacional sobre trastornos relacionados con neurotransmisores (iNTD). [23]
Investigación para uso terapéutico [ editar ]
La clasificación de la L- serina como un aminoácido no esencial se ha llegado a considerar condicional, ya que los vertebrados como los humanos no siempre pueden sintetizar cantidades óptimas durante toda la vida. [24] La L- serina se encuentra en un ensayo clínico en humanos aprobado por la FDA como posible tratamiento para la esclerosis lateral amiotrófica, ELA (identificador de ClinicalTrials.gov: NCT01835782). [25] Un metaanálisis de 2011 encontró que la sarcosina adyuvante tiene un tamaño de efecto medio para los síntomas negativos y totales. [26] También hay evidencia de que la L ‐ serina podría adquirir una función terapéutica en la diabetes. [27]
La D- serina se está estudiando en roedores como posible tratamiento para la esquizofrenia. [28] La D- serina también se ha descrito como un biomarcador potencial para el diagnóstico temprano de la enfermedad de Alzheimer (EA), debido a una concentración relativamente alta en el líquido cefalorraquídeo de los pacientes probables con EA. [29]
Ver también [ editar ]
- Isoserina
- Homoserina (isothreonine)
- Racimo de octámero de serina
Referencias [ editar ]
- ^ Dawson, RMC, et al., Datos para la investigación bioquímica , Oxford, Clarendon Press, 1959.
- ^ Weast RC, ed. (1981). Manual CRC de Química y Física (62ª ed.). Boca Raton, FL: CRC Press. pag. C-512. ISBN 0-8493-0462-8.
- ^ "Nomenclatura y simbolismo de aminoácidos y péptidos" . Comisión Conjunta IUPAC-IUB sobre Nomenclatura Bioquímica. 1983. Archivado desde el original el 9 de octubre de 2008 . Consultado el 5 de marzo de 2018 .
- ^ "Nomenclatura y simbolismo de aminoácidos y péptidos (Recomendaciones IUPAC-IUB 1983)", Pure Appl. Chem. , 56 (5): 595–624, 1984, doi : 10.1351 / pac198456050595.
- ^ "Ueber die Bestandtheile der Seide" . Journal für praktische Chemie 96 .
- ^ "Serina" . The Columbia Encyclopedia 6ª ed . encyclopedia.com . Consultado el 22 de octubre de 2012 .
- ^ Sitio web de Brain Chemistry Labs
- ^ Sitio web de Self Nutrition Data
- ↑ a b Stryer L (1988). Bioquímica (3ª ed.). Nueva York: WH Freeman. pag. 580 . ISBN 978-0-7167-1843-7.
- ^ KEGG EC 3.1.3.3 etc.
- ^ Uniprot: serB
- ^ Lehninger AL, Nelson DL, Cox MM (2000). Principios de bioquímica (3ª ed.). Nueva York: W. H. Freeman. ISBN 1-57259-153-6.
- ^ Karlheinz Drauz, Ian Grayson, Axel Kleemann, Hans-Peter Krimmer, Wolfgang Leuchtenberger, Christoph Weckbecker (2006). Enciclopedia de química industrial de Ullmann . Weinheim: Wiley-VCH. doi : 10.1002 / 14356007.a02_057.pub2 .CS1 maint: varios nombres: lista de autores ( enlace )
- ^ Carter HE , West HD (1940). " dl -Serine" . Org. Synth. 20 : 81. doi : 10.15227 / orgsyn.020.0081 .
- ^ Liu Y, Hill RH, Arhem P, von Euler G (2001). "NMDA y glicina regulan la afinidad del sitio de bloqueo Mg2 + en los canales del receptor NMDA NR1-1a / NR2A expresados en ovocitos de Xenopus". Ciencias de la vida . 68 (16): 1817–26. doi : 10.1016 / S0024-3205 (01) 00975-4 . PMID 11292060 .
- ^ Mothet JP, Parent AT, Wolosker H, Brady RO, Linden DJ, Ferris CD, Rogawski MA, Snyder SH (abril de 2000). "D-serina es un ligando endógeno para el sitio de glicina del receptor de N-metil-D-aspartato" . Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 97 (9): 4926–31. Código Bib : 2000PNAS ... 97.4926M . doi : 10.1073 / pnas.97.9.4926 . PMC 18334 . PMID 10781100 .
- ^ Takarada T, Hinoi E, Takahata Y, Yoneda Y (mayo de 2008). "La serina racemasa suprime la diferenciación condrogénica en el cartílago de una manera dependiente de Sox9". Revista de fisiología celular . 215 (2): 320–8. doi : 10.1002 / jcp.21310 . PMID 17929246 . S2CID 45669104 .
- ^ Ma MC, Huang HS, Chen YS, Lee SH (noviembre de 2008). "Los receptores de N-metil-D-aspartato mecanosensibles contribuyen a la activación sensorial en la pelvis renal de la rata" . La hipertensión . 52 (5): 938–44. doi : 10.1161 / HYPERTENSIONAHA.108.114116 . PMID 18809793 .
- ^ Ghasemi M, Rezania F, Lewin J, Moore KP, Mani AR (junio de 2010). "d-serina modula la relajación neurogénica en el cuerpo cavernoso de rata". Farmacología bioquímica . 79 (12): 1791–6. doi : 10.1016 / j.bcp.2010.02.007 . PMID 20170643 .
- ^ Kawai M, Sekine-Hayakawa Y, Okiyama A, Ninomiya Y (diciembre de 2012). "Sensación gustativa de (L) - y (D) -aminoácidos en humanos". Aminoácidos . 43 (6): 2349–58. doi : 10.1007 / s00726-012-1315-x . PMID 22588481 . S2CID 17671611 .
- ^ de Koning TJ (abril de 2006). "Tratamiento con aminoácidos en trastornos por deficiencia de serina". Revista de enfermedades metabólicas hereditarias . 29 (2): 347–351. doi : 10.1007 / s10545-006-0269-0 . PMID 16763900 . S2CID 25013468 .
- ^ Tabatabaie L; Klomp LW; Berger R; de Koning TJ (marzo de 2010). "Síntesis de L-serina en el sistema nervioso central: una revisión sobre los trastornos por deficiencia de serina". Mol Genet Metab . 99 (3): 256–262. doi : 10.1016 / j.ymgme.2009.10.012 . PMID 19963421 .
- ^ "Registro de pacientes" .
- ^ Metcalf, JS; Dunlop, RA; Powell, JT; Banack, SA; Cox, Pensilvania (2017). "L-serina: un aminoácido natural con potencial terapéutico". Investigación de neurotoxicidad . 33 (1): 213-221. doi : 10.1007 / s12640-017-9814-x . ISSN 1029-8428 . PMID 28929385 . S2CID 20271849 .
- ^ Dunlop RA, Cox PA, Banack SA, Rodgers KJ (2013). "El aminoácido no proteico BMAA se incorpora erróneamente a las proteínas humanas en lugar de la L-serina, lo que provoca un plegamiento incorrecto y una agregación de las proteínas" . PLOS ONE . 8 (9): e75376. Código bibliográfico : 2013PLoSO ... 875376D . doi : 10.1371 / journal.pone.0075376 . PMC 3783393 . PMID 24086518 .
- ^ Singh SP, Singh V (octubre de 2011). "Metanálisis de la eficacia de los moduladores del receptor de NMDA adyuvantes en la esquizofrenia crónica". Medicamentos para el SNC . 25 (10): 859–85. doi : 10.2165 / 11586650-000000000-00000 . PMID 21936588 . S2CID 207299820 .
- ↑ Holm, Laurits J .; Buschard, Karsten (2019). "L ‐ serina: un aminoácido desatendido con un papel terapéutico potencial en la diabetes" . APMIS . 127 (10): 655–659. doi : 10.1111 / apm.12987 . ISSN 0903-4641 . PMC 6851881 . PMID 31344283 .
- ^ Balu DT, Li Y, Puhl MD, Benneyworth MA, Basu AC, Takagi S, Bolshakov VY, Coyle JT (junio de 2013). "Múltiples vías de riesgo para la esquizofrenia convergen en ratones knockout de serina racemasa, un modelo de ratón de hipofunción del receptor NMDA" . Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 110 (26): E2400-9. Código bibliográfico : 2013PNAS..110E2400B . doi : 10.1073 / pnas.1304308110 . PMC 3696825 . PMID 23729812 .
- ^ Madeira C, Lourenco MV, Vargas-Lopes C, Suemoto CK, Brandão CO, Reis T, Leite RE, Laks J, Jacob-Filho W, Pasqualucci CA, Grinberg LT, Ferreira ST, Panizzutti R (5 de mayo de 2015). "Niveles de d-serina en la enfermedad de Alzheimer: implicaciones para el desarrollo de nuevos biomarcadores" . Psiquiatría traslacional . 5 (5): e561. doi : 10.1038 / tp.2015.52 . PMC 4471283 . PMID 25942042 .
Enlaces externos [ editar ]
- Espectro de serina MS