Solubilidad
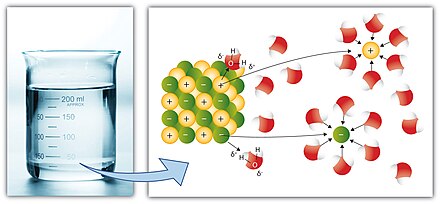
En química , la solubilidad es la capacidad de una sustancia , el soluto , para formar una solución con otra sustancia, el solvente . La insolubilidad es la propiedad opuesta, la incapacidad del soluto para formar tal solución.
El grado de solubilidad de una sustancia en un solvente específico generalmente se mide como la concentración del soluto en una solución saturada , una en la que no se puede disolver más soluto. [1] En este punto, se dice que las dos sustancias se encuentran en el equilibrio de solubilidad . Para algunos solutos y disolventes puede no haber tal límite, en cuyo caso se dice que las dos sustancias son " miscibles en todas las proporciones" (o simplemente "miscibles"). [2]
El soluto puede ser sólido , líquido o gas , mientras que el disolvente suele ser sólido o líquido. Ambos pueden ser sustancias puras o pueden ser en sí mismas soluciones. Los gases son siempre miscibles en todas las proporciones, excepto en situaciones muy extremas, [3] y un sólido o líquido puede "disolverse" en un gas sólo pasando primero al estado gaseoso.
La solubilidad depende principalmente de la composición del soluto y el disolvente (incluido su pH y la presencia de otras sustancias disueltas), así como de la temperatura y la presión. La dependencia a menudo se puede explicar en términos de interacciones entre las partículas ( átomos , moléculas o iones ) de las dos sustancias y de conceptos termodinámicos como entalpía y entropía .
En determinadas condiciones, la concentración del soluto puede superar su límite de solubilidad habitual. El resultado es una solución sobresaturada , que es metaestable y excluirá rápidamente el exceso de soluto si aparece un sitio de nucleación adecuado . [4]
El concepto de solubilidad no se aplica cuando hay una reacción química irreversible entre dos sustancias, como la reacción de hidróxido de calcio con ácido clorhídrico ; aunque se podría decir, informalmente, que uno "disolvió" al otro. La solubilidad tampoco es la misma que la velocidad de la solución , que es la rapidez con la que un soluto sólido se disuelve en un solvente líquido. Esta propiedad depende de muchas otras variables, como la forma física de las dos sustancias y la forma y la intensidad de la mezcla.