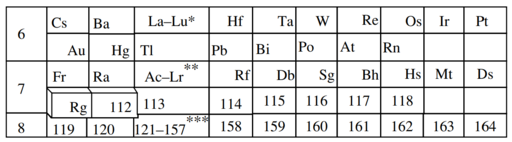
Tabla periódica extendida
Una tabla periódica extendida teoriza sobre elementos químicos más allá de los conocidos y probados actualmente en la tabla periódica . Esos elementos podrían incluir cualquiera más allá de oganesson , que completa el séptimo período (fila) en la tabla periódica en el número atómico ( Z ) 118. A partir de 2022 [actualizar], ningún elemento con un número atómico más alto que oganesson se ha sintetizado con éxito; todos los elementos del octavo período y posteriores siguen siendo, por tanto, puramente hipotéticos.
Si se descubren más elementos con números atómicos más altos que éste, se colocarán en períodos adicionales, dispuestos (como con los períodos existentes) para ilustrar tendencias periódicas recurrentes en las propiedades de los elementos en cuestión. Se espera que cualquier período adicional contenga un número mayor de elementos que el séptimo período, ya que se calcula que tiene un llamado bloque g adicional, que contiene al menos 18 elementos con orbitales g parcialmente llenos en cada período. Glenn T. Seaborg sugirió una tabla de ocho períodos que contiene este bloque en 1969. [1] [2] El primer elemento del bloque g puede tener el número atómico 121, y por lo tanto tendría el nombre sistemático unbiunium . A pesar de muchas búsquedas, no se ha sintetizado ni descubierto ningún elemento en esta región en la naturaleza. [3]
De acuerdo con la aproximación orbital en las descripciones de la mecánica cuántica de la estructura atómica, el bloque g correspondería a elementos con orbitales g parcialmente llenos, pero los efectos de acoplamiento espín-órbita reducen sustancialmente la validez de la aproximación orbital para elementos de alto número atómico. Mientras que la versión de Seaborg del período extendido tenía los elementos más pesados siguiendo el patrón establecido por los elementos más ligeros, ya que no tomaba en cuenta los efectos relativistas , los modelos que toman en cuenta los efectos relativistas no lo hacen. Pekka Pyykkö y Burkhard Fricke utilizaron modelos informáticos para calcular las posiciones de los elementos hasta Z = 172, y encontraron que varios se desplazaron de laRegla de Madelung . [4] Como resultado de la incertidumbre y la variabilidad en las predicciones de las propiedades químicas y físicas de los elementos más allá de 120, actualmente no existe consenso sobre su ubicación en la tabla periódica ampliada.
Es probable que los elementos de esta región sean muy inestables con respecto a la desintegración radiactiva y experimenten desintegración alfa o fisión espontánea con vidas medias extremadamente cortas , aunque se supone que el elemento 126 se encuentra dentro de una isla de estabilidad que es resistente a la fisión pero no a la alfa . decaer. También pueden ser posibles otras islas de estabilidad más allá de los elementos conocidos, incluida una teorizada en torno al elemento 164, aunque el alcance de los efectos estabilizadores de los proyectiles nucleares cerrados es incierto. No está claro cuántos elementos más allá de la isla de estabilidad esperada son físicamente posibles, si el período 8 está completo o si hay un período 9. ElLa Unión Internacional de Química Pura y Aplicada (IUPAC) define que un elemento existe si su vida útil es superior a 10-14 segundos (0,01 picosegundos o 10 femtosegundos), que es el tiempo que tarda el núcleo en formar una nube de electrones . [5]
Ya en 1940, se observó que una interpretación simplista de la ecuación relativista de Dirac se topa con problemas con los orbitales de electrones en Z > 1 / α ≈ 137, lo que sugiere que los átomos neutros no pueden existir más allá del elemento 137, y que una tabla periódica de elementos basada en los orbitales de electrones, por lo tanto, se descompone en este punto. [6] Por otro lado, un análisis más riguroso calcula que el límite análogo es Z ≈ 173 donde la subcapa 1s se sumerge en el mar de Dirac , y que en cambio no son átomos neutros los que no pueden existir más allá del elemento 173, sino núcleos desnudos, por tanto, no supone ningún obstáculo para la ampliación del sistema periódico. Los átomos más allá de este número atómico crítico se llamanátomos supercríticos .