Reglas de Woodward-Hoffmann
Las reglas de Woodward-Hoffmann (o reglas de selección pericíclica ), [1] ideadas por Robert Burns Woodward y Roald Hoffmann , son un conjunto de reglas utilizadas para racionalizar o predecir ciertos aspectos de la estereoquímica y la energía de activación de las reacciones pericíclicas , una clase importante de reacciones en química orgánica . Las reglas se entienden mejor en términos del concepto de conservación de la simetría orbital utilizando diagramas de correlación orbital.(consulte la Sección 3 a continuación). Las reglas de Woodward-Hoffmann son una consecuencia de los cambios en la estructura electrónica que ocurren durante una reacción pericíclica y se basan en la fase de los orbitales moleculares que interactúan . Son aplicables a todas las clases de reacciones pericíclicas (y sus procesos 'retro' inversos microscópicos), incluidas (1) electrociclaciones , (2) cicloadiciones , (3) reacciones sigmatrópicas , (4) reacciones de transferencia de grupo , (5) reacciones eno , [2] (6) reacciones queletrópicas , [3] y (7) reacciones diotrópicas . [4]Debido a su elegancia, simplicidad y generalidad, se atribuye a las reglas de Woodward-Hoffmann el primer ejemplo del poder de la teoría de orbitales moleculares para los químicos experimentales. [5]
Woodward y Hoffmann desarrollaron las reglas de selección pericíclica al examinar las correlaciones entre los orbitales reactivo y producto (es decir, cómo los orbitales reactivo y producto se relacionan entre sí mediante distorsiones geométricas continuas que son funciones de la coordenada de reacción). Identificaron la conservación de la simetría orbital como un principio teórico fundamental que dicta el resultado (o la viabilidad) de un proceso pericíclico. También se han propuesto otros enfoques teóricos que conducen a las mismas reglas de selección. Hoffmann recibió el Premio Nobel de Química de 1981 por dilucidar la importancia de la simetría orbital en las reacciones pericíclicas, que compartió con Kenichi Fukui .. Fukui desarrolló un conjunto similar de ideas en el marco de la teoría de los orbitales moleculares fronterizos (FMO). Debido a que Woodward había muerto dos años antes, no era elegible para ganar el que habría sido su segundo Premio Nobel de Química. [6]
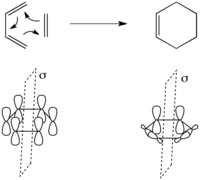
Una reacción pericíclica es una reacción orgánica que procede a través de un único estado de transición cíclico y concertado , cuya geometría permite la superposición continua de un ciclo de orbitales (π y/o σ) . En el lenguaje de la simetría orbital, una reacción pericíclica se denomina simetría prohibida si existe una barrera energética adicional impuesta por la simetría que surge de la correlación prevista de la configuración electrónica del estado fundamental del material de partida con una configuración electrónica del estado excitado del producto y viceversa. (Aunque la regla de no cruceprohibe tal correlación, el aumento de energía a medida que se acerca al cruce previsto da como resultado una barrera de energía adicional). Una reacción pericíclica se clasifica como simetría permitida.si no existe tal barrera impuesta por la simetría. Por lo tanto, estos términos no implican si la reacción en cuestión realmente tendrá lugar. Más bien, con todos los demás factores energéticos siendo iguales, un proceso prohibido por la simetría se verá obstaculizado por una barrera energética adicional. Aunque la barrera impuesta por la simetría suele ser formidable (hasta aprox. 5 eV o 480 kJ/mol en el caso de una cicloadición [2+2] prohibida), la prohibición no es absoluta, y aún pueden tener lugar reacciones prohibidas por la simetría. a través de una vía pericíclica si otros factores (p. ej., liberación de tensión) favorecen la reacción. Del mismo modo, una reacción permitida por la simetría puede ser adelantada por una barrera energética infranqueable resultante de factores no relacionados con la simetría orbital.