Pentafluoruro de tantalio
 | |
| Nombres | |
|---|---|
| Otros nombres pentafluoruro de tantalio | |
| Identificadores | |
Modelo 3D ( JSmol ) | |
| Tarjeta de información ECHA | 100.029.111 |
| Número CE |
|
PubChem CID | |
| Número RTECS |
|
| UNII | |
Tablero CompTox ( EPA ) | |
| |
| |
| Propiedades | |
| TaF 5 | |
| Masa molar | 275,95 g / mol |
| Apariencia | polvo blanco |
| Densidad | 4,74 g / cm 3 , sólido |
| Punto de fusion | 96,8 ° C (206,2 ° F; 369,9 K) |
| Punto de ebullición | 229,5 ° C (445,1 ° F; 502,6 K) |
| se descompone | |
| + 795,0 · 10 −6 cm 3 / mol | |
| Estructura | |
| 0 D | |
| Riesgos | |
| Principales peligros | Fuente de HF |
| no enlistado | |
| Frases R (desactualizadas) | 34 |
| Frases S (desactualizadas) | 26-27-28-36 / 37 / 39-45 |
| punto de inflamabilidad | No es inflamable |
| Compuestos relacionados | |
Compuestos relacionados | TACL 5 NbCl 5 WF 6 |
Salvo que se indique lo contrario, los datos se proporcionan para materiales en su estado estándar (a 25 ° C [77 ° F], 100 kPa). | |
| Referencias de Infobox | |
El fluoruro de tantalio (V) es el compuesto inorgánico de fórmula TaF 5 . Es uno de los principales compuestos moleculares del tantalio . Característico de algunos otros pentafluoruros, el compuesto es volátil pero existe como un oligómero en estado sólido.
Preparación y estructura
Se prepara tratando el metal de tantalio con gas flúor . [1] NbF 5 se prepara de forma similar.
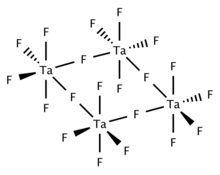
El TaF 5 sólido y fundido es tetramérico y consta de cuatro centros TaF 6 unidos mediante centros de fluoruro puente. El TaF 5 gaseoso adopta la estructura piramidal trigonal con simetría D 3h . [2]
Reacciones y derivadas
La tendencia del TaF 5 a formar grupos en estado sólido indica la acidez de Lewis del monómero. De hecho, TaF 5 reacciona con fuentes de fluoruro para dar iones [TaF
6]-
, [TaF
7]2−
y [TaF
8]3−
. Con bases de Lewis neutras, como el éter dietílico, el TaF 5 forma aductos .
TaF
5se utiliza en combinación con HF como catalizador para la alquilación de alcanos y alquenos y para la protonación de compuestos aromáticos . El TaF
5–El sistema de HF es estable en entornos reductores, a diferencia de SbF5–HF . [3] En presencia de fluoruro, el pentafluoruro de tantalio forma los aniones [TaF
8]3−
, [TaF
7]2−
, o [TaF
6]-
, dependiendo de la naturaleza del contraión y la concentración de HF. Altas concentraciones de HF favorecen el hexafluoruro en virtud de la formación de HF-
2: [4]
- [TaF
7]2−
+ HF ⇌ [TaF
6]-
+ HF-
2
Las sales M 3 TaF 8 se han cristalizado. Para K + = M + , los cristales consisten en [TaF
7]2−
aniones junto con fluoruro que no se coordina con Ta (V). [5] Para M + = M + , los cristales presentan [TaF
8]3−
. [6]
- Sección de la estructura de Na 3 TaF 8 (Ta = turquesa, F = verde).
Relevancia para la separación de Ta y Nb
En el proceso de Marignac , Nb y Ta se separan mediante cristalización fraccionada de K 2 TaF 7 a partir de soluciones de ácido fluorhídrico. En estas condiciones, el niobio forma K 2 NbOF 5 , que es más soluble que K 2 TaF 7 . La reducción de K 2 TaF 7 con sodio produce Ta metálico. [7]
Referencias
- ^ Sacerdote, HF (1950). "Fluoruros metálicos anhidros" Síntesis inorgánica ". 3 : 171-183. Doi : 10.1002 / 9780470132340.ch47 . Cite journal requiere
|journal=( ayuda ) - ^ Holleman, AF; Wiberg, E. "Química inorgánica" Academic Press: San Diego, 2001. ISBN 0-12-352651-5 .
- ^ Arpad Molnar; GK Surya Prakash; Jean Sommer (2009). Química de los superácidos (2ª ed.). Wiley-Interscience. pag. 60. ISBN 978-0-471-59668-4.
- ^ Anatoly Agulyanski (2004). La química de los compuestos de fluoruro de niobio y tantalio . Amsterdam: Elsevier. pag. 134 . ISBN 0-444-51604-2.
- ^ Ľubomír Smrčok, Radovan Černý, Miroslav Boca, Iveta Macková, Blanka Kubíková (2010). "K 3 TaF 8 de datos de polvo de rayos X de laboratorio" . Acta Crystallographica C . 66 (2): pi16 – pi18. doi : 10.1107 / S0108270109055140 . PMID 20124670 . Mantenimiento de CS1: utiliza el parámetro de autores ( enlace )
- ↑ Langer, V .; Smrčok, L .; Boča, M. (2010). "Redeterminación de Na 3 TaF 8 ". Acta Crystallographica C . 66 (9): pi85 – pi86. doi : 10.1107 / S0108270110030556 . PMID 20814090 . Mantenimiento de CS1: utiliza el parámetro de autores ( enlace )
- ^ Klaus Andersson, Karlheinz Reichert, Rüdiger Wolf "Tantalio y compuestos de tantalio" en Enciclopedia de química industrial 2002 de Ullmann, Wiley-VCH. Weinheim. doi : 10.1002 / 14356007.a26_071
- Fluoruros
- Compuestos de tantalio
- Halogenuros metálicos