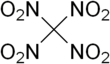| |||
| Nombres | |||
|---|---|---|---|
| Nombre IUPAC Tetranitrometano | |||
| Otros nombres TNM Tetan | |||
| Identificadores | |||
Modelo 3D ( JSmol ) | |||
| CHEMBL | |||
| ChemSpider | |||
| Tarjeta de información ECHA | 100.007.359 | ||
| KEGG | |||
| Número RTECS |
| ||
| UNII | |||
| un numero | 1510 | ||
Tablero CompTox ( EPA ) | |||
| |||
| |||
| Propiedades | |||
| CN 4 O 8 | |||
| Masa molar | 196,04 g / mol | ||
| Apariencia | Líquido o sólido de incoloro a amarillo pálido | ||
| Olor | Acre | ||
| Densidad | 1,623 g / cm 3 | ||
| Punto de fusion | 13,8 ° C (56,8 ° F; 286,9 K) | ||
| Punto de ebullición | 126 ° C (259 ° F; 399 K) | ||
| insol | |||
| Presión de vapor | 8 mmHg (20 ° C) [2] | ||
| -43,02 · 10 −6 cm 3 / mol | |||
| Riesgos | |||
| Principales peligros | Oxidante, puede formar mezclas explosivas. | ||
| Ficha de datos de seguridad | ICSC 1468 | ||
  | |||
| Frases R (desactualizadas) | R8 R23 / 24/25 R36 / 38 R45 | ||
| Frases S (desactualizadas) | S17 S45 | ||
| NFPA 704 (diamante de fuego) |  3 1 2 BUEY | ||
| Dosis o concentración letal (LD, LC): | |||
LC 50 ( concentración media ) | 18 ppm (rata, 4 h) 100 ppm (gato, 20 min) 54 ppm (ratón, 4 h) [3] | ||
| NIOSH (límites de exposición a la salud de EE. UU.): | |||
PEL (permitido) | TWA 1 ppm (8 mg / m 3 ) [2] | ||
REL (recomendado) | TWA 1 ppm (8 mg / m 3 ) [2] | ||
IDLH (peligro inmediato) | 4 ppm [2] | ||
| Compuestos relacionados | |||
Compuestos relacionados | Hexanitroetano Octanitropentano Trinitrometano | ||
Salvo que se indique lo contrario, los datos se proporcionan para materiales en su estado estándar (a 25 ° C [77 ° F], 100 kPa). | |||
| Referencias de Infobox | |||
El tetranitrometano o TNM es un oxidante orgánico con fórmula química C (NO 2 ) 4 . Su estructura química consta de cuatro grupos nitro unidos a un átomo de carbono. En 1857 se sintetizó por primera vez mediante la reacción de cianoacetamida de sodio con ácido nítrico . [4]
Usos
Se ha investigado para su uso como oxidante en cohetes bipropelentes ; sin embargo, su alto punto de fusión lo hace inadecuado. No se puede hacer que el tetranitrometano altamente purificado explote, pero su sensibilidad aumenta drásticamente por los contaminantes oxidables, como los aditivos anticongelantes. Esto lo hace efectivamente inutilizable como propulsor. [5] En el laboratorio se utiliza como reactivo para la detección de dobles enlaces en compuestos orgánicos y como reactivo nitrante. También ha encontrado uso como aditivo del combustible diesel para aumentar el índice de cetano . [6]
Preparación
El TNM es un líquido amarillo pálido que se puede preparar en el laboratorio mediante la nitración de anhídrido acético con ácido nítrico anhidro (método de Chattaway). [7] Este método se intentó a escala industrial en la década de 1950 por Nitroform Products Company en Newark, EE. UU., Pero toda la planta fue destruida por una explosión en 1953. [8]
La primera producción a escala industrial se inició en Alemania durante la Segunda Guerra Mundial en un esfuerzo por mejorar el número de cetano del combustible diesel. Este proceso mejoró el método original, que comenzó con ácido acético y ácido nítrico. [9] Independientemente del rendimiento o el costo, se produjeron aproximadamente 10 toneladas de TNM en unas pocas semanas. Sin embargo, este proceso de producción no se ha vuelto a utilizar industrialmente después del final de la guerra, debido a los altos costos asociados. [10]
Para uso comercial se ha utilizado un método más económico a partir del acetileno . [11] En primer lugar, el ácido nítrico que contiene nitrato de mercurio se reduce con acetileno, lo que da como resultado trinitrometano (nitroformo) y una mezcla de dióxido de carbono y óxido de nitrógeno como gas residual. Los óxidos de nitrógeno son valiosos y normalmente se recuperan como ácido nítrico en una torre de absorción. El nitroformo resultante se convierte en TNM mediante la adición de ácido nítrico y sulfúrico a temperaturas más altas. Con este método se puede alcanzar un rendimiento del 90% (basado en ácido nítrico) antes de la purificación. [12]
Estructura [13]

TNM es un excelente ejemplo de flexibilidad molecular. Llevó los métodos estructurales al límite de su aplicabilidad, como lo demuestra el hecho de que se intentó determinar la estructura de TNM durante un período de más de 70 años en varias fases.
Las primeras investigaciones por difracción de electrones de gas no pudieron describir el patrón de difracción observado en su totalidad y solo la aplicación de un modelo de cuatro dimensiones con respecto al movimiento correlacionado de los cuatro grupos de NO 2 sobre los enlaces CN pudo describir completamente las observaciones experimentales. El problema ocurre porque la simetría local doble de las unidades C-NO 2 versus la simetría triple de la unidad C (NO 2 ) 3 , así como la proximidad de los grupos NO 2 dificultan su libre rotación, es la fuente de un movimiento mutuamente obstaculizado muy complicado de los grupos NO 2 .
La estructura cristalina también se ha intentado varias veces. Una primera solución decente del problema requirió un modelo que describiera una fase cristalina de alta temperatura altamente desordenada de una fase de alta temperatura (> 174.4 K) como se muestra en la Figura 1. Reducción de la simetría y análisis del hermanamiento de los cristales conducidos finalmente a un desorden resuelto de la estructura que se muestra en la Figura 2.
La estructura de una fase ordenada de baja temperatura contiene tres moléculas independientes en la unidad asimétrica. Los parámetros estructurales de las fases gaseosa y sólida se enumeran en la siguiente tabla para su comparación.
| Parámetro | GED | XRD (rango) |
| r C – N | 1,509 (5) | 1,502 (4) - 1,554 (5) |
| r N – O (eclip) | 1.201 (3) | 1,198 (4) - 1,215 (5) |
| r N – O (ciervo) | 1.199 (3) | 1,178 (5) - 1,222 (4) |
| ∡NCN_1 | 105,1 (16) | 108,2 (3) - 110,9 (3) |
| ∡NCN_2 | 111,7 (8) | 107,3 (3) - 111,4 (2) |
| ∡NCN_3 | 106,6 (2) - 107,1 (3) | |
| ∡ONO | 129,2 (17) | 128,0 (4) - 132,3 (4) |
Seguridad
La capacidad de TNM para detonar se ve muy afectada por la presencia de impurezas, incluso en pequeñas cantidades. TNM forma mezclas explosivas extremadamente poderosas cuando se agregan combustibles en proporciones estequiométricas. Muchas de estas mezclas muestran una sensibilidad al impacto incluso mayor que la de la nitroglicerina . [14]
El tetranitrometano se puede utilizar como componente de explosivos líquidos altamente explosivos como agente oxidante. Forma mezclas altamente explosivas con todas las sustancias inflamables. Cuando experimente con esta sustancia, ¡no use papel para filtrar! Incluso las pequeñas impurezas hacen que el tetranitrometano sea un explosivo que explota con el impacto o la fricción. Es bien conocido un trágico experimento de conferencias en la Universidad de Münster en 1920, donde un pequeño tubo de acero que contenía tetranitrometano, tolueno y algodón absorbente detonó poco antes de quemarse de tal manera que más de 30 estudiantes resultaron heridos, algunos de gravedad; [15] sin embargo, sobre la base de los registros de la oficina del rector, se documentan hasta 10 muertes y más de una docena de lesiones. [dieciséis]Acto seguido, el Reichsanstalt químico-técnico alemán determinó una velocidad de detonación de 9300 metros por segundo. Alfred Stettbacher luego demostró comparativamente que esta mezcla era mucho más explosiva que el hexógeno , pentrita , gelatina explosiva o panclastita y, por lo tanto, representaba el explosivo más destructivo de todos.
TNM reacciona con la humedad a pH elevado para producir trinitrometano (nitroformo) que reacciona fácilmente con metales para formar sales altamente inestables y explosivas.
El tetranitrometano es muy tóxico. La absorción de tan solo 2.5 mg / kg puede causar metahemoglobinemia , edema pulmonar y daño al hígado, riñón y sistema nervioso central. Se espera razonablemente que sea un carcinógeno humano. [17]
Referencias
- ^ Índice de Merck , undécima edición, 9164 .
- ^ a b c d Guía de bolsillo de NIOSH sobre peligros químicos. "# 0605" . Instituto Nacional de Seguridad y Salud Ocupacional (NIOSH).
- ^ "Tetranitrometano" . Concentraciones inmediatamente peligrosas para la vida o la salud (IDLH) . Instituto Nacional de Seguridad y Salud Ocupacional (NIOSH).
- ^ LN Shishkov (1857). "Sur la constitución de l'acide fulminique et un nouvelle serie de corps derives de l'acide acetique" . Annales de chimie et de physique . 49 (11): 310.
- ^ JG Tschinkel (1956). "Tetranitrometano como oxidante en propulsores de cohetes". Química Industrial y de Ingeniería . 48 (4): 732–735. doi : 10.1021 / ie50556a022 .
- ^ KV Altukhov, VV Perekalin (1976). "La química del tetranitrometano". Reseñas de productos químicos rusos . 45 (11): 1052–1066. doi : 10.1070 / RC1976v045n11ABEH002759 .
- ^ Liang, P. (1941). "Tetranitrometano" (PDF) . Síntesis orgánicas . 21 : 105. ; Volumen colectivo , 3 , p. 803
- ^ Mahoney contra Nitroform Co. , 114 A.2d 863 (División de apelación de Nueva Jersey, 1955).
- ^ FD Chattaway (1910). "Un método sencillo de preparación de tetranitrometano" . Revista de la Sociedad Química . 97 : 2099–2102. doi : 10.1039 / CT9109702099 .
- ^ KF Hager (1949). "Tetranitrometano". Química Industrial y de Ingeniería . 41 (10): 2168–2172. doi : 10.1021 / ie50478a028 .
- ^ KJP Orton, PV McKie (1920). "La acción del ácido nítrico sobre los hidrocarburos insaturados. La acción del ácido nítrico sobre el acetileno" . Revista de la Sociedad Química . 117 : 283-297. doi : 10.1039 / CT9201700283 .
- ^ Urbanski, Tadeusz (1964). Química y Tecnología de Explosivos . Yo . Pergamon Press. págs. 589–594. LCCN 83002261 .
- ↑ Vishnevskiy, Yury V .; Tikhonov, Denis S .; Schwabedissen, Jan; Stammler, Hans-Georg; Moll, Richard; Krumm, Burkhard; Klapötke, Thomas M .; Mitzel, Norbert W. (1 de agosto de 2017). "Tetranitrometano: una pesadilla de flexibilidad molecular en los estados gaseoso y sólido" . Angewandte Chemie International Edition . 56 (32): 9619–9623. doi : 10.1002 / anie.201704396 . PMID 28557111 .
- ^ Urbanski, Tadeusz (1964). Química y Tecnología de Explosivos . Yo . Pergamon Press. pag. 593. LCCN 83002261 .
- ^ Real Sociedad de Química: accidente de explosión en el Instituto de Química, Universidad de Munster iW y su causa. En: J. Chem. Soc., Abstr. , 1920, 118, ii457-ii483. doi: 10.1039 / CA9201805457
- ^ Universitätsarchiv Münster, NU EI 9 spec., Explosionsunglück im Chemischen Institut am 27. Mayo de 1920, Rüst, A. Ebert, K. Egli: Unfälle beim chemischen Arbeiten. Rascher, 1948, pág. 23.
- ^ Programa Nacional de Toxicología (2011). "Tetranitrometano" (PDF) . Informe sobre carcinógenos (12ª ed.). Programa Nacional de Toxicología . Archivado (PDF) desde el original el 31 de enero de 2013 . Consultado el 14 de agosto de 2012 .
Enlaces externos
- Página del libro web para CN4O8
- CDC - Guía de bolsillo de NIOSH sobre peligros químicos