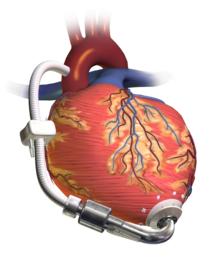
| Dispositivo de asistencia ventricular | |
|---|---|
 Un dispositivo de asistencia del ventrículo izquierdo (DAVI) que bombea sangre desde el ventrículo izquierdo a la aorta, conectado a una unidad de control y una batería de uso externo. | |
| MedlinePlus | 007268 |
Un dispositivo de asistencia ventricular (DAV) es un dispositivo electromecánico para ayudar a la circulación cardíaca, que se utiliza para reemplazar parcial o completamente la función de un corazón defectuoso . La función de un VAD difiere de la de un marcapasos cardíaco artificial en que un VAD bombea sangre, mientras que un marcapasos envía impulsos eléctricos al músculo cardíaco. Algunos DAV son para uso a corto plazo, generalmente para pacientes que se recuperan de un infarto de miocardio (ataque cardíaco) y para pacientes que se recuperan de una cirugía cardíaca ; algunos son para uso a largo plazo (de meses a años hasta la perpetuidad), generalmente para pacientes que padecen insuficiencia cardíaca avanzada .
Los DAV están diseñados para ayudar al ventrículo derecho (RVAD) o al ventrículo izquierdo (DAVI), o para ayudar a ambos ventrículos (BiVAD). El tipo de DAV implantado depende del tipo de enfermedad cardíaca subyacente, y sobre la resistencia arterial pulmonar, que determina la carga de trabajo del ventrículo derecho. El dispositivo de asistencia ventricular izquierda (DAVI) es el dispositivo más común que se aplica a un corazón defectuoso (es suficiente en la mayoría de los casos; el lado derecho del corazón a menudo puede hacer uso del flujo sanguíneo muy aumentado), pero cuando el La resistencia arterial pulmonar es alta, por lo que podría ser necesario un dispositivo de asistencia ventricular derecha (ADVD) (adicional) para resolver el problema de la circulación cardíaca. Si se necesita tanto un DAVI como un DAVD, normalmente se utiliza un BiVAD, en lugar de un DAVI y un DAVD separados.
Normalmente, el DAV a largo plazo se utiliza como puente al trasplante (BTT), lo que mantiene al paciente con vida, en condiciones razonablemente buenas y capaz de esperar el trasplante de corazón fuera del hospital. Otros "puentes" incluyen el puente a la candidatura, el puente a la decisión y el puente a la recuperación. En algunos casos, los DAV también se utilizan como terapia de destino (DT). En este caso, el paciente no se someterá a un trasplante de corazón y dependerá del VAD por el resto de su vida. [1] [2]
Los DAV son distintos de los corazones artificiales , que están diseñados para asumir la función cardíaca y, por lo general, requieren la extracción del corazón del paciente.
Diseño [ editar ]
Bombas [ editar ]
Las bombas utilizadas en los DAV se pueden dividir en dos categorías principales: bombas pulsátiles [3] que imitan la acción pulsante natural del corazón y bombas de flujo continuo. [4] Los VAD pulsátiles utilizan bombas de desplazamiento positivo . [5] [6] [7] En algunas bombas pulsátiles (que utilizan aire comprimido como fuente de energía [8] ), el volumen ocupado por la sangre varía durante el ciclo de bombeo. Si la bomba está contenida dentro del cuerpo, entonces se requiere un tubo de ventilación al aire exterior.
Los DAV de flujo continuo son más pequeños y han demostrado ser más duraderos que los DAV pulsátiles. [9] Normalmente utilizan una bomba centrífuga o una bomba de flujo axial . Ambos tipos tienen un rotor central que contiene imanes permanentes. Las corrientes eléctricas controladas que atraviesan las bobinas contenidas en la carcasa de la bomba aplican fuerzas a los imanes, que a su vez hacen que los rotores giren. En las bombas centrífugas, los rotores están configurados para acelerar la sangre de forma circunferencial y de ese modo hacer que se mueva hacia el borde exterior de la bomba, mientras que en las bombas de flujo axial los rotores son más o menos cilíndricos con palas helicoidales, lo que provoca que la sangre acelerarse en la dirección del eje del rotor. [10]
Un problema importante con las bombas de flujo continuo es el método utilizado para suspender el rotor. Las primeras versiones usaban cojinetes sólidos; sin embargo, las bombas más nuevas, algunas de las cuales están aprobadas para su uso en la UE, utilizan levitación magnética ("maglev") [11] [12] [13] o suspensión hidrodinámica . Estas bombas contienen solo una parte móvil (el rotor). [ cita requerida ]
Historia [ editar ]
El primer sistema de dispositivo de asistencia ventricular izquierda (DAVI) fue creado por Domingo Liotta en el Baylor College of Medicine en Houston en 1962. El primer DAVI fue implantado en 1963 por Liotta y E. Stanley Crawford. La primera implantación exitosa de un LVAD fue completada en 1966 por Liotta junto con el Dr. Michael E. DeBakey . La paciente era una mujer de 37 años, y un circuito paracorpóreo (externo) pudo brindar soporte mecánico durante los 10 días posteriores a la cirugía. [15] La primera implantación exitosa a largo plazo de un DAVI fue realizada en 1988 por el Dr. William F. Bernhard del Centro Médico del Hospital Infantil de Boston y Thermedics, Inc. de Woburn, MA, bajo los Institutos Nacionales de Salud(NIH) contrato de investigación que desarrolló HeartMate, un dispositivo de asistencia controlado electrónicamente. Esto fue financiado por un contrato de tres años por $ 6.2 millones con Thermedics and Children's Hospital, Boston, MA, del Instituto Nacional del Corazón, los Pulmones y la Sangre , un programa de los NIH. [16] Los primeros DAV emulaban al corazón mediante una acción "pulsátil" en la que la sangre se succionaba alternativamente en la bomba desde el ventrículo izquierdo y luego se expulsaba hacia la aorta. Los dispositivos de este tipo incluyen el HeartMate IP LVAS, que fue aprobado para su uso en los EE. UU. Por la Administración de Alimentos y Medicamentos (FDA) en octubre de 1994. Estos dispositivos comenzaron a ganar aceptación a fines de la década de 1990 como cirujanos cardíacos, incluido Eric Rose , OH Frazier yMehmet Oz comenzó a popularizar el concepto de que los pacientes podían vivir fuera del hospital. La cobertura mediática de pacientes ambulatorios con DAV subrayó estos argumentos. [17]
El trabajo más reciente se ha concentrado en bombas de flujo continuo, que pueden clasificarse aproximadamente como bombas centrífugas o bombas impulsadas por impulsor de flujo axial . Estas bombas tienen la ventaja de una mayor simplicidad que resulta en un tamaño más pequeño y una mayor confiabilidad. Estos dispositivos se conocen como VAD de segunda generación. Un efecto secundario es que el usuario no tendrá pulso , [18] o que la intensidad del pulso se reducirá seriamente. [19]
Los VAD de tercera generación suspenden el impulsor en la bomba utilizando suspensión hidrodinámica o electromagnética, eliminando así la necesidad de cojinetes y reduciendo el número de piezas móviles a una. [ cita requerida ]
Otra tecnología que se está sometiendo a ensayos clínicos es el uso de inducción transcutánea para alimentar y controlar el dispositivo en lugar de utilizar cables percutáneos. Aparte de la obvia ventaja cosmética, esto reduce el riesgo de infección y la consiguiente necesidad de tomar medidas preventivas. Una bomba pulsátil que utiliza esta tecnología tiene la aprobación de la marca CE y se encuentra en ensayos clínicos para la aprobación de la FDA de EE. UU. [ cita requerida ]
Un enfoque muy diferente en las primeras etapas del desarrollo fue el uso de un manguito inflable alrededor de la aorta. Inflar el manguito contrae la aorta y desinflar el manguito permite que la aorta se expanda; de hecho, la aorta se convierte en un segundo ventrículo izquierdo. Un refinamiento propuesto es utilizar el músculo esquelético del paciente, impulsado por un marcapasos , para alimentar este dispositivo, lo que lo haría verdaderamente autónomo. Sin embargo, en la década de 1990 se intentó una operación similar ( cardiomioplastia ) con resultados decepcionantes. En cualquier caso, tiene ventajas potenciales sustanciales al evitar la necesidad de operar en el corazón mismo y al evitar cualquier contacto entre la sangre y el dispositivo. Este enfoque implica un retorno a un flujo pulsátil. [ cita requerida ]
Peter Houghton fue el receptor de un DAV para uso permanente que más tiempo sobrevivió. Recibió un LVAD Jarvik 2000 experimental en junio de 2000. Desde entonces, completó una caminata benéfica de 91 millas, publicó dos libros, dio numerosas conferencias, caminó por los Alpes suizos y el oeste americano, voló en un avión ultraligero y viajó extensamente en todo el mundo. Murió de una lesión renal aguda en 2007 a la edad de 69 años. [20] [21]
Estudios y resultados [ editar ]
Desarrollos recientes [ editar ]
- En julio de 2009 en Inglaterra, los cirujanos extrajeron un corazón de donante que se había implantado en un niño pequeño junto a su corazón nativo, después de que su corazón nativo se había recuperado. Esta técnica sugiere que un dispositivo de asistencia mecánica, como un DAVI, puede quitar parte o todo el trabajo del corazón nativo y permitirle que se cure. [22]
- En julio de 2009, los resultados de seguimiento de 18 meses del ensayo clínico HeartMate II concluyeron que el DAVI de flujo continuo proporciona un apoyo hemodinámico eficaz durante al menos 18 meses en pacientes en espera de trasplante, con mejor estado funcional y calidad de vida. [23]
- El Hospital Universitario de Heidelberg informó en julio de 2009 que allí se implantó el primer HeartAssist5, conocido como la versión moderna del DeBakey VAD. El HeartAssist5 pesa 92 gramos, está hecho de titanio y plástico y sirve para bombear sangre desde el ventrículo izquierdo a la aorta. [24]
- Se está llevando a cabo un ensayo clínico de fase 1 (en agosto de 2009), que consta de pacientes con injerto de derivación de la arteria coronaria y pacientes en insuficiencia cardíaca en etapa terminal que tienen un dispositivo de asistencia ventricular izquierda. El ensayo consiste en probar un parche llamado Anginera que contiene células que secretan factores de crecimiento similares a hormonas que estimulan el crecimiento de otras células. Los parches se siembran con células del músculo cardíaco y luego se implantan en el corazón con el objetivo de que las células musculares comiencen a comunicarse con los tejidos nativos de una manera que permita contracciones regulares. [25] [26]
- En septiembre de 2009, un medio de noticias de Nueva Zelanda, Stuff, informó que en otros 18 meses a dos años, un nuevo dispositivo inalámbrico estará listo para un ensayo clínico que alimentará los VAD sin contacto directo. Si tiene éxito, esto puede reducir la posibilidad de infección como resultado del cable de alimentación a través de la piel. [27]
- Los Institutos Nacionales de Salud (NIH) otorgaron una subvención de $ 2.8 millones para desarrollar un corazón artificial total "sin pulso" utilizando dos VAD de Micromed , inicialmente creados por Michael DeBakey y George Noon . La subvención se renovó por un segundo año de investigación en agosto de 2009. El corazón artificial total se creó utilizando dos VAD HeartAssist5, mediante los cuales un VAD bombea sangre por todo el cuerpo y el otro hace circular sangre hacia y desde los pulmones. [28]
- HeartWare International anunció en agosto de 2009 que había superado los 50 implantes de su sistema de asistencia ventricular HeartWare en su ensayo clínico ADVANCE, un estudio IDE aprobado por la FDA. El estudio tiene como objetivo evaluar el sistema como puente al trasplante para pacientes con insuficiencia cardíaca en etapa terminal. El estudio, Evaluación del sistema HeartWare LVAD para el tratamiento de la insuficiencia cardíaca avanzada, es un estudio multicéntrico que comenzó en mayo de 2009. [29] [30]
- El 27 de junio de 2014, la Escuela de Medicina de Hannover en Hannover, Alemania, realizó el primer implante humano de HeartMate III bajo la dirección del profesor Axel Haverich MD, jefe del Departamento de Cirugía Cardiotorácica, Trasplante y Vascular y cirujano Jan Schmitto, MD, Ph.D. [31]
- El 21 de enero de 2015 se publicó un estudio en el Journal of American College of Cardiology que sugiere que el uso prolongado de LVAD puede inducir la regeneración del corazón. [32] Esto puede explicar el fenómeno del puente a la recuperación descrito por primera vez por el grupo Yacoub en NEJM en 2009 (arriba). [ cita requerida ]
- El jugador de béisbol del Salón de la Fama Rod Carew tenía insuficiencia cardíaca congestiva y se le colocó un HeartMate II. Luchaba con el uso del equipo, por lo que unió esfuerzos para ayudar a proporcionar la ropa más útil para ayudar al HeartMate II y HeartMate III. [33]
- En diciembre de 2018, se realizaron dos casos clínicos en Kazajstán y se implantó en humanos un sistema LVAD completamente inalámbrico de Jarvik 2000 combinado con Leviticus Cardio FiVAD (Dispositivo de asistencia ventricular completamente implantable). La tecnología de transferencia de energía inalámbrica basada en la técnica llamada Coplanar Energy Transfer (CET) que es capaz de transferir energía desde una bobina de transmisión externa a una pequeña bobina de recepción que se implanta en el cuerpo humano. En la fase postoperatoria temprana, la operación CET se logró como se esperaba en ambos pacientes, lo que alimentó la bomba y mantuvo la batería cargada para permitir los procedimientos médicos y de enfermería. El Levítico CardioSistema FiVAD con tecnología de transferencia de energía inalámbrica coplanar que mejora el riesgo de infección mediante la eliminación de la línea motriz al tiempo que proporciona una transmisión de energía exitosa que permite un soporte sin tapizar sustancial (aproximadamente 6 horas) del LVAD. [34]
La mayoría de los VAD del mercado actual son algo voluminosos. El dispositivo más pequeño aprobado por la FDA, el HeartMate II, pesa aproximadamente 1 libra (0,45 kg) y mide 3 pulgadas (7,6 cm). Esto ha demostrado ser particularmente importante para las mujeres y los niños, para quienes las alternativas habrían sido demasiado amplias. [35] A partir de 2017, HeartMate III ha sido aprobado por la FDA. Es más pequeño que su predecesor HeartMate II y utiliza un impulsor de levitación magnética completo en lugar del sistema de cojinetes de copa y bolas que se encuentra en HeartMate II. [36]
Un dispositivo, VentrAssist, obtuvo la aprobación de la marca CE para su uso en la UE y comenzó los ensayos clínicos en los EE. UU. En junio de 2007, estas bombas se habían implantado en más de 100 pacientes. En 2009, Ventracor fue puesto en manos de Administradores debido a problemas financieros y posteriormente ese año fue liquidado. Ninguna otra empresa compró la tecnología, por lo que el dispositivo VentrAssist estaba prácticamente desaparecido. Alrededor de 30 a 50 pacientes en todo el mundo siguen siendo compatibles con los dispositivos VentrAssist en enero de 2010. [ cita requerida ]
El HeartWare HVAD funciona de manera similar al VentrAssist, aunque es mucho más pequeño y no requiere la implantación de un bolsillo abdominal. El dispositivo ha obtenido la marca CE en Europa y la aprobación de la FDA en los EE. UU. Recientemente, se demostró que el HeartWare HVAD se puede implantar mediante un acceso limitado sin esternotomía . [37]
En un pequeño número de casos, los dispositivos de asistencia del ventrículo izquierdo, combinados con la terapia con medicamentos, han permitido que el corazón se recupere lo suficiente como para que el dispositivo se pueda extraer ( explantar ). [1] [2]
Estudio fundamental del DAVI HeartMate II [ editar ]
Una serie de estudios que involucran el uso del LVAD HeartMate II han demostrado ser útiles para establecer la viabilidad y los riesgos del uso de LVAD para la terapia puente al trasplante y el destino.
- El ensayo piloto del HeartMate II LVAD comenzó en noviembre de 2003 y consistió en 46 pacientes del estudio en 15 centros. Los resultados incluyeron 11 pacientes que recibieron apoyo durante más de un año y tres pacientes que recibieron apoyo durante más de dos años. [ cita requerida ]
- El ensayo fundamental HeartMate II comenzó en 2005 e incluyó la evaluación de HeartMate II para dos indicaciones: puente al trasplante (BTT) y terapia de destino (DT), o apoyo permanente a largo plazo. Thoratec Corp. anunció que esta era la primera vez que la FDA había aprobado un ensayo clínico para incluir ambas indicaciones en un protocolo. [38] [39] [40]
- Un estudio multicéntrico en los Estados Unidos de 2005 a 2007 con 113 pacientes (de los cuales 100 informaron resultados principales) mostró que las mejoras significativas en la función eran prevalentes después de tres meses y una tasa de supervivencia del 68% después de doce meses. [41]
- Sobre la base de los datos de seguimiento de un año de los primeros 194 pacientes inscritos en el ensayo, la FDA aprobó HeartMate II para el puente al trasplante. El ensayo proporcionó evidencia clínica de mejores tasas de supervivencia y calidad de vida para una amplia gama de pacientes. [42] [43]
- Los datos de seguimiento de 18 meses de 281 pacientes que habían alcanzado el punto final del estudio o completado 18 meses de seguimiento posoperatorio mostraron una mejor supervivencia, menos eventos adversos frecuentes y una mayor confiabilidad con LVADS de flujo continuo en comparación con los dispositivos de flujo pulsátil. De los 281 pacientes, 157 pacientes se habían sometido a un trasplante, 58 pacientes continuaban con DAVI en su cuerpo y siete pacientes tenían el DAVI extirpado porque su corazón se recuperó; los 56 restantes habían muerto. Los resultados mostraron que la clase NYHA de los pacientesde insuficiencia cardíaca había mejorado significativamente después de seis meses de soporte del DAVI en comparación con la línea de base anterior al DAVI. Aunque este ensayo involucró la indicación del puente al trasplante, los resultados proporcionan evidencia temprana de que los DAVI de flujo continuo tienen ventajas en términos de durabilidad y confiabilidad para los pacientes que reciben soporte mecánico para la terapia de destino. [44]
- Tras la aprobación de la FDA de HeartMate II LVAD para fines de puente al trasplante, se llevó a cabo un estudio posterior a la aprobación ("registro") para evaluar la eficacia del dispositivo en un entorno comercial. El estudio encontró que el dispositivo mejoró los resultados, tanto en comparación con otros tratamientos con DAVI como con los pacientes de referencia. Específicamente, los pacientes con HeartMate II mostraron niveles de creatinina más bajos, las tasas de supervivencia a 30 días fueron considerablemente más altas (96%) y el 93% alcanzó resultados exitosos (trasplante, recuperación cardíaca o DAVI a largo plazo). [45]
HARPS [ editar ]
El Estudio del Protocolo de Recuperación de Harefield (HARPS) es un ensayo clínico para evaluar si los pacientes con insuficiencia cardíaca avanzada que requieren soporte de DAV pueden recuperar la función miocárdica suficiente para permitir la extracción del dispositivo (lo que se conoce como explantación). HARPS combina un LVAD (HeartMate XVE) con medicamentos orales convencionales para la insuficiencia cardíaca, seguido del novedoso agonista β2 clenbuterol . Esto abre la posibilidad de que algunos pacientes con insuficiencia cardíaca avanzada renuncien al trasplante de corazón. [46]
Hasta la fecha, el 73% (11 de 15) de los pacientes que se sometieron al régimen de terapia combinada demostraron una recuperación suficiente para permitir la explantación y evitar el trasplante de corazón; la ausencia de insuficiencia cardíaca recurrente en los pacientes supervivientes fue del 100% y el 89% al año y a los cuatro años después de la explantación, respectivamente; la fracción de eyección promedio fue del 64% a los 59 meses después de la explantación; todos los pacientes eran de clase I de la NYHA y no se informaron efectos adversos significativos con la terapia con clenbuterol. [ cita requerida ]
REMATCH [ editar ]
El ensayo clínico REMATCH (Evaluación aleatoria de la asistencia mecánica para el tratamiento de la insuficiencia cardíaca congestiva) comenzó en mayo de 1998 y se desarrolló hasta julio de 2001 en 20 centros de trasplante cardíaco en los EE. UU. El ensayo se diseñó para comparar la implantación a largo plazo de dispositivos de asistencia ventricular izquierda con el manejo médico óptimo para pacientes con insuficiencia cardíaca en etapa terminal que requieren, pero no califican para recibir un trasplante cardíaco. Como resultado de los resultados clínicos, el dispositivo recibió la aprobación de la FDA para ambas indicaciones, en 2001 y 2003, respectivamente. [47]
El ensayo demostró una mejora del 81% en la supervivencia a dos años entre los pacientes que recibieron HeartMate XVE en comparación con el tratamiento médico óptimo. Además, un estudio de terapia de destino posterior al ensayo REMATCH demostró una mejora adicional del 17% (61% frente a 52%) en la supervivencia a un año de los pacientes a los que se les implantó un DAV (HeartMate XVE), con una implicación para la selección adecuada. de candidatos y momento de implantación del DAV. [ cita requerida ]
Una prueba realizada en 2001 por el Dr. Eric A. Rose y el grupo de estudio REMATCH con pacientes con insuficiencia cardíaca congestiva que no eran elegibles para un trasplante mostró una supervivencia a dos años del 23% para los implantados con un DAVI en comparación con el 8% para aquellos que fueron tratados con drogas. Las dos principales complicaciones de la implantación de DAV fueron infección y falla mecánica [ cita requerida ]
Según un estudio de cohorte retrospectivo que comparó pacientes tratados con un dispositivo de asistencia ventricular izquierda versus terapia inotrópica mientras esperaban un trasplante de corazón, el grupo tratado con DAVI había mejorado la función clínica y metabólica en el momento del trasplante con mejor presión arterial, sodio, nitrógeno ureico en sangre, y creatinina. Después del trasplante, el 57,7% del grupo de inótropos presentó insuficiencia renal frente al 16,6% del grupo de DAVI; 31,6% del grupo inotrópico tenía insuficiencia cardíaca derecha versus 5,6% en el grupo LVAD; y la supervivencia libre de eventos fue del 15,8% en el grupo de inotrópicos frente al 55,6% en el grupo de DAVI. [48]
Complicaciones y efectos secundarios [ editar ]
El sangrado es la complicación temprana postoperatoria más común después de la implantación o explantación de DAVI, lo que requiere reintervención hasta en el 60% de los receptores. [49] [50] Las implicaciones de las transfusiones de sangre masivas son grandes e incluyen infección, insuficiencia pulmonar, aumento de los costos, insuficiencia cardíaca derecha, alosensibilización y transmisión viral, algunas de las cuales pueden resultar fatales o impedir el trasplante. [50] Cuando se produce una hemorragia, afecta la mortalidad de Kaplan-Meier al año. [49] Además de la complejidad de la población de pacientes y la complejidad de estos procedimientos que contribuyen al sangrado, los propios dispositivos pueden contribuir a la coagulopatía grave que puede sobrevenir cuando se implantan estos dispositivos. [51]
Debido a que los dispositivos generalmente hacen que la sangre fluya sobre una superficie no biológica, lo que predispone a la sangre a la coagulación , se necesitan medidas de anticoagulación . Un dispositivo, el HeartMate XVE, está diseñado con una superficie biológica derivada de la fibrina y no requiere anticoagulación a largo plazo (excepto aspirina); desafortunadamente, esta superficie biológica también puede predisponer al paciente a la infección a través de la reducción selectiva de ciertos tipos de leucocitos. [52]
Los nuevos diseños de VAD que ahora están aprobados para su uso en la Comunidad Europea y están siendo sometidos a pruebas para la aprobación de la FDA prácticamente han eliminado las fallas mecánicas. [ cita requerida ]
Es difícil medir la presión arterial en pacientes con DAVI utilizando la monitorización estándar de la presión arterial y la práctica actual es medir mediante ecografía Doppler en pacientes ambulatorios y monitorización invasiva de la presión arterial en pacientes hospitalizados . [53]
La infección relacionada con VAD puede ser causada por una gran cantidad de organismos diferentes: [54]
- Bacterias Gram positivas ( estafilococos , especialmente Staph. Aureus , enterococos )
- Bacterias Gram negativas ( Pseudomonas aeruginosa , especie Enterobacter , especie Klebsiella )
- Hongos, especialmente especies de Candida
El tratamiento de la infección relacionada con VAD es sumamente difícil y muchos pacientes mueren a causa de la infección a pesar del tratamiento óptimo. El tratamiento inicial debe ser con antibióticos de amplio espectro, pero se deben hacer todos los esfuerzos posibles para obtener muestras apropiadas para cultivo. La decisión final con respecto a la terapia con antibióticos debe basarse en los resultados de los cultivos microbiológicos. [ cita requerida ]
Otros problemas incluyen inmunosupresión , coagulación con accidente cerebrovascular resultante y hemorragia secundaria a la anticoagulación. Algunos de los componentes de poliuretano utilizados en los dispositivos provocan la eliminación de un subconjunto de células inmunitarias cuando la sangre entra en contacto con ellas. Esto predispone al paciente a infecciones fúngicas y algunas virales que requieren una terapia profiláctica adecuada . [55]
Teniendo en cuenta la multitud de riesgos y modificaciones del estilo de vida asociados con los implantes de dispositivos de asistencia ventricular, [56] es importante que los posibles pacientes estén informados antes de la toma de decisiones. [57] Además de la consulta con el médico, se encuentran disponibles varios recursos en Internet dirigidos por el paciente para ayudar en la educación del paciente. [58] [59]
Lista de dispositivos VAD implantables [ editar ]
Esta sección debe actualizarse . ( Abril de 2015 ) |
Esta es una lista parcial y puede que nunca esté completa.
Las adiciones referenciadas son bienvenidas.
| Dispositivo | Fabricante | Tipo | Estado de aprobación a julio de 2010 |
|---|---|---|---|
| HeartAssist5 | ReliantHeart | Flujo continuo impulsado por un rotor de flujo axial. | Aprobado para su uso en la Unión Europea. La versión infantil está aprobada por la FDA para su uso en niños en EE. UU. En proceso de ensayos clínicos en EE. UU. Para la aprobación de la FDA. |
| Novacor | Corazón del mundo | Pulsátil. | Fue aprobado para su uso en América del Norte, la Unión Europea y Japón. Ahora desaparecido y ya no es compatible con el fabricante. (HeartWare completó la adquisición en agosto de 2012) |
| HeartMate XVE | Thoratec | Pulsátil | Aprobación de la FDA para BTT en 2001 y DT en 2003. Marca CE autorizada. Rara vez se usa más debido a problemas de confiabilidad. |
| HeartMate II | Thoratec | Cojinetes de bolas y de taza de flujo axial continuo impulsados por rotor. | Aprobado para su uso en América del Norte y la UE. Marca CE autorizada. Aprobación de la FDA para BTT en abril de 2008. Recientemente aprobada por la FDA en los EE. UU. Para terapia de destino (en enero de 2010). |
| HeartMate III | Thoratec | Flujo continuo impulsado por un rotor de flujo axial suspendido magnéticamente. | Los ensayos fundamentales para HeartMate III comenzaron en 2014 y cuentan con el apoyo de CarewMedicalWear . Aprobación de la FDA para BTT en 2017 |
| Incor | Corazón de Berlín | Flujo continuo impulsado por un rotor de flujo axial suspendido magnéticamente. | Aprobado para su uso en la Unión Europea. Se utiliza en aprobaciones humanitarias caso por caso en los EE. UU. Entró en ensayos clínicos en los EE. UU. En 2009. |
| Excor Pediátrico | Corazón de Berlín | Dispositivo de bomba de membrana externa diseñado para niños. | Aprobado para su uso en la Unión Europea. La FDA otorgó la exención de dispositivos humanitarios para EE. UU. En diciembre de 2011. |
| Jarvik 2000 | Corazón de Jarvik | Rotor axial de flujo continuo soportado por cojinetes cerámicos. | Actualmente se usa en los Estados Unidos como puente al trasplante de corazón bajo una investigación clínica aprobada por la FDA. En Europa, el Jarvik 2000 ha obtenido la certificación CE Mark tanto para el uso del puente al trasplante como de por vida. Actualmente se está desarrollando la versión infantil. |
| MicroMed DeBakey VAD | MicroMed | Flujo continuo impulsado por rotor axial apoyado sobre cojinetes cerámicos. | Aprobado para su uso en la Unión Europea. La versión infantil está aprobada por la FDA para su uso en niños en EE. UU. En proceso de ensayos clínicos en EE. UU. Para la aprobación de la FDA. |
| VentrAssist | Ventracor [60] | Flujo continuo impulsado por un rotor centrífugo suspendido hidrodinámicamente. | Aprobado para su uso en la Unión Europea y Australia. La empresa se declaró en quiebra mientras los ensayos clínicos para la aprobación de la FDA estaban en curso en 2009. La empresa ahora se disuelve y la propiedad intelectual se vende a Thoratec. |
| MTIHeartLVAD | www.mitiheart.com | Flujo continuo impulsado por un rotor centrífugo suspendido magnéticamente. | Actualmente en experimentación con animales, recientemente se completó con éxito un implante de ternero de 60 días. |
| C-Pulse (ahora "Aquadex") | Sunshine Heart (ahora "Soluciones CHF") | Pulsátil, impulsado por un manguito inflable alrededor de la aorta. | Actualmente disponible comercialmente |
| HVAD | HeartWare | Dispositivo en miniatura de "tercera generación" con paso de sangre centrífugo y rotor suspendido hidromagnéticamente que puede colocarse en el espacio pericárdico. | Obtuvo la marca CE para su distribución en Europa, enero de 2009. Obtuvo la aprobación de la FDA en EE. UU., Noviembre de 2012. Se inició el ensayo BTT en EE. UU. En octubre de 2008 (completado en febrero de 2010) y el ensayo con DT en EE. UU. En agosto de 2010 (inscripción completada en mayo de 2012). Aprobación de la FDA para BTT en 2012 y DT en 2017. |
| MVAD | HeartWare | La bomba MVAD de HeartWare es un dispositivo de asistencia ventricular en miniatura en etapa de desarrollo, aproximadamente un tercio del tamaño de la bomba HVAD de HeartWare. | HeartWare Completed GLP Studies (septiembre de 2011). |
| DuraHeart | Terumo | Bomba centrífuga de levitación magnética. | Aprobado por la CE, ensayos de la FDA de EE. UU. En curso en enero de 2010. |
| Thoratec PVAD (dispositivo de asistencia ventricular paracorpórea) | Thoratec | El sistema pulsátil incluye tres componentes principales: bomba de sangre, cánulas y controlador neumático (consola de doble transmisión o controlador VAD portátil). | Marca CE autorizada. Recibió la aprobación de la FDA para BTT en 1995 y para la recuperación posterior a la cardiotomía (cirugía a corazón abierto) en 1998. |
| IVAD: dispositivo implantable de asistencia ventricular | Thoratec | El sistema pulsátil incluye tres componentes principales: bomba de sangre, cánulas y controlador neumático (consola de doble transmisión o controlador VAD portátil). | Marca CE autorizada. Recibió la aprobación de la FDA para BTT en 2004. Autorizado solo para implantes internos, no para implantes paracorpóreos debido a problemas de confiabilidad. |
| FiVAD | Levítico Cardio | Sistema inalámbrico versátil para LVAD. Permita 6 horas de libertad a los pacientes. | Dispositivo de investigación, ensayo de 2 pacientes realizado en diciembre de 2018 con Jarvik 2000 LVAD en Astana por el profesor Pya. [34] |
Ver también [ editar ]
- Bomba de balón intraaórtica
Referencias [ editar ]
- ^ a b Birks, EJ; Tansley, PD; Hardy, J; et al. (2006). "Dispositivo de asistencia ventricular izquierda y farmacoterapia para la reversión de la insuficiencia cardíaca". Revista de Medicina de Nueva Inglaterra . 355 (18): 1873–1884. doi : 10.1056 / NEJMoa053063 . PMID 17079761 .
- ^ a b "Primera recuperación cardíaca de VentrAssist en la televisión nacional" . Ventracor.com . 19 de octubre de 2006.
- ^ Fajdek, B; Krzysztof, J (2 a 5 de septiembre de 2014). "Sistema de control automático para dispositivo de asistencia ventricular". XIX Conferencia Internacional sobre Métodos y Modelos en Automatización y Robótica (MMAR) : 874–879. doi : 10.1109 / MMAR.2014.6957472 . ISBN 978-1-4799-5081-2. S2CID 13070912 .
- ^ Schulman, AR; Martens, TP; Christos, PJ; et al. (2007). "Comparaciones de las complicaciones de la infección entre los dispositivos de asistencia ventricular izquierda de flujo continuo y de flujo pulsátil". La Revista de Cirugía Torácica y Cardiovascular . 133 (3): 841–842. doi : 10.1016 / j.jtcvs.2006.09.083 . PMID 17320612 .
- ^ "El panel A muestra un flujo pulsátil de primera generación a la izquierda ve - Open-i" . openi.nlm.nih.gov . Consultado el 23 de abril de 2018 .
- ^ "Página 404 no encontrada" . ResearchGate . Consultado el 23 de abril de 2018 . Citar utiliza un título genérico ( ayuda )
- ^ "Componentes de la bomba pulsátil SynCardia TAH" (PDF) . syncardia.com . Consultado el 23 de abril de 2018 .
- ^ "El HeartMate XVE también tiene una línea de ventilación, a pesar de que funciona con baterías" (PDF) . aldmd.com . Consultado el 23 de abril de 2018 .
- ^ Masacre, MS; Pagani, FD; Rogers, JG; et al. (2010). "Manejo clínico de dispositivos de asistencia ventricular izquierda de flujo continuo en insuficiencia cardíaca avanzada". The Journal of Heart and Lung Transplantation . 29 (4): S1–39. doi : 10.1016 / j.healun.2010.01.011 . PMID 20181499 .
- ^ Fukamachi, Kiyo; Smedira, Nicholas (agosto de 2005). "LVADs más pequeños, más seguros y totalmente implantables: ¿realidad o fantasía?". Revista actual del American College of Cardiology . 14 (8): 40–42. doi : 10.1016 / j.accreview.2005.06.001 .
- ^ Inteligente, Frank. "Bomba cardíaca de levitación magnética implantada en el primer paciente estadounidense" . "Cardiología hoy". Octubre de 2008.
- ^ Pai, CN; Shinshi, T; Asama, J; et al. (2008). "Desarrollo de una bomba de sangre centrífuga de maglev compacta encerrada en una carcasa de titanio" . Revista de diseño, sistemas y fabricación mecánicos avanzados . 2 (3): 343–355. doi : 10.1299 / jamdsm.2.343 .
- ^ Hoshi, H; Shinshi, T; Takatani, S (2006). "Bombas de sangre de tercera generación con cojinetes magnéticos mecánicos sin contacto". Órganos artificiales . 30 (5): 324–338. doi : 10.1111 / j.1525-1594.2006.00222.x . PMID 16683949 .
- ^ "Dr. Denton Cooley y Dr. Michael E. DeBakey: estrellas de rock de la medicina de Houston" . Houston Chronicle . 3 de abril de 2014.
- ^ Kirklin, JK; Naftel, DC (septiembre de 2008). "Soporte circulatorio mecánico: registro de una terapia en evolución" . Circulación: insuficiencia cardíaca . 1 (3): 200–5. doi : 10.1161 / circheartfailure.108.782599 . PMC 3437761 . PMID 19808290 .
- ^ "Se anuncia el progreso de la bomba de corazón: un paso prometedor en la tecnología del corazón artificial". Children's Today (marzo): 1,5. 19 de marzo de 1988.
- ^ Corazón eléctrico . PBS.
- ^ Dan Baum. "Sin pulso: cómo los médicos reinventaron el corazón humano" . Ciencia popular. 2012.
- ^ "Preguntas frecuentes sobre VAD" . Centro médico de la Universidad de Columbia. cita: "Un paciente al que se le implanta un HeartMate II normalmente tiene el pulso amortiguado". Consultado el 27 de agosto de 2016.
- ^ "El primer paciente de uso de por vida" . Jarvik Heart. Archivado desde el original el 21 de noviembre de 2010.
- ^ El paciente establece un récord mundial por vivir con un dispositivo de asistencia cardíaca . Instituto del Corazón de Texas. 6 de julio de 2007.
- ^ Maugh, Thomas (14 de julio de 2009). "El trasplante muestra la capacidad reparadora del corazón" . Los Angeles Times .
- ^ Pagani, FD; Miller, LW; Russell, SD; et al. (2009). "Soporte circulatorio mecánico extendido con un dispositivo de asistencia ventricular izquierda giratoria de flujo continuo" . Revista del Colegio Americano de Cardiología . 54 (4): 312–321. doi : 10.1016 / j.jacc.2009.03.055 . PMID 19608028 .
- ^ "Los cirujanos cardíacos de Heidelberg implantan el primer nuevo dispositivo de asistencia cardíaca DeBakey del mundo" . Ciencias . 17 de agosto de 2009. Archivado desde el original el 18 de julio de 2011.
- ^ Quinn, Dale (4 de agosto de 2009). "Estudio VA: parche curativo del corazón" . Arizona Daily Star . Archivado desde el original el 7 de agosto de 2009.
- ^ "Un estudio de Anginera en pacientes sometidos a cirugía de injerto de derivación de arteria coronaria (CABG)" . ClinicalTrials.gov . Institutos Nacionales de Salud de EE. UU. 27 de marzo de 2009 . Consultado el 15 de septiembre de 2009 .
- ^ Hunter, Tim (13 de septiembre de 2009). "Conoce al hombre biónico Kiwi" . Estándar Manawatu .
- ^ "Subvención de $ 2,8 millones renovada para el desarrollo de un corazón artificial total" sin pulso "" . BusinessWire . 6 de agosto de 2009.
- ^ "Evaluación del sistema LVAD HeartWare para el tratamiento de la insuficiencia cardíaca avanzada" . Centro médico Johns Hopkins . Mayo de 2009.
- ^ "HeartWare International supera los 50 implantes en los Estados Unidos" . Biomedicina . 20 de agosto de 2009.
- ^ "Thoratec anuncia el primer implante humano HeartMate III y el inicio de la prueba de la marca CE" . Thoratec Corporation. 20 de agosto de 2009. Archivado desde el original el 7 de octubre de 2014.
- ↑ Canseco, Diana C .; Kimura, Wataru; Garg, Sonia; Mukherjee, Shibani; Bhattacharya, Souparno; Abdisalaam, Salim; Das, Sandeep; Asaithamby, Aroumougame; Mammen, Pradeep PA; Sadek, Hesham A. (2015). "Descarga ventricular humana induce la proliferación de cardiomiocitos" . Revista del Colegio Americano de Cardiología . 65 (9): 892–900. doi : 10.1016 / j.jacc.2014.12.027 . PMC 4488905 . PMID 25618530 .
- ^ "Desgaste de LVAD" . www.carewmedicalwear.com .
- ^ a b "Primer uso humano de una transferencia de energía coplanar inalámbrica junto con un dispositivo de asistencia ventricular izquierda de flujo continuo" . Trasplante de corazón y pulmón. 4 de febrero de 2019.
- ^ Bogaev, R; Chen, L; Russell, SD; et al. (2007). "Aspectos médicos de la insuficiencia cardíaca en etapa terminal: trasplantes y terapias de dispositivos I, Resumen 1762: una opción emergente para mujeres con insuficiencia cardíaca avanzada: resultados del puente de dispositivo de asistencia ventricular izquierda de flujo continuo HeartMate II al ensayo de trasplante" . Circulación . II. Asociación Americana del Corazón. 116 : 372. Archivado desde el original el 8 de junio de 2011.
- ^ https://www.thoratec.com/medical-professionals/vad-product-information/heartmate3/HeartMate3_PressKit-UK.pdf
- ^ Popov, AF; Hosseini, MT; Zych, B; et al. (2012). "Implantación de dispositivo de asistencia ventricular izquierda HeartWare mediante toracotomía anterior bilateral". Los anales de la cirugía torácica . 93 (2): 674–676. doi : 10.1016 / j.athoracsur.2011.09.055 . PMID 22269746 .
- ^ Benton, Susan (19 de agosto de 2008). "Hoja de datos del ensayo clínico fundamental HeartMate II" (PDF) . Thoratec Corporation . Consultado el 10 de septiembre de 2009 .
- ^ Dewey, Todd (19 de agosto de 2008). "El ensayo fundamental HeartMate II LVAS" . Instituto de Ciencia y Tecnología de la Investigación Cardiopulmonar. Archivado desde el original el 13 de julio de 2007.
- ^ Mager, Belinda (25 de abril de 2008). "La FDA aprueba la bomba cardíaca mecánica HeartMate II para pacientes con insuficiencia cardíaca que esperan un trasplante de órganos" . NewYork – Presbyterian Hospital . Archivado desde el original el 8 de mayo de 2008.
- ^ Miller, LW; Pagani, FD; Russell, SD; et al. (2007). "Uso de un dispositivo de flujo continuo en pacientes en espera de trasplante cardíaco". Revista de Medicina de Nueva Inglaterra . 357 (9): 885–896. doi : 10.1056 / NEJMoa067758 . PMID 17761592 .
- ^ Gavin, Kara (23 de abril de 2008). "Tiempos emocionantes para los dispositivos de asistencia cardíaca en la UM" . Sistema de Salud de la Universidad de Michigan. Archivado desde el original el 10 de mayo de 2008.
- ^ "Thoratec HeartMate II LVAS - P060040" . Administración de Alimentos y Medicamentos . 23 de abril de 2008 . Consultado el 28 de agosto de 2009 .
- ^ Eisen, HJ; Hankins, SR (2009). "Dispositivo de asistencia ventricular izquierda rotatoria de flujo continuo" . Revista del Colegio Americano de Cardiología . 54 (4): 322–324. doi : 10.1016 / j.jacc.2009.04.028 . PMID 19608029 .
- ^ Starling, RC; Naka, Y; Boyle, AJ; et al. (Agosto de 2009). "Resultados del registro INTERMACS del estudio posterior a la aprobación inicial de la FDA con un dispositivo de asistencia ventricular izquierda de flujo continuo como puente al trasplante de corazón". Revista de insuficiencia cardíaca . 15 (6): S46. doi : 10.1016 / j.cardfail.2009.06.252 .
- ^ Miller, Leslie; Aaronson y Pagani (2008). "Estudio de protocolo de recuperación de Harefield para pacientes con insuficiencia cardíaca crónica refractaria (HARPS)" . ClinicalTrials.gov . Consultado el 3 de agosto de 2009 .
- ^ Rose, EA; Moskowitz, AJ; Packer, M; et al. (1999). "El ensayo REMATCH: justificación, diseño y criterios de valoración. Evaluación aleatoria de la asistencia mecánica para el tratamiento de la insuficiencia cardíaca congestiva". Los anales de la cirugía torácica . 67 (3): 723–730. doi : 10.1016 / S0003-4975 (99) 00042-9 . PMID 10215217 .
- ^ Rogers, JG; Butler, J; Lansman, SL; et al. (2007). "Soporte circulatorio mecánico crónico para pacientes con insuficiencia cardíaca dependiente de inótropos que no son candidatos a trasplante". Revista del Colegio Americano de Cardiología . 50 (8): 741–747. doi : 10.1016 / j.jacc.2007.03.063 . PMID 17707178 .
- ^ a b Schaffer, JM; Arnaoutakis, GJ; Allen, JG; et al. (2011). "Complicaciones hemorrágicas y utilización de productos sanguíneos con implante de dispositivo de asistencia ventricular izquierda". Los anales de la cirugía torácica . 91 (3): 740–749. doi : 10.1016 / j.athoracsur.2010.11.007 . PMID 21352991 .
- ^ a b Goldstein, Daniel J .; Robert B. Beauford (2003). "Dispositivos de asistencia ventricular izquierda y sangrado: agregando insulto a la lesión". Los anales de la cirugía torácica . 75 (6): S42-7. doi : 10.1016 / s0003-4975 (03) 00478-8 . PMID 12820734 .
- ^ Spanier, Talia; Oz, M; Levin, H; et al. (1996). "Activación de vías de coagulación y fibrinolíticas con dispositivos de asistencia del ventrículo izquierdo". Revista de Cirugía Torácica y Cardiovascular . 112 (4): 1090–1097. doi : 10.1016 / s0022-5223 (96) 70111-3 . PMID 8873737 .
- ^ Samuels, LE; Kohout, J; Casanova-Ghosh, E; et al. (2008). "Argatroban como anticoagulante postoperatorio primario o secundario en pacientes implantados con dispositivos de asistencia ventricular". Los anales de la cirugía torácica . 85 (5): 1651-1655. doi : 10.1016 / j.athoracsur.2008.01.100 . PMID 18442558 .
- ^ Castagna, Francesco; Stöhr, Eric J .; Pinsino, Alberto; Cockcroft, John R .; Willey, Joshua; Reshad Garan, A .; Topkara, Veli K .; Colombo, Paolo C .; Yuzefpolskaya, Melana; McDonnell, Barry J. (2017). "La presión arterial única y la pulsatilidad de los pacientes con DAVI: desafíos actuales y oportunidades futuras" . Informes actuales de hipertensión . 19 (10): 85. doi : 10.1007 / s11906-017-0782-6 . ISSN 1522-6417 . PMC 5645430 . PMID 29043581 .
- ^ Gordon, RJ; Quagliarello, B; Lowy, FD (2006). "Infecciones relacionadas con el dispositivo de asistencia ventricular". Las enfermedades infecciosas de Lancet . 6 (7): 426–37. doi : 10.1016 / S1473-3099 (06) 70522-9 . PMID 16790383 .
- ^ Holman, WL; Rayburn, BK; McGiffin, DC; et al. (2003). "Infección en dispositivos de asistencia ventricular: prevención y tratamiento". Los anales de la cirugía torácica . 75 (Suplemento 6): S48 – S57. doi : 10.1016 / S0003-4975 (03) 00479-X . PMID 12820735 .
- ^ Marcuccilli, L; Casida, J; Peters, RM (2013). "Modificación del autoconcepto en pacientes con dispositivo de asistencia ventricular izquierda: una exploración inicial" (PDF) . Revista de Enfermería Clínica . 22 (2456–64): 2456–64. doi : 10.1111 / j.1365-2702.2012.04332.x . hdl : 2027,42 / 99069 . PMID 23506318 .
- ^ Mcillvennan, CK; Allen, LA; Nowels, C; Brieke, A; Cleveland, JC; Matlock, DD (2014). "Toma de decisiones para los dispositivos de asistencia ventricular izquierda de terapia de destino:" no había otra opción "versus" lo pensé muchísimo " " . Circulación: calidad cardiovascular y resultados . 7 (3): 374–80. doi : 10.1161 / CIRCOUTCOMES.113.000729 . PMC 4081474 . PMID 24823949 .
- ^ Iacovetto, MC; Matlock, DD; Mcillvennan, CK; et al. (2014). "Recursos educativos para pacientes que están considerando un dispositivo de asistencia ventricular izquierda: una revisión transversal de materiales de Internet, impresos y multimedia" . Circulación: calidad cardiovascular y resultados . 7 (6): 905-11. doi : 10.1161 / CIRCOUTCOMES.114.000892 . PMID 25316772 .
- ^ Matlock, DD; Allen, LA; Thompson, JS; Mcilvennan, CK (31 de julio de 2014). "Una ayuda de decisión para el dispositivo de asistencia ventricular izquierda (DAVI) para la terapia de destino Un dispositivo para pacientes con insuficiencia cardíaca avanzada" (PDF) . Facultad de Medicina de la Universidad de Colorado.
- ^ Ventracor se puso en liquidación el 3 de julio de 2009, por lo que los activos de la empresa, incluida su propiedad intelectual, datos de ensayos clínicos, plantas y equipos y activos residuales, se pondrán a la venta Boyd, Tony (13 de julio de 2009). "Sin corazón" . Espectador de negocios . Consultado el 15 de septiembre de 2009 .
Enlaces externos [ editar ]
- MyLVAD.com: sitio sin marca con información sobre varios LVAD