Alfa-glucosidasa
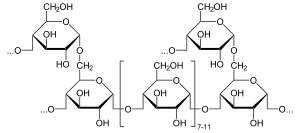
Alfa-glucosidasa ( EC 3.2.1.20 , maltasa , glucoinvertasa , glucosidosucrasa , maltasa-glucoamilasa , alfa-glucopiranosidasa , glucosidoinvertasa , alfa-D-glucosidasa , alfa-glucósido hidrolasa , alfa-1,4-glucosidasa , alfa-D-glucósido glucohidrolasa ) es una glucosidasa ubicada en el borde en cepillo del intestino delgado que actúa sobre los enlaces α(1→4). [1] [2] [3] [4] [5] [6] Esto contrasta conbeta-glucosidasa . La alfa-glucosidasa descompone el almidón y los disacáridos en glucosa. La maltasa , una enzima similar que escinde la maltosa , es casi funcionalmente equivalente.
La alfa-glucosidasa hidroliza los residuos de alfa-glucosa enlazados no reductores (1→4) terminales para liberar una sola molécula de alfa-glucosa. [7] La alfa-glucosidasa es una hidrolasa de carbohidratos que libera alfa-glucosa en lugar de beta-glucosa. Los residuos de beta-glucosa pueden ser liberados por la glucoamilasa, una enzima funcionalmente similar. La selectividad de sustrato de la alfa-glucosidasa se debe a las afinidades de subsitio del sitio activo de la enzima. [8] Dos mecanismos propuestos incluyen un desplazamiento nucleofílico y un ion oxocarbenio intermedio. [8]
Las alfa-glucosidasas se pueden dividir, según su estructura primaria, en dos familias. [8] El gen que codifica para la alfa-glucosidasa lisosomal humana tiene una longitud de aproximadamente 20 kb y su estructura ha sido clonada y confirmada. [12]