 | |
 | |
| Nombres | |
|---|---|
| Nombre IUPAC trisulfuro de diantimonio, sulfuro de antimonio (III) | |
| Otros nombres sulfuro de antimonio, sulfuro de antimonio, sesquisulfuro de antimonio, bermellón de antimonio, antimonio negro, sulfureto de antimonio | |
| Identificadores | |
| |
Modelo 3D ( JSmol ) | |
| ChemSpider | |
| Tarjeta de información ECHA | 100.014.285 |
PubChem CID | |
| UNII | |
Tablero CompTox ( EPA ) | |
| |
| |
| Propiedades | |
| Sb 2 S 3 | |
| Masa molar | 339.715 |
| Apariencia | cristal ortorrómbico gris / negro (estibina) |
| Densidad | 4,562 g cm −3 (estibina) [1] |
| Punto de fusion | 550 ° C (1022 ° F; 823 K) (estibina) [1] |
| Punto de ebullición | 1.150 ° C (2.100 ° F; 1.420 K) |
| 0,00017 g / 100 mL (18 ° C) | |
| -86,0 · 10 −6 cm 3 / mol | |
Índice de refracción ( n D ) | 4.046 |
| Termoquímica | |
Capacidad calorífica ( C ) | 123,32 J / K mol |
| -157,8 kJ / mol | |
| Peligros | |
| NFPA 704 (diamante de fuego) | |
| Dosis o concentración letal (LD, LC): | |
LD 50 ( dosis mediana ) | > 2000 mg / kg (rata, oral) |
| NIOSH (límites de exposición a la salud de EE. UU.): | |
PEL (permitido) | TWA 0,5 mg / m 3 (como Sb) [2] |
REL (recomendado) | TWA 0,5 mg / m 3 (como Sb) [2] |
Salvo que se indique lo contrario, los datos se proporcionan para materiales en su estado estándar (a 25 ° C [77 ° F], 100 kPa). | |
| Referencias de Infobox | |
El trisulfuro de antimonio (Sb 2 S 3 ) se encuentra en la naturaleza como el mineral cristalino estibina y el mineral rojo amorfo (en realidad un mineraloide) [3] metastibnita . [4] Está fabricado para su uso en fósforos de seguridad , munición militar, explosivos y fuegos artificiales. También se utiliza en la producción de vidrio de color rubí y en plásticos como retardante de llama. [5] Históricamente, la forma de estibita se utilizó como pigmento gris en pinturas producidas en el siglo XVI. [6] Es un semiconductor con una banda prohibida directa de 1.8-2.5 eV. [ cita requerida ]Con el dopaje adecuado, se pueden producir materiales de tipo pyn. [7]
Preparación y reacciones [ editar ]
Sb 2 S 3 se puede preparar a partir de los elementos a una temperatura de 500 a 900 ° C: [5]
- 2 Sb + 3 S → Sb 2 S 3
El Sb 2 S 3 se precipita cuando se hace pasar H 2 S a través de una solución acidificada de Sb (III). [8] Esta reacción se ha utilizado como método gravimétrico para determinar el antimonio, burbujeando H 2 S a través de una solución de compuesto Sb (III) en HCl caliente, se deposita una forma naranja de Sb 2 S 3 que se vuelve negra en las condiciones de reacción. [9]
El Sb 2 S 3 se oxida fácilmente, reaccionando vigorosamente con agentes oxidantes. [5] Arde en el aire con una llama azul. Reacciona con incandescencia con cloratos de cadmio, magnesio y zinc. Las mezclas de Sb 2 S 3 y cloratos pueden explotar. [10]
En la extracción de antimonio de minerales de antimonio se emplea el proceso de sulfuro alcalino en el que Sb 2 S 3 reacciona para formar sales de tioantimoniato (III) (también llamadas tioantimonita): [11]
- 3 Na 2 S + Sb 2 S 3 → 2 Na 3 SbS 3
Se pueden preparar varias sales que contienen diferentes iones tioantimoniato (III) a partir de Sb 2 S 3, entre las que se incluyen: [12]
- [SbS 3 ] 3− , [SbS 2 ] - , [Sb 2 S 5 ] 4− , [Sb 4 S 9 ] 6− , [Sb 4 S 7 ] 2− y [Sb 8 S 17 ] 10−
" Sal de Schlippe ", Na 3 SbS 4 · 9H 2 O, se forma una sal de tioantimoniato (V) cuando Sb 2 S 3 se hierve con azufre e hidróxido de sodio. La reacción se puede representar como: [8]
- Sb 2 S 3 + 3 S 2− + 2 S → 2 [SbS 4 ] 3−
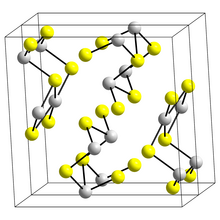
Estructura [ editar ]
La estructura de la forma negra en forma de aguja de Sb 2 S 3 , estibina , consta de cintas enlazadas en las que los átomos de antimonio se encuentran en dos entornos de coordinación diferentes, piramidal trigonal y piramidal cuadrada. [8] Cintas similares ocurren en Bi 2 S 3 y Sb 2 Se 3 . [13] La forma roja, metastibnita, es amorfa. Un trabajo reciente sugiere que hay una serie de estructuras de estibina dependientes de la temperatura estrechamente relacionadas que se han denominado estibina (I) la forma de alta temperatura, identificada previamente, estibina (II) y estibina (III). [14]Otro artículo muestra que los poliedros de coordinación reales del antimonio son de hecho SbS 7 , con coordinación (3 + 4) en el sitio M1 y (5 + 2) en el sitio M2. Estas coordinaciones consideran la presencia de vínculos secundarios. Algunas de las uniones secundarias imparten cohesión y están conectadas con la empaquetadura. [15]
Referencias [ editar ]
- ↑ a b Haynes, WM, ed. (2014). Manual CRC de Química y Física (95ª ed.). Boca Raton, FL: CRC Press. págs. 4-48. ISBN 978-1-4822-0867-2.
- ^ a b Guía de bolsillo de NIOSH sobre peligros químicos. "# 0036" . Instituto Nacional de Seguridad y Salud Ocupacional (NIOSH).
- ^ https://www.mindat.org/min-2686.html
- ^ SUPERGENE METASTIBNITA DE MINA ALACRAN, PAMPA LARGA, COPIAPO, CHILE, Alan H Clark, EL MINERALOGISTA AMERICANO. VOL. 55., 1970
- ↑ a b c Greenwood, Norman N .; Earnshaw, Alan (1997). Química de los Elementos (2ª ed.). Butterworth-Heinemann . págs. 581–582. ISBN 978-0-08-037941-8.
- ^ Eastaugh, Nicholas (2004). Compendio de pigmentos: un diccionario de pigmentos históricos . Butterworth-Heinemann . pag. 359. ISBN 978-0-7506-5749-5.
- ^ Electroquímica de calcogenuros metálicos, Mirtat Bouroushian, Springer, 2010
- ↑ a b c Holleman, Arnold Frederik; Wiberg, Egon (2001), Wiberg, Nils (ed.), Inorganic Chemistry , traducido por Eagleson, Mary; Brewer, William, San Diego / Berlín: Academic Press / De Gruyter, p. 765-766, ISBN 0-12-352651-5
- ^ AI Vogel, (1951), Análisis inorgánico cuantitativo, (2a edición), Longmans Green and Co
- ^ Guía de eliminación de sustancias químicas de laboratorio peligrosas, tercera edición, CRC Press, 2003, Margaret-Ann Armor , ISBN 9781566705677
- ^ Anderson, Corby G. (2012). "La metalurgia del antimonio". Chemie der Erde - Geoquímica . 72 : 3-8. doi : 10.1016 / j.chemer.2012.04.001 . ISSN 0009-2819 .
- ^ Reacciones y métodos inorgánicos, La formación de enlaces a elementos del grupo VIB (O, S, Se, Te, Po) (Parte 1) (Volumen 5) Ed. AP, Hagen, 1991, Wiley-VCH, ISBN 0-471-18658-9
- ^ Wells AF (1984) Química inorgánica estructural 5ta edición Publicaciones de ciencia de Oxford ISBN 0-19-855370-6
- ↑ Kuze S., Du Boulay D., Ishizawa N., Saiki A, Pring A .; (2004), evidencia de difracción de rayos X para una forma monoclínica de estibina, Sb2S3, por debajo de 290K; Mineralogista estadounidense, 9 (89), 1022-1025.
- ^ Kyono, A .; Kimata, M .; Matsuhisa, M .; Miyashita, Y .; Okamoto, K. (2002). "Estructuras cristalinas de baja temperatura de estibina que implican superposición orbital de electrones de par inerte Sb 5s 2". Física y Química de Minerales . 29 (4): 254–260. doi : 10.1007 / s00269-001-0227-1 .
