 | |
| Nombres | |
|---|---|
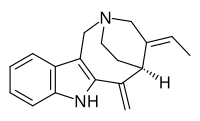
| Nombre IUPAC (2 R , 4 E , 5 S ) -4-Etiliden-6-metiliden-1,3,4,5,6,7-hexahidro-2,5-etanoazocino [4,3- b ] indol | |
| Identificadores | |
Modelo 3D ( JSmol ) | |
| 3DMet | |
| CHEBI | |
| CHEMBL | |
| ChemSpider | |
| KEGG | |
PubChem CID | |
| |
| |
| Propiedades | |
| C 18 H 20 N 2 | |
| Masa molar | 264,372 g · mol −1 |
| Densidad | 0,945875 |
| log P | 3.404 |
| Acidez (p K a ) | 8,37 |
Índice de refracción ( n D ) | 1.665 |
| 0.552121 | |
Salvo que se indique lo contrario, los datos se proporcionan para materiales en su estado estándar (a 25 ° C [77 ° F], 100 kPa). | |
| Referencias de Infobox | |
Apparicine es un alcaloide indol monoterpenoide . [1] Lleva el nombre de Apparicio Duarte, un botánico brasileño que estudió la especie Aspidosperma de la que se aisló por primera vez el aparato. [2] [3] Fue el primer miembro del grupo de alcaloides vallesamina en ser aislado y tener su estructura establecida, [3] que se publicó por primera vez en 1965. [4] También ha sido conocido por los sinónimos gomezine , pericalline y tabernoschizina . [5]
Bioquímica [ editar ]
El alcaloide se ha aislado de siete especies de Aspidosperma . [6] Es el principal alcaloide que se encuentra en el callo de Tabernaemontana elegans , y también se ha identificado en otras especies de Tabernaemontana , como T. africana , T. divaricata , T. orientalis y T. pachysiphon . [7] [8] En estudios de T. pachysiphon , se encontró que el contenido de alcaloides, incluido el de apparicina, era mayor en hojas jóvenes y hojas que recibían mayor sombra, y variaba con la edad de la hoja, la edad de la planta y la procedencia. [9]
La investigación sobre Aspidosperma pyricollum ha llevado al descubrimiento de que la aparicina se biosintetiza a partir del triptófano por "pérdida de C-2 y retención de C-3". [10] La biosíntesis de apparicina requiere la alteración de la cadena lateral de triptamina habitual con pérdida de C-1. [1]
Determinación de estructura [ editar ]
Su estructura se estableció mediante los métodos de descomposición química y el campo naciente de desacoplamiento de resonancia magnética nuclear (RMN) utilizando el isótopo 1 H del hidrógeno. [11] La espectroscopía ultravioleta-visible mostró que la apparicina tiene una absorción de UV similar a la uleína , [12] y se encontró que sus cromóforos eran idénticos. [11]
Los experimentos de desacoplamiento de RMN revelaron que la aparicina carece de una señal de N -metilo y tiene un átomo de carbono metilénico entre el átomo de nitrógeno y los anillos de indol , lo que permite a los investigadores distinguirla de la uleína. [12] Este fue un notable uso temprano del desacoplamiento de RMN para determinar una estructura química. [12] Se encontró que su esqueleto de carbono estaba relacionado pero era diferente al de la uleína, y las estructuras de vallesamina y O-acetil-vallesamina estaban relacionadas con la aparicina. [13]
La deshidrogenación de apparicina seguida de oxidación con permanganato permitió la ubicación de los dos sustituyentes de carbono del anillo de piperidina . [14]
Aplicaciones [ editar ]
Apparicine puede tener varias aplicaciones potenciales. En cultivos celulares , ha mostrado citotoxicidad frente a la línea celular de leucemia linfocítica experimental P388 . [15] Exhibe una fuerte actividad contra el poliovirus tipo 3 (PV3), [15] y tiene una actividad de moderada a fuerte contra algunos patógenos humanos . [16] También es activo en los receptores de opioides [15] y tiene afinidad micromolar por los receptores de adenosina . [17] Apparicine tiene propiedades analgésicas locales . [dieciséis]
Notas [ editar ]
- ↑ a b Herbert 1983 , p. 13.
- ^ Elia 2008 , p. 594.
- ↑ a b Joule 1983 , p. 286.
- ^ Joule y col. 1965 , pág. 4773.
- ^ Gilbert 1968 , p. 273.
- ^ Monteiro 1966 , p. 39.
- ^ Verpoorte y col. 1989 , pág. 139.
- ^ Elia 2008 , p. 593.
- ^ Elia 2008 , p. 596.
- ^ Shamma 1970 , p. 324.
- ^ a b Joule y col. 1980 , pág. 230.
- ↑ a b c Joule 1983 , p. 287.
- ↑ Biemann , 1966 , p. 40.
- ^ Joule 1983 , p. 288.
- ↑ a b c Schmelzer , 2008 , p. 592.
- ↑ a b Mairura y Schmelzer , 2008 , p. 590.
- ^ Ingkaninan y col. 1999 , pág. 1441.
Referencias [ editar ]
- Biemann, Klaus (1966). "Espectrometría de masas de productos naturales seleccionados". En Zechmeister, L. (ed.). Fortschritte der Chemie organischer Naturstoffe / Progresos en la química de los productos naturales orgánicos / Progrès dans la chimie des essence organiques naturelles . 24 . Springer-Verlag . págs. 1-98. doi : 10.1007 / 978-3-7091-8143-0_1 . ISBN 978-3-7091-8145-4. PMID 5958065 .
- Elia, J. (2008). "Tabernaemontana pachysiphon Stapf". En Schmelzer, GH; Gurib-Fakim, A. (eds.). Plantas medicinales 1 . Recursos vegetales de África tropical . 11 . Fundación PROTA; Editores Backhuys; CTA . págs. 593–596. ISBN 978-90-5782-204-9.
- Gilbert, B. (1968). "Los alcaloides de Aspidosperma , Ochrosia , Pleiocarpa , Melodinus y géneros relacionados". En Manske, RHF (ed.). Los alcaloides: química y fisiología . 11 . Prensa académica . págs. 205-306. doi : 10.1016 / S1876-0813 (08) 60121-9 . ISBN 978-0-12-469511-5.
- Herbert, Richard B. (1983). "Relaciones estructurales y biosintéticas". En Saxton, J. Edwin (ed.). Indoles: cuarta parte: los alcaloides de indol monoterpenoides . La química de los compuestos heterocíclicos. 25 . John Wiley e hijos . págs. 1-46 . doi : 10.1002 / 9780470186954.ch1 . ISBN 0-471-89748-5.
- Ingkaninan, K .; Ijzerman, AP; Taesotikul, T .; Verpoorte, R. (1999). "Aislamiento de compuestos opioides activos de hojas de Tabernaemontana pachysiphon ". Revista de Farmacia y Farmacología . 51 (12): 1441–1446. doi : 10.1211 / 0022357991777092 . PMID 10678501 .
- Joule, John A. (1983). "El grupo de uleína-elipticina-vallesamina". En Saxton, J. Edwin (ed.). Indoles: cuarta parte: los alcaloides de indol monoterpenoides . La química de los compuestos heterocíclicos. 25 . John Wiley e hijos. págs. 265-292 . doi : 10.1002 / 9780470186954.ch1 . ISBN 0-471-89748-5.
- Joule, JA; Allen, MS; Bishop, DI; Harris, M .; et al. (1980). "Aproximaciones a la síntesis de apparicine". En Phillipson, John David; Zenk, MH (eds.). Alcaloides indol y biogenéticamente relacionados . Actas anuales de la Sociedad Fitoquímica de Europa. 17 . Prensa académica. págs. 229–248. ISBN 0-12-554450-2.
- Joule, JA; Monteiro, H .; Durham, LJ; Gilbert, B .; et al. (1965). "Estudios de alcaloides. Parte XLVIII. La estructura de apparicine, un nuevo alcaloide de Aspidosperma". Revista de la Sociedad Química (4): 4773–4780. doi : 10.1039 / JR9650004773 . PMID 5891947 .
- Mairura, FS; Schmelzer, GH (2008). "Tabernaemontana crassa Benth.". En Schmelzer, GH; Gurib-Fakim, A. (eds.). Plantas medicinales 1 . Recursos vegetales de África tropical. 11 . Fundación PROTA; Editores Backhuys; CTA. págs. 589–592. ISBN 978-90-5782-204-9.
- Monteiro, Hugo Jorge (1966). Estudios sobre algunos alcaloides indólicos: la estructura de la vallesiachotamina. apparicina, un alcaloide indol de estructura novedosa. la estructura y química de la nervobscurina. tubulosina y su correlación química con desoxitubulosina, Partes 1-4 .
- Schmelzer, GH (2008). "Tabernaemontana elegans Stapf". En Schmelzer, GH; Gurib-Fakim, A. (eds.). Plantas medicinales 1 . Recursos vegetales de África tropical. 11 . Fundación PROTA; Editores Backhuys; CTA. págs. 592–593. ISBN 978-90-5782-204-9.
- Shamma, Maurice (1970). "Alcaloides". En Caín, Cornelius K .; et al. (eds.). Informes anuales de química medicinal, 1969 . Prensa académica. págs. 323–332. doi : 10.1016 / S0065-7743 (08) 60353-X . ISBN 978-0-12-040505-3.
- Verpoorte, R .; van der Heijden, R .; Schripsema, J .; Sierra, M .; et al. (1989). "Metabolitos secundarios en cultivos celulares de la especie Teabernaemontana ". En Kurz, Wolfgang GW (ed.). Metabolismo primario y secundario de cultivos de células vegetales II . Springer-Verlag. págs. 138-148. doi : 10.1007 / 978-3-642-74551-5_16 . ISBN 978-3-642-74553-9.
Enlaces externos [ editar ]
- (-) - Apparicine en la Agencia de Protección Ambiental de los Estados Unidos
- (-) - Apparicine en KNApSAck
- Pericalline en ChemIDplus