 | |||
| Nombres | |||
|---|---|---|---|
Otros nombres
| |||
| Identificadores | |||
Modelo 3D ( JSmol ) | |||
| 3DMet | |||
| 1900390 | |||
| CHEBI | |||
| CHEMBL | |||
| ChemSpider | |||
| Tarjeta de información ECHA | 100.004.271 | ||
| Número CE |
| ||
| Número e | E290 (conservantes) | ||
| 989 | |||
| KEGG | |||
| Malla | Carbono + dióxido | ||
PubChem CID | |||
| Número RTECS |
| ||
| UNII | |||
| un numero | 1013 (gas), 1845 (sólido) | ||
Tablero CompTox ( EPA ) | |||
| |||
| |||
| Propiedades | |||
| C O 2 | |||
| Masa molar | 44,009 g · mol −1 | ||
| Apariencia | Gas incoloro | ||
| Olor |
| ||
| Densidad |
| ||
| Punto de fusion | -56,6 ° C; -69,8 ° F; 216,6 K ( punto triple a 5,1 atm (0,52 MPa)) | ||
| Punto crítico ( T , P ) | 31,1 ° C (304,2 K), 7,38 MPa (72,8 atmósferas) | ||
Condiciones de sublimación | -78,5 ° C (-109,3 ° F); 194,7 K (1 atm (0,10 MPa)) | ||
solubilidad en agua | 1,45 g / L a 25 ° C (77 ° F), 100 kPa (0,99 atm) | ||
| Presión de vapor | 5,73 MPa (56,6 atmósferas) (20 ° C (293 K)) | ||
| Acidez (p K a ) | 6,35, 10,33 | ||
Susceptibilidad magnética (χ) | −20,5 · 10 −6 cm 3 / mol | ||
| Conductividad térmica | 0,01662 W · m −1 · K −1 (300 K (27 ° C; 80 ° F)) [2] | ||
Índice de refracción ( n D ) | 1.00045 | ||
| Viscosidad |
| ||
Momento bipolar | 0 D | ||
| Estructura | |||
Estructura cristalina | Trigonal | ||
Forma molecular | Lineal | ||
| Termoquímica | |||
Capacidad calorífica ( C ) | 37,135 J / K · mol | ||
Entropía molar estándar ( S | 214 J · mol −1 · K −1 | ||
Entalpía estándar de formación (Δ f H ⦵ 298 ) | −393,5 kJ · mol −1 | ||
| Farmacología | |||
Código ATC | V03AN02 ( OMS ) | ||
| Peligros | |||
| Ficha de datos de seguridad | Ver: página de datos Sigma-Aldrich | ||
| NFPA 704 (diamante de fuego) | [6] [7]  2 0 0 SA | ||
| Dosis o concentración letal (LD, LC): | |||
LC Lo ( más bajo publicado ) | 90.000 ppm (humano, 5 min) [5] | ||
| NIOSH (límites de exposición a la salud de EE. UU.): | |||
PEL (permitido) | TWA 5000 ppm (9000 mg / m 3 ) [4] | ||
REL (recomendado) | TWA 5000 ppm (9000 mg / m 3 ), ST 30,000 ppm (54,000 mg / m 3 ) [4] | ||
IDLH (peligro inmediato) | 40.000 ppm [4] | ||
| Compuestos relacionados | |||
Otros aniones |
| ||
Otros cationes |
| ||
Óxidos de carbono relacionados |
| ||
Compuestos relacionados |
| ||
| Página de datos complementarios | |||
Estructura y propiedades | Índice de refracción ( n ), constante dieléctrica (ε r ), etc. | ||
Datos termodinámicos | Comportamiento de fase sólido-líquido-gas | ||
Datos espectrales | UV , IR , RMN , MS | ||
Salvo que se indique lo contrario, los datos se proporcionan para materiales en su estado estándar (a 25 ° C [77 ° F], 100 kPa). | |||
| Referencias de Infobox | |||
Dióxido de carbono ( fórmula química CO
2) Es un incoloro ácida gas con una densidad de alrededor del 53% mayor que la del aire seco. Las moléculas de dióxido de carbono constan de un átomo de carbono con doble enlace covalente a dos átomos de oxígeno . Ocurre naturalmente en la atmósfera de la Tierra como un gas traza . La concentración actual es de aproximadamente 0,04% (412 ppm ) por volumen, habiendo aumentado desde los niveles preindustriales de 280 ppm. [8] Las fuentes naturales incluyen volcanes , fuentes termales y géiseres , y se libera de las rocas carbonatadas por disolución. en agua y ácidos. Debido a que el dióxido de carbono es soluble en agua, se encuentra naturalmente en aguas subterráneas , ríos y lagos , casquetes polares , glaciares y agua de mar . Está presente en depósitos de petróleo y gas natural . El dióxido de carbono tiene un olor fuerte y ácido y genera el sabor del agua con gas en la boca. [9] Sin embargo, a las concentraciones que se encuentran normalmente, es inodoro. [1]
Como fuente de carbono disponible en el ciclo del carbono , el dióxido de carbono atmosférico es la principal fuente de carbono para la vida en la Tierra y su concentración en la atmósfera preindustrial de la Tierra desde finales del Precámbrico ha sido regulada por organismos fotosintéticos y fenómenos geológicos. Las plantas , las algas y las cianobacterias utilizan la energía de la luz para fotosintetizar los carbohidratos a partir del dióxido de carbono y el agua, produciendo oxígeno como producto de desecho. [10]
El CO 2 es producido por todos los organismos aeróbicos cuando metabolizan compuestos orgánicos para producir energía mediante la respiración . [11] Se devuelve al agua a través de las branquias de los peces y al aire a través de los pulmones de los animales terrestres que respiran aire, incluidos los humanos. El dióxido de carbono se produce durante los procesos de descomposición de materiales orgánicos y la fermentación de azúcares en la elaboración del pan , la cerveza y el vino . Se produce por combustión de madera , turba y otros materiales orgánicos y combustibles fósiles comocarbón , petróleo y gas natural . Es un subproducto no deseado en muchos procesos de oxidación a gran escala , por ejemplo, en la producción de ácido acrílico (más de 5 millones de toneladas / año). [12] [13] [14]
Es un material industrial versátil, utilizado, por ejemplo, como gas inerte en soldadura y extintores , como gas presurizante en pistolas de aire y recuperación de aceite, como materia prima química y como fluido supercrítico solvente en descafeinado de café y secado supercrítico. . [15] Se agrega al agua potable y bebidas carbonatadas, incluida la cerveza y el vino espumoso, para agregar efervescencia . La forma sólida congelada del CO 2 , conocida como hielo seco, se utiliza como refrigerante y como abrasivo en la limpieza criogénica . Es una materia prima para la síntesis de combustibles y productos químicos. [dieciséis][17] [18] [19]
El dióxido de carbono es la larga vida significativa más gases de efecto invernadero en la atmósfera de la Tierra . Desde la Revolución Industrial, las emisiones antropogénicas, principalmente por el uso de combustibles fósiles y la deforestación , han aumentado rápidamente su concentración en la atmósfera, lo que ha provocado el calentamiento global . El dióxido de carbono también causa la acidificación de los océanos porque se disuelve en el agua para formar ácido carbónico . [20]
Historia
El dióxido de carbono fue el primer gas que se describió como una sustancia discreta. Aproximadamente en 1640, [21] el químico flamenco Jan Baptist van Helmont observó que cuando quemaba carbón vegetal en un recipiente cerrado, la masa de la ceniza resultante era mucho menor que la del carbón vegetal original. Su interpretación fue que el resto del carbón vegetal había sido transmutado en una sustancia invisible que él denominó "gas" o "espíritu salvaje" ( spiritus sylvestris ). [22]
Las propiedades del dióxido de carbono fueron estudiadas más a fondo en la década de 1750 por el médico escocés Joseph Black . Descubrió que la piedra caliza ( carbonato de calcio ) se podía calentar o tratar con ácidos para producir un gas que llamó "aire fijo". Observó que el aire fijo era más denso que el aire y no sostenía ni llamas ni vida animal. Black también descubrió que cuando se burbujeaba a través de agua de cal (una solución acuosa saturada de hidróxido de calcio ), precipitaba carbonato de calcio. Usó este fenómeno para ilustrar que el dióxido de carbono se produce por la respiración animal y la fermentación microbiana. En 1772, el químico inglésJoseph Priestley publicó un artículo titulado Impregnating Water with Fixed Air en el que describía un proceso de goteo de ácido sulfúrico (o aceite de vitriolo como lo conocía Priestley) sobre tiza para producir dióxido de carbono, y obligando al gas a disolverse agitando un recipiente. de agua en contacto con el gas. [23]
El dióxido de carbono fue licuado por primera vez (a presiones elevadas) en 1823 por Humphry Davy y Michael Faraday . [24] La primera descripción del dióxido de carbono sólido ( hielo seco ) fue dada por el inventor francés Adrien-Jean-Pierre Thilorier , quien en 1835 abrió un recipiente presurizado de dióxido de carbono líquido, solo para descubrir que el enfriamiento producido por la evaporación rápida del líquido producido una "nieve" de CO sólido 2 . [25] [26]
Propiedades fisicas y quimicas
Estructura y vinculación
La molécula de dióxido de carbono es lineal y centrosimétrica en equilibrio. La longitud del enlace carbono-oxígeno es 116,3 pm , notablemente más corta que la longitud del enlace de un enlace simple C – O e incluso más corta que la mayoría de los otros grupos funcionales con enlaces múltiples C – O. [27] Dado que es centrosimétrica, la molécula no tiene dipolo eléctrico .
Como molécula triatómica lineal, el CO 2 tiene cuatro modos vibracionales como se muestra en el diagrama. Sin embargo, el modo de estiramiento simétrico no crea un dipolo y, por lo tanto, no se observa en el espectro de infrarrojos. Los dos modos de flexión están degenerados, lo que significa que corresponden a una sola frecuencia. En consecuencia, solo se observan dos bandas vibratorias en el espectro IR : un modo de estiramiento antisimétrico en el número de onda 2349 cm -1 (longitud de onda 4,25 μm) y un par degenerado de modos de flexión en 667 cm -1 (longitud de onda 15 μm). También hay un modo de estiramiento simétrico a 1388 cm -1 que solo se observa en el espectro Raman . [28]
Como resultado de los dos modos de flexión, la molécula solo es estrictamente lineal cuando la cantidad de flexión es cero. Tanto la teoría [29] como los experimentos de imágenes de explosión de Coulomb [30] han demostrado que esto nunca es cierto para ambos modos a la vez. En una muestra de dióxido de carbono en fase gaseosa, ninguna de las moléculas es lineal como resultado de los movimientos vibratorios. Sin embargo, la geometría molecular todavía se describe como lineal, lo que describe las posiciones atómicas promedio correspondientes a la energía potencial mínima. Esto también es cierto para otras moléculas "lineales".
En solución acuosa
El dióxido de carbono es soluble en agua, en la que forma reversiblemente H
2CO
3( ácido carbónico ), que es un ácido débil ya que su ionización en agua es incompleta.
- CO
2+ H
2O ⇌ H
2CO
3
La constante de equilibrio de hidratación del ácido carbónico es (a 25 ° C). Por lo tanto, la mayor parte del dióxido de carbono no se convierte en ácido carbónico, sino que permanece como moléculas de CO 2 , sin afectar el pH.
Las concentraciones relativas de CO
2, H
2CO
3, y las formas desprotonadas HCO-
3( bicarbonato ) y CO2−
3( carbonato ) dependen del pH . Como se muestra en un gráfico de Bjerrum , en agua neutra o ligeramente alcalina (pH> 6,5), la forma de bicarbonato predomina (> 50%) convirtiéndose en la más prevalente (> 95%) al pH del agua de mar. En agua muy alcalina (pH> 10,4), la forma predominante (> 50%) es el carbonato. Los océanos, que son levemente alcalinos con un pH típico de 8,2 a 8,5, contienen alrededor de 120 mg de bicarbonato por litro.
Al ser diprótico , el ácido carbónico tiene dos constantes de disociación ácida , la primera para la disociación en el ion bicarbonato (también llamado hidrogenocarbonato) (HCO 3 - ):
- H 2 CO 3 ⇌ HCO 3 - + H +
- K a1 =2,5 x 10 −4 mol / L ; p K a1 = 3,6 a 25 ° C. [27]
Ésta es la verdadera primera constante de disociación ácida, definida como , donde el denominador incluye solo H 2 CO 3 unido covalentemente y no incluye CO 2 hidratado (aq). El valor mucho menor y frecuentemente cotizado cerca4.16 × 10 −7 es un valor aparente calculado sobre la suposición (incorrecta) de que todo el CO 2 disuelto está presente como ácido carbónico, de modo que . Dado que la mayor parte del CO 2 disuelto permanece como moléculas de CO 2 , K a1 (aparente) tiene un denominador mucho más grande y un valor mucho más pequeño que el verdadero K a1 . [31]
El ion bicarbonato es una especie anfótera que puede actuar como ácido o como base, dependiendo del pH de la solución. A pH alto , se disocia significativamente en el ion carbonato (CO 3 2− ):
- HCO 3 - ⇌ CO 3 2− + H +
- K a2 =4,69 x 10 −11 mol / L ; p K a2 = 10,329
En los organismos de producción de ácido carbónico es catalizada por la enzima , anhidrasa carbónica .
Reacciones químicas de CO 2
El CO 2 es un electrófilo potente que tiene una reactividad electrófila que es comparable al benzaldehído o compuestos carbonílicos α, β insaturados fuertes . Sin embargo, a diferencia de los electrófilos de reactividad similar, las reacciones de los nucleófilos con CO 2 son termodinámicamente menos favorecidas y, a menudo, se encuentra que son altamente reversibles. [32] Solo los nucleófilos muy fuertes, como los carbaniones proporcionados por los reactivos de Grignard y los compuestos de organolitio, reaccionan con el CO 2 para dar carboxilatos :
- MR + CO 2 → RCO 2 M
- donde M = Li o Mg Br y R = alquilo o arilo .
En los complejos de dióxido de carbono metálico , el CO 2 actúa como ligando , lo que puede facilitar la conversión de CO 2 en otras sustancias químicas. [33]
La reducción de CO 2 a CO suele ser una reacción lenta y difícil:
- CO 2 + 2 e - + 2H + → CO + H 2 O
Los fotoautótrofos (es decir, plantas y cianobacterias ) utilizan la energía contenida en la luz solar para fotosintetizar azúcares simples del CO 2 absorbido del aire y el agua:
- n CO 2 + n H
2O → (CH
2O)
norte+ n O
2
El potencial redox para esta reacción cerca de pH 7 es de aproximadamente -0,53 V en comparación con el electrodo de hidrógeno estándar . La enzima monóxido de carbono deshidrogenasa que contiene níquel cataliza este proceso. [34]
Propiedades físicas
El dióxido de carbono es incoloro. A bajas concentraciones, el gas es inodoro; sin embargo, a concentraciones suficientemente altas, tiene un olor ácido y penetrante. [1] A temperatura y presión estándar , la densidad del dióxido de carbono es de aproximadamente 1,98 kg / m 3 , aproximadamente 1,53 veces la del aire . [35]
El dióxido de carbono no tiene estado líquido a presiones por debajo de 5,1 atmósferas estándar (520 kPa). A 1 atmósfera (cerca de la presión media al nivel del mar), el gas se deposita directamente en un sólido a temperaturas inferiores a -78,5 ° C (-109,3 ° F; 194,7 K) y el sólido se sublima directamente a un gas por encima de -78,5 ° C. En su estado sólido, el dióxido de carbono se denomina comúnmente hielo seco .
El dióxido de carbono líquido se forma sólo a presiones superiores a 5,1 atm; el punto triple del dióxido de carbono es de aproximadamente 5,1 bar (517 kPa ) a 217 K (consulte el diagrama de fases). El punto crítico es 7.38 MPa a 31.1 ° C. [36] [37] Otra forma de dióxido de carbono sólido que se observa a alta presión es un sólido amorfo similar al vidrio. [38] Esta forma de vidrio, llamada carbonia , se produce mediante el sobreenfriamiento de CO 2 calentado a presión extrema (40-48 GPa o aproximadamente 400.000 atmósferas) en un yunque de diamante.. Este descubrimiento confirmó la teoría de que el dióxido de carbono podría existir en un estado de vidrio similar a otros miembros de su familia elemental, como el silicio ( vidrio de sílice ) y el dióxido de germanio . Sin embargo, a diferencia de los vidrios de sílice y de Alemania, el vidrio de carbonia no es estable a presiones normales y se convierte en gas cuando se libera la presión.
A temperaturas y presiones por encima del punto crítico, el dióxido de carbono se comporta como un fluido supercrítico conocido como dióxido de carbono supercrítico .
Aislamiento y producción
El dióxido de carbono se puede obtener mediante destilación del aire, pero el método es ineficaz. Industrialmente, el dióxido de carbono es predominantemente un producto de desecho no recuperado, producido por varios métodos que pueden practicarse a diversas escalas. [39]
La combustión de todos los combustibles a base de carbono , como metano ( gas natural ), destilados de petróleo ( gasolina , diesel , queroseno , propano ), carbón, madera y materia orgánica genérica produce dióxido de carbono y, excepto en el caso del carbono puro, agua. . Como ejemplo, la reacción química entre metano y oxígeno:
- CH
4+ 2 O
2→ CO
2+ 2 H
2O
Se produce por descomposición térmica de la piedra caliza, CaCO.
3por calentamiento ( calcinación ) a aproximadamente 850 ° C (1,560 ° F), en la fabricación de cal viva ( óxido de calcio , CaO ), un compuesto que tiene muchos usos industriales:
- CaCO
3→ CaO + CO
2
El hierro se reduce de sus óxidos con coque en un alto horno , produciendo arrabio y dióxido de carbono: [40]
El dióxido de carbono es un subproducto de la producción industrial de hidrógeno mediante reformado con vapor y la reacción de cambio de gas de agua en la producción de amoníaco . Estos procesos comienzan con la reacción del agua y el gas natural (principalmente metano). [41] Esta es una fuente importante de dióxido de carbono de calidad alimentaria para su uso en la carbonatación de cerveza y refrescos , y también se utiliza para aturdir animales como las aves de corral . En el verano de 2018 surgió en Europa una escasez de dióxido de carbono para estos fines debido al cierre temporal de varias plantas de amoniaco por mantenimiento. [42]
Los ácidos liberan CO 2 de la mayoría de los carbonatos metálicos. En consecuencia, puede obtenerse directamente de manantiales de dióxido de carbono natural , donde se produce por la acción del agua acidificada sobre piedra caliza o dolomita . La reacción entre el ácido clorhídrico y el carbonato de calcio (piedra caliza o creta) se muestra a continuación:
- CaCO
3+ 2 HCl → CaCl
2+ H
2CO
3
El ácido carbónico ( H
2CO
3) luego se descompone en agua y CO 2 :
- H
2CO
3→ CO
2+ H
2O
Estas reacciones van acompañadas de formación de espuma o burbujeo, o ambos, a medida que se libera el gas. Tienen usos muy extendidos en la industria porque se pueden utilizar para neutralizar corrientes de ácidos residuales.
El dióxido de carbono es un subproducto de la fermentación del azúcar en la elaboración de cerveza , whisky y otras bebidas alcohólicas y en la producción de bioetanol . La levadura metaboliza el azúcar para producir CO 2 y etanol , también conocido como alcohol, de la siguiente manera:
- C
6H
12O
6→ 2 CO
2+ 2 C
2H
5OH
Todos los organismos aeróbicos producen CO 2 cuando oxidan carbohidratos , ácidos grasos y proteínas. El gran número de reacciones involucradas son extremadamente complejas y no se describen fácilmente. Consulte ( respiración celular , respiración anaeróbica y fotosíntesis ). La ecuación para la respiración de glucosa y otros monosacáridos es:
- C
6H
12O
6+ 6 O
2→ 6 CO
2+ 6 H
2O
Los organismos anaeróbicos descomponen el material orgánico produciendo metano y dióxido de carbono junto con trazas de otros compuestos. [43] Independientemente del tipo de material orgánico, la producción de gases sigue un patrón cinético bien definido . El dióxido de carbono comprende alrededor del 40-45% del gas que emana de la descomposición en los vertederos (denominado " gas de vertedero "). La mayor parte del 50-55% restante es metano. [44]
Aplicaciones
El dióxido de carbono es utilizado por la industria alimentaria, la industria petrolera y la industria química. [39] El compuesto tiene diversos usos comerciales, pero uno de sus mayores usos como químico es en la producción de bebidas carbonatadas; proporciona el brillo en las bebidas carbonatadas como el agua con gas, la cerveza y el vino espumoso.
Precursor de productos químicos
Esta sección necesita expansión . Puede ayudar agregando más . ( Julio de 2014 ) |
En la industria química, el dióxido de carbono se consume principalmente como ingrediente en la producción de urea , y una fracción más pequeña se utiliza para producir metanol y una variedad de otros productos. [45] Algunos derivados del ácido carboxílico, como el salicilato de sodio, se preparan utilizando CO 2 mediante la reacción de Kolbe-Schmitt . [46]
Además de los procesos convencionales que utilizan CO 2 para la producción química, también se están explorando métodos electroquímicos a nivel de investigación. En particular, el uso de energía renovable para la producción de combustibles a partir de CO 2 (como el metanol) es atractivo ya que esto podría resultar en combustibles que podrían transportarse y usarse fácilmente dentro de las tecnologías de combustión convencionales, pero no tienen emisiones netas de CO 2 . [47]
Alimentos
El dióxido de carbono es un aditivo alimentario que se utiliza como propulsor y regulador de la acidez en la industria alimentaria. Está aprobado para su uso en la UE [48] (listado como número E E290), Estados Unidos [49] y Australia y Nueva Zelanda [50] (listado por su número SIN 290).
Un caramelo llamado Pop Rocks se presuriza con gas dióxido de carbono [51] a aproximadamente 4.000 kPa (40 bar ; 580 psi ). Cuando se coloca en la boca, se disuelve (al igual que otros caramelos duros) y libera las burbujas de gas con un estallido audible.
Los agentes leudantes hacen que la masa suba al producir dióxido de carbono. [52] La levadura de panadería produce dióxido de carbono por fermentación de azúcares dentro de la masa, mientras que los leudantes químicos como el polvo de hornear y el bicarbonato de sodio liberan dióxido de carbono cuando se calientan o si se exponen a ácidos .
Bebidas
El dióxido de carbono se utiliza para producir refrescos carbonatados y agua con gas . Tradicionalmente, la carbonatación de la cerveza y el vino espumoso se producía por fermentación natural, pero muchos fabricantes carbonatan estas bebidas con dióxido de carbono recuperado del proceso de fermentación. En el caso de la cerveza embotellada y en barril, el método más utilizado es la carbonatación con dióxido de carbono reciclado. Con la excepción de la cerveza inglesa , la cerveza de barril generalmente se transfiere de barriles en una cámara fría o bodega a grifos dispensadores en la barra usando dióxido de carbono presurizado, a veces mezclado con nitrógeno.
El sabor del agua de soda (y las sensaciones de sabor relacionadas en otras bebidas carbonatadas) es un efecto del dióxido de carbono disuelto en lugar de las burbujas que estallan del gas. La anhidrasa carbónica 4 se convierte en ácido carbónico dando lugar a un sabor amargo , y también el dióxido de carbono disuelto induce una respuesta somatosensorial . [53]
Vinificación
El dióxido de carbono en forma de hielo seco se utiliza a menudo durante la fase de remojo en frío en la elaboración del vino para enfriar los racimos de uvas rápidamente después de la recolección para ayudar a prevenir la fermentación espontánea por la levadura silvestre . La principal ventaja de usar hielo seco sobre hielo de agua es que enfría las uvas sin agregar agua adicional que pueda disminuir la concentración de azúcar en el mosto de uva y, por lo tanto, la concentración de alcohol en el vino terminado. El dióxido de carbono también se utiliza para crear un entorno hipóxico para la maceración carbónica , el proceso utilizado para producir Beaujolais. vino.
El dióxido de carbono se usa a veces para rellenar botellas de vino u otros recipientes de almacenamiento , como barriles, para evitar la oxidación, aunque tiene el problema de que puede disolverse en el vino, lo que hace que un vino previamente quieto esté ligeramente burbujeante. Por este motivo, los enólogos profesionales prefieren otros gases como el nitrógeno o el argón para este proceso.
Animales asombrosos
El dióxido de carbono se utiliza a menudo para "aturdir" a los animales antes del sacrificio. [54] "Aturdimiento" puede ser un nombre inapropiado, ya que los animales no son eliminados inmediatamente y pueden sufrir angustia. [55] [56]
Gas inerte
Es uno de los gases comprimidos más utilizados para sistemas neumáticos (gas presurizado) en herramientas portátiles a presión. El dióxido de carbono también se utiliza como atmósfera para soldar , aunque en el arco de soldadura reacciona para oxidar la mayoría de los metales. El uso en la industria automotriz es común a pesar de la evidencia significativa de que las soldaduras hechas con dióxido de carbono son más frágiles que las hechas en atmósferas más inertes. [ cita requerida ] Cuando se usa para soldadura MIG , el uso de CO 2 a veces se conoce como soldadura MAG, para Metal Active Gas, como CO 2puede reaccionar a estas altas temperaturas. Tiende a producir un charco más caliente que las atmósferas verdaderamente inertes, mejorando las características de flujo. Aunque, esto puede deberse a reacciones atmosféricas que ocurren en el lugar del charco. Por lo general, esto es lo opuesto al efecto deseado al soldar, ya que tiende a fragilizar el sitio, pero puede no ser un problema para la soldadura de acero dulce en general, donde la ductilidad final no es una preocupación importante.
Se utiliza en muchos productos de consumo que requieren gas presurizado porque es económico y no inflamable, y porque experimenta una transición de fase de gas a líquido a temperatura ambiente a una presión alcanzable de aproximadamente 60 bar (870 psi ; 59 atm ), lo que permite más dióxido de carbono para caber en un contenedor dado que de otra manera. Los chalecos salvavidas a menudo contienen botes de dióxido de carbono a presión para inflarlos rápidamente. Las cápsulas de aluminio de CO 2 también se venden como suministros de gas comprimido para pistolas de aire , marcadores / pistolas de paintball , inflado de neumáticos de bicicletas y para hacer agua carbonatada.. También se pueden utilizar altas concentraciones de dióxido de carbono para matar plagas. El dióxido de carbono líquido se utiliza en el secado supercrítico de algunos productos alimenticios y materiales tecnológicos, en la preparación de muestras para microscopía electrónica de barrido [57] y en la descafeinación de granos de café .
Extintor de incendios
El dióxido de carbono se puede utilizar para extinguir llamas inundando el ambiente alrededor de la llama con el gas. No reacciona por sí mismo para extinguir la llama, sino que priva de oxígeno a la llama desplazándola. Algunos extintores, especialmente los diseñados para incendios eléctricos, contienen dióxido de carbono líquido a presión. Los extintores de dióxido de carbono funcionan bien en fuegos pequeños de líquidos inflamables y eléctricos, pero no en fuegos de combustibles ordinarios, porque aunque excluye el oxígeno, no enfría las sustancias en combustión de manera significativa y cuando el dióxido de carbono se dispersa, pueden prenderse fuego al exponerse a la atmósfera. oxígeno. Su conveniencia en incendios eléctricos se debe al hecho de que, a diferencia del agua u otros métodos basados en productos químicos, el dióxido de carbono no causará cortocircuitos, lo que provocará aún más daños al equipo. Debido a que es un gas, también es fácil dispensar grandes cantidades de gas automáticamente en las salas de infraestructura de TI, donde el fuego en sí puede ser difícil de alcanzar con métodos más inmediatos porque está detrás de las puertas de los estantes y dentro de las vitrinas.El dióxido de carbono también se ha utilizado ampliamente como agente extintor en sistemas fijos de protección contra incendios para la aplicación local de peligros específicos y la inundación total de un espacio protegido.[58] Las normas de la Organización Marítima Internacional también reconocen los sistemas de dióxido de carbono para la protección contra incendios de las bodegas de los buques y las salas de máquinas. Los sistemas de protección contra incendios basados en dióxido de carbono se han relacionado con varias muertes, ya que pueden causar asfixia en concentraciones suficientemente altas. Una revisión de lossistemasde CO 2 identificó 51 incidentes entre 1975 y la fecha del informe (2000), que causaron 72 muertes y 145 heridos. [59]
CO 2 supercrítico como disolvente
El dióxido de carbono líquido es un buen disolvente para muchos compuestos orgánicos lipofílicos y se utiliza para eliminar la cafeína del café . [15] El dióxido de carbono ha atraído la atención en la industria farmacéutica y otras industrias de procesamiento químico como una alternativa menos tóxica a los disolventes más tradicionales como los organoclorados . También es utilizado por algunas tintorerías por este motivo (ver química verde ). Se utiliza en la preparación de algunos aerogeles debido a las propiedades del dióxido de carbono supercrítico.
Agricultura
Las plantas necesitan dióxido de carbono para realizar la fotosíntesis . Las atmósferas de los invernaderos pueden (si son de gran tamaño, deben) enriquecerse con CO 2 adicional para mantener y aumentar la tasa de crecimiento de las plantas. [60] [61] En concentraciones muy altas (100 veces la concentración atmosférica o más), el dióxido de carbono puede ser tóxico para la vida animal, por lo que elevar la concentración a 10,000 ppm (1%) o más durante varias horas eliminará plagas como moscas blancas y ácaros en un invernadero. [62]
Usos médicos y farmacológicos
En medicina, se añade hasta dióxido de carbono al 5% (130 veces la concentración atmosférica) a oxígeno para la estimulación de la respiración después de la apnea y para estabilizar la O
2/CO
2 equilibrio en sangre.
El dióxido de carbono se puede mezclar con hasta un 50% de oxígeno, formando un gas inhalable; esto se conoce como Carbogen y tiene una variedad de usos médicos y de investigación.
Energía
Recuperación de combustibles fósiles
El dióxido de carbono se utiliza en la recuperación mejorada de petróleo donde se inyecta en pozos de petróleo productores o adyacentes a ellos, generalmente en condiciones supercríticas , cuando se vuelve miscible con el petróleo. Este enfoque puede aumentar la recuperación de petróleo original al reducir la saturación de petróleo residual entre un 7% y un 23% adicional a la extracción primaria . [63] Actúa como un agente de presurización y, cuando se disuelve en el petróleo crudo subterráneo , reduce significativamente su viscosidad y cambia la química de la superficie, lo que permite que el petróleo fluya más rápidamente a través del depósito hasta el pozo de extracción. [64] En los campos petrolíferos maduros, se utilizan extensas redes de tuberías para transportar el dióxido de carbono a los puntos de inyección.
En la recuperación mejorada de metano del lecho de carbón , se bombearía dióxido de carbono a la veta de carbón para desplazar el metano, a diferencia de los métodos actuales que se basan principalmente en la eliminación de agua (para reducir la presión) para hacer que la veta de carbón libere su metano atrapado. [sesenta y cinco]
Bio transformación en combustible
Se ha propuesto que el CO 2 de la generación de energía se burbujee en estanques para estimular el crecimiento de algas que luego podrían convertirse en combustible biodiesel . [66] Una cepa de la cianobacteria Synechococcus elongatus ha sido modificada genéticamente para producir los combustibles isobutiraldehído e isobutanol a partir de CO 2 mediante fotosíntesis. [67]
Refrigerante
El dióxido de carbono líquido y sólido son refrigerantes importantes , especialmente en la industria alimentaria, donde se emplean durante el transporte y almacenamiento de helados y otros alimentos congelados. El dióxido de carbono sólido se denomina "hielo seco" y se utiliza para envíos pequeños donde el equipo de refrigeración no es práctico. El dióxido de carbono sólido siempre está por debajo de -78,5 ° C (-109,3 ° F) a presión atmosférica regular, independientemente de la temperatura del aire.
Se usó dióxido de carbono líquido (nomenclatura industrial R744 o R-744) como refrigerante antes del uso [ cita requerida ] de diclorodifluorometano (R12, un compuesto clorofluorocarbonado (CFC)). CO
2podría disfrutar de un renacimiento porque uno de los principales sustitutos de los CFC, el 1,1,1,2-tetrafluoroetano ( R134a , un compuesto de hidrofluorocarbono (HFC)) contribuye al cambio climático más que el CO
2lo hace. CO
2Las propiedades físicas son altamente favorables para propósitos de enfriamiento, refrigeración y calefacción, teniendo una alta capacidad de enfriamiento volumétrico. Debido a la necesidad de operar a presiones de hasta 130 bares (1900 psi; 13000 kPa), CO
2Los sistemas requieren depósitos y componentes altamente resistentes mecánicamente que ya han sido desarrollados para la producción en masa en muchos sectores. En aire acondicionado de automóviles, en más del 90% de todas las condiciones de conducción para latitudes superiores a 50 °, CO
2(R744) funciona de manera más eficiente que los sistemas que utilizan HFC ( por ejemplo , R134a). Sus ventajas ambientales ( GWP de 1, no agota la capa de ozono, no tóxico, no inflamable) podrían convertirlo en el fluido de trabajo futuro para reemplazar los HFC actuales en automóviles, supermercados y calentadores de agua con bomba de calor, entre otros. Coca-Cola ha enviado CO
2enfriadores de bebidas basadas y el Ejército de Estados Unidos está interesado en CO
2tecnología de refrigeración y calefacción. [68] [69]
Se espera que la industria automotriz mundial se decida por el refrigerante de próxima generación en el aire acondicionado de los automóviles. [ cuando? ] CO
2es una de las opciones discutidas (ver también: Aire acondicionado automotriz sustentable ).
Usos menores
El dióxido de carbono es el medio láser en un láser de dióxido de carbono , que es uno de los primeros tipos de láseres.
El dióxido de carbono se puede utilizar como un medio para controlar el pH de las piscinas, [70] agregando continuamente gas al agua, evitando así que el pH aumente. Entre las ventajas de esto se encuentra evitar la manipulación de ácidos (más peligrosos). De manera similar, también se usa en el mantenimiento de acuarios de arrecife , donde se usa comúnmente en reactores de calcio para reducir temporalmente el pH del agua que pasa sobre el carbonato de calcio para permitir que el carbonato de calcio se disuelva en el agua más libremente donde se usa. por algunos corales para construir su esqueleto.
Se utiliza como refrigerante primario en el reactor británico avanzado refrigerado por gas para la generación de energía nuclear.
La inducción de dióxido de carbono se usa comúnmente para la eutanasia de animales de investigación de laboratorio. Los métodos para administrar CO 2 incluyen colocar a los animales directamente en una cámara cerrada y precargada que contenga CO 2 , o exponerlos a una concentración de CO 2 que aumenta gradualmente . En 2013, la Asociación Americana de Medicina Veterinaria emitió nuevas pautas para la inducción de dióxido de carbono, indicando que una tasa de desplazamiento del 30% al 70% del volumen de la cámara de gas por minuto es óptima para la eutanasia humanitaria de pequeños roedores. [71] Sin embargo, existe oposición a la práctica de usar dióxido de carbono para esto, sobre la base de que es cruel. [56]
El dióxido de carbono también se utiliza en varias técnicas relacionadas de limpieza y preparación de superficies .
En la atmósfera de la Tierra
El dióxido de carbono en la atmósfera de la Tierra es un gas traza , con una concentración promedio global de 415 partes por millón en volumen (o 630 partes por millón en masa) a fines del año 2020. [74] [75] CO atmosférico
2las concentraciones fluctúan ligeramente con las estaciones, cayendo durante la primavera y el verano del hemisferio norte a medida que las plantas consumen el gas y aumentando durante el otoño y el invierno del norte a medida que las plantas permanecen inactivas o mueren y se descomponen. Las concentraciones también varían según la región, más fuertemente cerca del suelo con variaciones mucho más pequeñas en el aire. En las áreas urbanas, las concentraciones son generalmente más altas [76] y en interiores pueden alcanzar 10 veces los niveles de fondo.
La concentración de dióxido de carbono ha aumentado debido a las actividades humanas. [77] La extracción y quema de combustibles fósiles , utilizando carbono que ha sido secuestrado durante muchos millones de años en la litosfera , ha provocado la concentración atmosférica de CO
2aumentar en aproximadamente un 50% desde el comienzo de la era de la industrialización hasta el año 2020. [78] [79] La mayor parte del CO
2de las actividades humanas se libera de la quema de carbón, petróleo y gas natural. Otras grandes fuentes antropogénicas incluyen la producción de cemento, la deforestación y la quema de biomasa. Las actividades humanas emiten más de 30 mil millones de toneladas de CO
2(9 mil millones de toneladas de carbono fósil) por año, mientras que los volcanes emiten solo entre 0,2 y 0,3 mil millones de toneladas de CO
2. [80] [81] Las actividades humanas han provocado que el CO 2 aumente por encima de niveles no vistos en cientos de miles de años. Actualmente, aproximadamente la mitad del dióxido de carbono liberado por la quema de combustibles fósiles permanece en la atmósfera y no es absorbido por la vegetación y los océanos. [82] [83] [84] [85]
2fluye desde fuentes antropogénicas (izquierda) hacia la atmósfera terrestre, la tierra y los sumideros oceánicos (derecha) desde la década de 1960. Unidades en gigatoneladas de carbono equivalentes por año. [79]
Si bien es transparente a la luz visible , el dióxido de carbono es un gas de efecto invernadero que absorbe y emite radiación infrarroja en sus dos frecuencias vibratorias activas en el infrarrojo (consulte la sección " Estructura y enlace " más arriba). La emisión de luz de la superficie terrestre es más intensa en la región infrarroja entre 200 y 2500 cm -1 , [86] en contraposición a la emisión de luz del sol mucho más caliente, que es más intensa en la región visible. Absorción de luz infrarroja en las frecuencias vibratorias del CO atmosférico
2atrapa energía cerca de la superficie, calentando la superficie y la atmósfera inferior. Menos energía llega a la atmósfera superior, que por lo tanto es más fría debido a esta absorción. [87] Aumento de las concentraciones atmosféricas de CO
2y otros gases de efecto invernadero de larga duración como el metano, el óxido nitroso y el ozono han reforzado en consecuencia su absorción y emisión de radiación infrarroja, provocando el aumento de la temperatura global media desde mediados del siglo XX. El dióxido de carbono es el más preocupante porque ejerce una mayor influencia de calentamiento general que todos estos otros gases combinados. [78] Además, tiene una vida atmosférica que aumenta con la cantidad acumulada de carbono fósil extraído y quemado, debido al desequilibrio que esta actividad ha impuesto al rápido ciclo del carbono de la Tierra . [88] Esto significa que una fracción (un 20-35% proyectado) del carbono fósil transferido hasta el momento persistirá en la atmósfera tan elevadoCO
2niveles durante muchos miles de años después de que estas actividades de transferencia de carbono comiencen a disminuir. [89] [90] [91]
( simulación por computadora de la NASA ).
No solo el aumento de CO
2las concentraciones conducen a aumentos en la temperatura de la superficie global, pero el aumento de las temperaturas globales también provoca concentraciones crecientes de dióxido de carbono. Esto produce una retroalimentación positiva de los cambios inducidos por otros procesos como los ciclos orbitales . [92] Hace quinientos millones de años, el CO
2la concentración fue 20 veces mayor que la actual, disminuyó a 4-5 veces durante el período Jurásico y luego disminuyó lentamente con una reducción particularmente rápida que ocurrió hace 49 millones de años. [93] [94]
Las concentraciones locales de dióxido de carbono pueden alcanzar valores altos cerca de fuentes fuertes, especialmente aquellas que están aisladas por el terreno circundante. En el manantial termal de Bossoleto cerca de Rapolano Terme en Toscana , Italia , situado en una depresión en forma de cuenco de unos 100 m (330 pies) de diámetro, las concentraciones de CO 2 se elevan por encima del 75% durante la noche, suficiente para matar insectos y animales pequeños. Después del amanecer, el gas se dispersa por convección. [95] Se cree que las altas concentraciones de CO 2 producidas por la alteración de las aguas profundas de los lagos saturadas con CO 2 han causado 37 muertes en el lago Mimony , Camerún.en 1984 y 1700 bajas en el lago Nyos , Camerún en 1986. [96]
En los océanos
El dióxido de carbono se disuelve en el océano para formar ácido carbónico (H 2 CO 3 ), bicarbonato (HCO 3 - ) y carbonato (CO 3 2− ). Hay unas cincuenta veces más dióxido de carbono disuelto en los océanos que en la atmósfera. Los océanos actúan como un enorme sumidero de carbono y han absorbido alrededor de un tercio del CO 2 emitido por la actividad humana. [97]
A medida que aumenta la concentración de dióxido de carbono en la atmósfera, la mayor absorción de dióxido de carbono en los océanos está provocando una disminución mensurable del pH de los océanos, lo que se conoce como acidificación de los océanos . Esta reducción del pH afecta a los sistemas biológicos de los océanos, principalmente a los organismos calcificantes oceánicos . Estos efectos abarcan la cadena alimentaria desde autótrofos hasta heterótrofos e incluyen organismos como cocolitóforos , corales , foraminíferos , equinodermos , crustáceos y moluscos.. En condiciones normales, el carbonato de calcio es estable en aguas superficiales, ya que el ion carbonato se encuentra en concentraciones sobresaturantes . Sin embargo, a medida que desciende el pH del océano, también lo hace la concentración de este ión, y cuando el carbonato se vuelve insuficientemente saturado, las estructuras hechas de carbonato de calcio son vulnerables a la disolución. [98] Corales, [99] [100] [101] algas cocolitóforos, [102] [103] [104] [105] algas coralinas, [106] foraminíferos, [107] mariscos [108] y pterópodos [109] experiencia calcificación reducida o disolución mejorada cuando se expone a niveles elevados de CO
2.
La solubilidad del gas disminuye a medida que aumenta la temperatura del agua (excepto cuando la presión excede los 300 bar y la temperatura excede los 393 K, solo se encuentra cerca de respiraderos geotérmicos profundos) [110] y, por lo tanto, la tasa de absorción de la atmósfera disminuye a medida que aumenta la temperatura del océano.
La mayor parte del CO 2 absorbido por el océano, que es aproximadamente el 30% del total liberado a la atmósfera, [111] forma ácido carbónico en equilibrio con bicarbonato. Algunas de estas especies químicas son consumidas por organismos fotosintéticos que eliminan el carbono del ciclo. El aumento de CO 2 en la atmósfera ha provocado una disminución de la alcalinidad del agua de mar, y existe la preocupación de que esto pueda afectar negativamente a los organismos que viven en el agua. En particular, con la disminución de la alcalinidad, la disponibilidad de carbonatos para formar conchas disminuye, [112] aunque hay evidencia de una mayor producción de concha por parte de ciertas especies bajo un mayor contenido de CO 2 . [113]
La NOAA declara en su "Hoja informativa sobre el estado de la ciencia para la acidificación de los océanos " de mayo de 2008 que:
"Los océanos han absorbido aproximadamente el 50% del dióxido de carbono (CO 2 ) liberado por la quema de combustibles fósiles, lo que ha provocado reacciones químicas que bajan el océano. pH. Esto ha provocado un aumento de los iones de hidrógeno (acidez) de aproximadamente un 30% desde el inicio de la era industrial a través de un proceso conocido como "acidificación de los océanos". Un número creciente de estudios han demostrado efectos adversos en los organismos marinos, entre ellos:
- La velocidad a la que los corales formadores de arrecifes producen sus esqueletos disminuye, mientras que aumenta la producción de numerosas variedades de medusas.
- Se reduce la capacidad de las algas marinas y del zooplancton que nada libremente para mantener las conchas protectoras.
- Se reduce la supervivencia de las especies marinas larvarias, incluidos los peces y mariscos comerciales ".
Además, el Panel Intergubernamental sobre Cambio Climático (IPCC) escribe en su Informe de síntesis sobre el cambio climático 2007: [114]
"La absorción de carbono antropogénico desde 1750 ha llevado a que el océano se vuelva más ácido con una disminución promedio del pH de 0,1 unidades. El aumento de las concentraciones atmosféricas de CO 2 conduce a una mayor acidificación ... Si bien los efectos de la acidificación oceánica observada en la biosfera marina aún no están documentados, se espera que la acidificación progresiva de los océanos tenga impactos negativos en los organismos marinos formadores de conchas (p. Ej., Corales) y sus especies dependientes ".
Algunos organismos marinos calcificantes (incluidos los arrecifes de coral) han sido seleccionados por las principales agencias de investigación, como NOAA, la comisión OSPAR, NANOOS y el IPCC, porque su investigación más actual muestra que se debe esperar que la acidificación de los océanos los impacte negativamente. [115]
El dióxido de carbono también se introduce en los océanos a través de respiraderos hidrotermales. El respiradero hidrotermal de Champagne , que se encuentra en el volcán Eifuku del noroeste en la Fosa de las Marianas , produce dióxido de carbono líquido casi puro, uno de los dos únicos sitios conocidos en el mundo en 2004, el otro en Okinawa Trough . [116] En 2006 se informó del hallazgo de un lago submarino de dióxido de carbono líquido en el abrevadero de Okinawa. [117]
Papel biológico
El dióxido de carbono es un producto final de la respiración celular en organismos que obtienen energía al descomponer azúcares, grasas y aminoácidos con oxígeno como parte de su metabolismo . Esto incluye todas las plantas, algas y animales y hongos y bacterias aeróbicos . En los vertebrados , el dióxido de carbono viaja en la sangre desde los tejidos del cuerpo hasta la piel (p. Ej., Anfibios ) o las branquias (p. Ej., Peces ), desde donde se disuelve en el agua o hasta los pulmones desde donde se exhala. Durante la fotosíntesis activa, las plantas pueden absorber más dióxido de carbono de la atmósfera del que liberan al respirar.
Fotosíntesis y fijación de carbono
La fijación de carbono es un proceso bioquímico mediante el cual las plantas , las algas y las ( cianobacterias ) incorporan dióxido de carbono atmosférico en moléculas orgánicas ricas en energía como la glucosa , creando así su propio alimento mediante la fotosíntesis . La fotosíntesis utiliza dióxido de carbono y agua para producir azúcares a partir de los cuales se pueden construir otros compuestos orgánicos , y el oxígeno se produce como subproducto.
La ribulosa-1,5-bisfosfato carboxilasa oxigenasa , comúnmente abreviada como RuBisCO, es la enzima involucrada en el primer paso importante de la fijación de carbono, la producción de dos moléculas de 3-fosfoglicerato a partir de CO 2 y bisfosfato de ribulosa , como se muestra en el diagrama en izquierda.
Se cree que RuBisCO es la proteína más abundante en la Tierra. [118]
Los fotótrofos utilizan los productos de su fotosíntesis como fuentes internas de alimento y como materia prima para la biosíntesis de moléculas orgánicas más complejas, como polisacáridos , ácidos nucleicos y proteínas . Estos se utilizan para su propio crecimiento y también como base de las cadenas alimentarias y las redes que alimentan a otros organismos, incluidos animales como nosotros. Algunos fotótrofos importantes, los cocolitóforos, sintetizan escamas duras de carbonato de calcio . [119] Una especie de cocolitóforo de importancia mundial es Emiliania huxleyi, cuya calcitalas escamas han formado la base de muchas rocas sedimentarias como la piedra caliza , donde lo que antes era carbono atmosférico puede permanecer fijo durante escalas de tiempo geológicas.
Las plantas pueden crecer hasta un 50 por ciento más rápido en concentraciones de 1,000 ppm de CO 2 en comparación con las condiciones ambientales, aunque esto supone que no hay cambios en el clima ni limitaciones en otros nutrientes. [120] Los niveles elevados de CO 2 provocan un aumento del crecimiento reflejado en el rendimiento cosechable de los cultivos, y el trigo, el arroz y la soja muestran aumentos en el rendimiento del 12 al 14% bajo niveles elevados de CO 2 en los experimentos FACE. [121] [122]
El aumento de las concentraciones de CO 2 atmosférico da como resultado que se desarrollen menos estomas en las plantas [123], lo que conduce a una reducción del uso de agua y una mayor eficiencia del uso del agua . [124] Los estudios que utilizan FACE han demostrado que el enriquecimiento de CO 2 conduce a una disminución de las concentraciones de micronutrientes en las plantas de cultivo. [125] Esto puede tener efectos en cadena en otras partes de los ecosistemas, ya que los herbívoros necesitarán comer más alimentos para obtener la misma cantidad de proteína. [126]
La concentración de metabolitos secundarios como fenilpropanoides y flavonoides también se puede alterar en plantas expuestas a altas concentraciones de CO 2 . [127] [128]
Las plantas también emiten CO 2 durante la respiración, por lo que la mayoría de las plantas y algas, que utilizan la fotosíntesis de C3 , son solo absorbentes netos durante el día. Aunque un bosque en crecimiento absorberá muchas toneladas de CO 2 cada año, un bosque maduro producirá tanto CO 2 por la respiración y descomposición de especímenes muertos (por ejemplo, ramas caídas) como se utiliza en la fotosíntesis en plantas en crecimiento. [129] Contrariamente a la opinión de larga data de que son carbono neutros, los bosques maduros pueden seguir acumulando carbono [130] y seguir siendo valiosos sumideros de carbono, ayudando a mantener el equilibrio de carbono de la atmósfera terrestre. Además, y de manera crucial para la vida en la tierra, la fotosíntesis del fitoplancton consume CO 2 disuelto en la capa superior del océano y, por lo tanto, promueve la absorción de CO 2 de la atmósfera. [131]
Toxicidad
El contenido de dióxido de carbono en el aire fresco (promediado entre el nivel del mar y el nivel de 10 kPa, es decir, aproximadamente 30 km (19 millas) de altitud) varía entre 0.036% (360 ppm) y 0.041% (412 ppm), dependiendo de la ubicación. [133] [ aclaración necesaria ]
El CO 2 es un gas asfixiante y no está clasificado como tóxico o nocivo de acuerdo con las normas del Sistema Globalmente Armonizado de Clasificación y Etiquetado de Productos Químicos de la Comisión Económica de las Naciones Unidas para Europa utilizando las Directrices de la OCDE para el Ensayo de Productos Químicos . En concentraciones de hasta el 1% (10,000 ppm), hará que algunas personas se sientan somnolientas y les dé a los pulmones una sensación de congestión. [132] Las concentraciones de 7% a 10% (70.000 a 100.000 ppm) pueden causar asfixia, incluso en presencia de suficiente oxígeno, que se manifiesta como mareos, dolor de cabeza, disfunción visual y auditiva y pérdida del conocimiento en unos pocos minutos a una hora. [134]Los efectos fisiológicos de la exposición aguda al dióxido de carbono se agrupan bajo el término hipercapnia , un subconjunto de asfixia .
Debido a que es más pesado que el aire, en lugares donde el gas se filtra del suelo (debido a la actividad volcánica o geotérmica subterránea) en concentraciones relativamente altas, sin los efectos de dispersión del viento, puede acumularse en lugares protegidos / embolsados por debajo del suelo promedio. nivel, provocando la asfixia de los animales situados en el mismo. Los comederos carroñeros atraídos por los cadáveres también son sacrificados. Los niños han muerto de la misma manera cerca de la ciudad de Goma por las emisiones de CO 2 del volcán cercano Mt. Nyiragongo . [135] El término swahili para este fenómeno es ' mazuku '.
La adaptación al aumento de las concentraciones de CO 2 se produce en los seres humanos, incluida la respiración modificada y la producción de bicarbonato renal, para equilibrar los efectos de la acidificación de la sangre ( acidosis ). Varios estudios sugirieron que las concentraciones inspiradas al 2.0 por ciento podrían usarse para espacios de aire cerrados (por ejemplo, un submarino ) ya que la adaptación es fisiológica y reversible, ya que el deterioro en el rendimiento o en la actividad física normal no ocurre con este nivel de exposición durante cinco días. [136] [137] Sin embargo, otros estudios muestran una disminución en la función cognitiva incluso a niveles mucho más bajos. [138] [139] Además, con acidosis respiratoria en curso, adaptación olos mecanismos compensatorios no podrán revertir tal condición .
Por debajo del 1%
Hay pocos estudios sobre los efectos en la salud de la exposición continua a largo plazo al CO 2 en humanos y animales a niveles por debajo del 1%. Los límites de exposición ocupacional al CO 2 se han establecido en los Estados Unidos en 0.5% (5000 ppm) por un período de ocho horas. [140] Con esta concentración de CO 2 , la tripulación de la Estación Espacial Internacional experimentó dolores de cabeza, letargo, lentitud mental, irritación emocional y trastornos del sueño. [141] Los estudios en animales al 0,5% de CO 2 han demostrado calcificación renal y pérdida ósea después de ocho semanas de exposición. [142]Un estudio de humanos expuestos en sesiones de 2.5 horas demostró efectos negativos significativos sobre las capacidades cognitivas en concentraciones tan bajas como 0.1% (1000 ppm) de CO 2 probablemente debido a aumentos inducidos por CO 2 en el flujo sanguíneo cerebral. [138] Otro estudio observó una disminución en el nivel de actividad básica y el uso de información a 1000 ppm, en comparación con 500 ppm. [139]
Ventilación
La mala ventilación es una de las principales causas de concentraciones excesivas de CO 2 en espacios cerrados. El diferencial de dióxido de carbono por encima de las concentraciones exteriores en condiciones de estado estacionario (cuando la ocupación y el funcionamiento del sistema de ventilación son lo suficientemente largos como para que la concentración de CO 2 se haya estabilizado) a veces se utilizan para estimar las tasas de ventilación por persona. [ cita requerida ] Las concentraciones más altas de CO 2 están asociadas con la salud de los ocupantes, la comodidad y la degradación del rendimiento. [143] [144] ASHRAELas tasas de ventilación estándar 62.1–2007 pueden resultar en concentraciones en interiores de hasta 2,100 ppm por encima de las condiciones ambientales exteriores. Por lo tanto, si la concentración en el exterior es de 400 ppm, las concentraciones en el interior pueden alcanzar las 2500 ppm con tasas de ventilación que cumplen con este estándar de consenso de la industria. Las concentraciones en espacios mal ventilados se pueden encontrar incluso más altas que esto (rango de 3.000 o 4.000 ppm).
Los mineros, que son particularmente vulnerables a la exposición al gas debido a una ventilación insuficiente, se refieren a las mezclas de dióxido de carbono y nitrógeno como " blackdamp ", "choke húmedo" o "stythe". Antes de que se desarrollaran tecnologías más efectivas, los mineros monitoreaban con frecuencia niveles peligrosos de grisú y otros gases en los pozos de las minas llevando consigo un canario enjaulado mientras trabajaban. El canario es más sensible a los gases asfixiantes que los humanos, y cuando perdía el conocimiento dejaba de cantar y se caía de su percha. La lámpara Davy también podría detectar altos niveles de grisú (que se hunde y se acumula cerca del piso) al quemarse con menos brillo, mientras que el metano, otro gas sofocante y riesgo de explosión, haría que la lámpara arda con más intensidad.
En febrero de 2020, tres personas murieron por asfixia en una fiesta en Moscú cuando se agregó hielo seco (CO 2 congelado ) a una piscina para enfriarla. [145]
Fisiología humana
Contenido
| Compartimento de sangre | ( kPa ) | ( mm Hg ) |
|---|---|---|
| Dióxido de carbono en sangre venosa | 5,5–6,8 | 41–51 [146] |
| Presiones de gas pulmonar alveolar | 4.8 | 36 |
| Dióxido de carbono en sangre arterial | 4,7–6,0 | 35–45 [146] |
El cuerpo produce aproximadamente 2,3 libras (1,0 kg) de dióxido de carbono por día por persona, [147] que contiene 0,63 libras (290 g) de carbono.En los seres humanos, este dióxido de carbono se transporta a través del sistema venoso y se exhala a través de los pulmones, lo que resulta en concentraciones más bajas en las arterias . El contenido de dióxido de carbono de la sangre a menudo se da como la presión parcial , que es la presión que habría tenido el dióxido de carbono si solo ocupara el volumen. [148] En los seres humanos, el contenido de dióxido de carbono en sangre se muestra en la tabla adyacente.
Transporte en la sangre
El CO 2 se transporta en la sangre de tres formas diferentes. (Los porcentajes exactos varían según sea sangre arterial o venosa).
- La mayor parte (aproximadamente del 70% al 80%) se convierte en iones de bicarbonato HCO-
3por la enzima anhidrasa carbónica en los glóbulos rojos, [149] por la reacción CO 2 + H
2O → H
2CO
3→ H+
+ HCO-
3. - El 5-10% se disuelve en el plasma [149].
- El 5-10% se une a la hemoglobina como compuestos carbamino [149]
La hemoglobina , la principal molécula transportadora de oxígeno en los glóbulos rojos , transporta tanto oxígeno como dióxido de carbono. Sin embargo, el CO 2 unido a la hemoglobina no se une al mismo sitio que el oxígeno. En cambio, se combina con los grupos N-terminales en las cuatro cadenas de globina. Sin embargo, debido a los efectos alostéricos sobre la molécula de hemoglobina, la unión de CO 2 disminuye la cantidad de oxígeno que se une a una determinada presión parcial de oxígeno. Esto se conoce como efecto Haldane y es importante en el transporte de dióxido de carbono de los tejidos a los pulmones. Por el contrario, un aumento de la presión parcial de CO 2o un pH más bajo provocará la descarga de oxígeno de la hemoglobina, lo que se conoce como efecto Bohr .
Regulación de la respiración
Esta sección necesita citas adicionales para su verificación . ( Junio de 2014 ) ( Obtenga información sobre cómo y cuándo eliminar este mensaje de plantilla ) |
El dióxido de carbono es uno de los mediadores de la autorregulación local del riego sanguíneo. Si su concentración es alta, los capilares se expanden para permitir un mayor flujo sanguíneo a ese tejido.
Los iones de bicarbonato son cruciales para regular el pH sanguíneo. La frecuencia respiratoria de una persona influye en el nivel de CO 2 en sangre. La respiración demasiado lenta o superficial provoca acidosis respiratoria , mientras que la respiración demasiado rápida conduce a la hiperventilación , que puede provocar alcalosis respiratoria .
Aunque el cuerpo necesita oxígeno para el metabolismo, los niveles bajos de oxígeno normalmente no estimulan la respiración. Más bien, la respiración es estimulada por niveles más altos de dióxido de carbono. Como resultado, respirar aire a baja presión o una mezcla de gases sin nada de oxígeno (como nitrógeno puro) puede provocar la pérdida del conocimiento sin experimentar nunca la falta de aire . Esto es especialmente peligroso para los pilotos de combate de gran altitud. También es la razón por la que los auxiliares de vuelo instruyen a los pasajeros, en caso de pérdida de presión en la cabina, para que se apliquen primero la máscara de oxígeno antes de ayudar a los demás; de lo contrario, uno corre el riesgo de perder el conocimiento. [149]
Los centros respiratorios intentan mantener una presión arterial de CO 2 de 40 mm Hg. Con la hiperventilación intencional, el contenido de CO 2 de la sangre arterial puede reducirse a 10-20 mm Hg (el contenido de oxígeno de la sangre se ve poco afectado) y el impulso respiratorio disminuye. Es por eso que uno puede contener la respiración por más tiempo después de hiperventilar que sin hiperventilar. Esto conlleva el riesgo de que se pierda el conocimiento antes de que la necesidad de respirar se vuelva abrumadora, por lo que la hiperventilación es particularmente peligrosa antes del buceo libre.
Ver también
- Gasometría arterial
- Reacción de Bosch
- Gas envasado : sustancias que son gaseosas a temperatura y presión estándar y que han sido comprimidas y almacenadas en cilindros de gas.
- Eliminación de dióxido de carbono - La eliminación de dióxido de carbono en la atmósfera (de la atmósfera)
- Sensor de dióxido de carbono
- Secuestro de carbono : captura y almacenamiento a largo plazo de dióxido de carbono atmosférico
- Cueva de los perros - Cueva cerca de Nápoles, Italia
- Estándares de emisión
- Calidad del aire interior: calidad del aire dentro y alrededor de edificios y estructuras
- Identidad de Kaya : identidad con respecto a las emisiones antropogénicas de dióxido de carbono
- Lago Kivu - Lago Meromictic en el valle del Rift de África Oriental
- Lista de centrales eléctricas menos eficientes en carbono
- Lista de países por emisiones de dióxido de carbono
- Lago meromíctico: lago estratificado permanentemente con capas de agua que no se entremezclan
- pCO2 : presión parcial de dióxido de carbono, que se utiliza a menudo en referencia a la sangre
- Gilbert Plass - físico canadiense (trabajo inicial sobre CO 2 y cambio climático)
- Reacción Sabatier : proceso de metanización de dióxido de carbono con hidrógeno
- Observatorio Orbital de Carbono de la NASA 2
- Satélite de observación de gases de efecto invernadero - Satélite de observación de la Tierra
Referencias
- ^ a b c "Dióxido de carbono" (PDF) . Productos de aire .
- ^ Touloukian, Y.S., Liley, P.E., and Saxena, S.C. (1970). "Thermophysical properties of matter - the TPRC data series". Thermal Conductivity - Nonmetallic Liquids and Gases. Data book. 3.CS1 maint: multiple names: authors list (link)
- ^ Schäfer, Michael; Richter, Markus; Span, Roland (2015). "Measurements of the viscosity of carbon dioxide at temperatures from (253.15 to 473.15) K with pressures up to 1.2 MPa". The Journal of Chemical Thermodynamics. 89: 7–15. doi:10.1016/j.jct.2015.04.015.
- ^ a b c NIOSH Pocket Guide to Chemical Hazards. "#0103". National Institute for Occupational Safety and Health (NIOSH).
- ^ "Carbon dioxide". Immediately Dangerous to Life or Health Concentrations (IDLH). National Institute for Occupational Safety and Health (NIOSH).
- ^ "Safety Data Sheet – Carbon Dioxide Gas – version 0.03 11/11" (PDF). AirGas.com. 12 February 2018. Retrieved 4 August 2018.
- ^ "Carbon dioxide, refrigerated liquid" (PDF). Praxair. p. 9. Archived from the original (PDF) on 29 July 2018. Retrieved 26 July 2018.
- ^ Eggleton, Tony (2013). A Short Introduction to Climate Change. Cambridge University Press. p. 52. ISBN 9781107618763.
- ^ Carbonated (Sparkling) Water: Good or Bad? healthline.com
- ^ Kaufman, Donald G.; Franz, Cecilia M. (1996). Biosphere 2000: protecting our global environment. Kendall/Hunt Pub. Co. ISBN 978-0-7872-0460-0.
- ^ "Food Factories". www.legacyproject.org. Retrieved 10 October 2011.
- ^ Lénárd-István Csepei (2011). Kinetic studies of propane oxidation on Mo and V based mixed oxide catalysts (PDF) (PHD thesis). Technical University of Berlin.
- ^ Amakawa, Kazuhiko; Kolen'ko, Yury V.; Villa, Alberto; Schuster, Manfred Erwin; Csepei, Lenard-Istvan; Weinberg, Gisela; Wrabetz, Sabine; Naumann d'Alnoncourt, Raoul; Girgsdies, Frank; Prati, Laura; Schloegl, Robert; Trunschke, Annette (2013). "Multifunctionality of Crystalline MoV(TeNb) M1 Oxide Catalysts in Selective Oxidation of Propane and Benzyl Alcohol". ACS Catalysis. 3 (6): 1103–1113. doi:10.1021/cs400010q.
- ^ Naumann d’Alnoncourt, Raoul; Csepei, Lénárd-István; Hävecker, Michael; Girgsdies, Frank; Schuster, Manfred E.; Schlögl, Robert; Trunschke, Annette (2014). "The reaction network in propane oxidation over phase-pure MoVTeNb M1 oxide catalysts" (PDF). Journal of Catalysis. 311: 369–385. doi:10.1016/j.jcat.2013.12.008. hdl:11858/00-001M-0000-0014-F434-5. Archived from the original (PDF) on 15 February 2016. Retrieved 9 July 2017.
- ^ a b Tsotsas, Evangelos; Mujumdar, Arun S. (2011). Modern drying technology. 3: Product quality and formulation. John Wiley & Sons. ISBN 978-3-527-31558-1.
- ^ Mikhail, M.; Wang, B.; Jalain, R.; Cavadias, S.; Tatoulian, M.; Ognier, S.; Gálvez, M. E.; Da Costa, P. (1 April 2019). "Plasma-catalytic hybrid process for CO2 methanation: optimization of operation parameters". Reaction Kinetics, Mechanisms and Catalysis. 126 (2): 629–643. doi:10.1007/s11144-018-1508-8. S2CID 104301429.
- ^ "Catalysts for climate protection". 19 August 2019.
- ^ Voiry, Damien; Shin, Hyeon Suk; Loh, Kian Ping; Chhowalla, Manish (2018). "Low-dimensional catalysts for hydrogen evolution and CO2 reduction". Nature Reviews Chemistry. 2 (1): 0105. doi:10.1038/s41570-017-0105.
- ^ Gomez, Elaine; Yan, Binhang; Kattel, Shyam; Chen, Jingguang G. (10 September 2019). "Carbon dioxide reduction in tandem with light-alkane dehydrogenation". Nature Reviews Chemistry. 3 (11): 638–649. doi:10.1038/s41570-019-0128-9. S2CID 202159972.
- ^ Ocean Acidification: A National Strategy to Meet the Challenges of a Changing Ocean. Washington, DC: National Academies Press. 22 April 2010. doi:10.17226/12904. ISBN 978-0-309-15359-1.
- ^ DavidFraser Harris (September 1910). "The Pioneer in the Hygiene of Ventilation". The Lancet. 176 (4542): 906–908. doi:10.1016/S0140-6736(00)52420-9.
- ^ Almqvist, Ebbe (2003). History of industrial gases. Springer. ISBN 978-0-306-47277-0. p. 93
- ^ Priestley, Joseph; Hey, Wm (1772). "Observations on Different Kinds of Air". Philosophical Transactions. 62: 147–264. doi:10.1098/rstl.1772.0021. S2CID 186210131.
- ^ Davy, Humphry (1823). "On the Application of Liquids Formed by the Condensation of Gases as Mechanical Agents". Philosophical Transactions. 113: 199–205. doi:10.1098/rstl.1823.0020. JSTOR 107649.
- ^ Thilorier, Adrien-Jean-Pierre (1835). "Solidification de l'Acide carbonique". Comptes Rendus. 1: 194–196.
- ^ "Solidification of carbonic acid". The London and Edinburgh Philosophical Magazine. 8 (48): 446–447. 1836. doi:10.1080/14786443608648911.
- ^ a b Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.
- ^ Atkins P. and de Paula J. Physical Chemistry (8th ed., W.H. Freeman 2006) pp. 461, 464 ISBN 0-7167-8759-8
- ^ Per Jensen; M. Spanner; P. R. Bunker (2020). "The CO2 molecule is never linear". J Mol Struct. 1212: 128087. Bibcode:2020JMoSt121228087J. doi:10.1016/j.molstruc.2020.128087. hdl:2142/107329.
- ^ B. Siegmann; U. Werner; H. O. Lutz; R. Mann (2002). "Complete Coulomb fragmentation of CO2 in collisions with 5.9 MeV u−1 Xe18+ and Xe43+". J Phys B Atom Mol Opt Phys. 35 (17): 3755. Bibcode:2002JPhB...35.3755S. doi:10.1088/0953-4075/35/17/311.
- ^ Jolly, William L., Modern Inorganic Chemistry (McGraw-Hill 1984), p. 196 ISBN 0-07-032760-2
- ^ Li, Zhen; Mayer, Robert J.; Ofial, Armin R.; Mayr, Herbert (27 April 2020). "From Carbodiimides to Carbon Dioxide: Quantification of the Electrophilic Reactivities of Heteroallenes". Journal of the American Chemical Society. 142 (18): 8383–8402. doi:10.1021/jacs.0c01960. PMID 32338511.
- ^ Aresta, M. (Ed.) (2010) Carbon Dioxide as a Chemical Feedstock, Wiley-VCH: Weinheim. ISBN 978-3-527-32475-0
- ^ Finn, Colin; Schnittger, Sorcha; Yellowlees, Lesley J.; Love, Jason B. (2012). "Molecular approaches to the electrochemical reduction of carbon dioxide" (PDF). Chemical Communications. 48 (10): 1392–1399. doi:10.1039/c1cc15393e. PMID 22116300.
- ^ "Gases - Densities". Engineering Toolbox. Retrieved 21 November 2020.
- ^ "Phase change data for Carbon dioxide". National Institute of Standards and Technology. Retrieved 21 January 2008.
- ^ Kudryavtseva I.V., Kamotskii V.I., Rykov S.V., Rykov V.A., "Calculation Carbon Dioxide Line of Phase Equilibrium", Processes and equipment for food production, Number 4(18), 2013
- ^ Santoro, M.; Gorelli, FA; Bini, R; Ruocco, G; Scandolo, S; Crichton, WA (2006). "Amorphous silica-like carbon dioxide". Nature. 441 (7095): 857–860. Bibcode:2006Natur.441..857S. doi:10.1038/nature04879. PMID 16778885. S2CID 4363092.
- ^ a b Pierantozzi, Ronald (2001). "Carbon Dioxide". Kirk-Othmer Encyclopedia of Chemical Technology. Wiley. doi:10.1002/0471238961.0301180216090518.a01.pub2. ISBN 978-0-471-23896-6.
- ^ Strassburger, Julius (1969). Blast Furnace Theory and Practice. New York: American Institute of Mining, Metallurgical, and Petroleum Engineers. ISBN 978-0-677-10420-1.
- ^ Topham, Susan (2000). "Carbon Dioxide". Ullmann's Encyclopedia of Industrial Chemistry. doi:10.1002/14356007.a05_165. ISBN 3527306730.
- ^ "CO2 shortage: Food industry calls for government action". BBC. 21 June 2018.
- ^ "Collecting and using biogas from landfills". U.S. Energy Information Administration. 11 January 2017. Retrieved 22 November 2015.
- ^ "Facts About Landfill Gas" (PDF). U.S. Environmental Protection Agency. January 2000.
- ^ "IPCC Special Report on Carbon dioxide Capture and Storage" (PDF). The Intergovernmental Panel on Climate Change. Archived from the original (PDF) on 24 September 2015. Retrieved 4 September 2015.
- ^ Morrison, R.T. and Boyd, R.N. (1983). Organic Chemistry (4th ed.). Allyn and Bacon. pp. 976–977. ISBN 978-0-205-05838-9.CS1 maint: multiple names: authors list (link)
- ^ Badwal, Sukhvinder P. S.; Giddey, Sarbjit S.; Munnings, Christopher; Bhatt, Anand I.; Hollenkamp, Anthony F. (24 September 2014). "Emerging electrochemical energy conversion and storage technologies (open access)". Frontiers in Chemistry. 2: 79. Bibcode:2014FrCh....2...79B. doi:10.3389/fchem.2014.00079. PMC 4174133. PMID 25309898.
- ^ UK Food Standards Agency: "Current EU approved additives and their E Numbers". Retrieved 27 October 2011.
- ^ US Food and Drug Administration: "Food Additive Status List". Retrieved 13 June 2015.
- ^ Australia New Zealand Food Standards Code"Standard 1.2.4 – Labelling of ingredients". Retrieved 27 October 2011.
- ^ Futurific Leading Indicators Magazine. 1. CRAES LLC. ISBN 978-0-9847670-1-4.
- ^ Vijay, G. Padma (25 September 2015). Indian Breads: A Comprehensive Guide to Traditional and Innovative Indian Breads. Westland. ISBN 978-93-85724-46-6.
- ^ "Scientists Discover Protein Receptor For Carbonation Taste". ScienceDaily. 16 October 2009. Retrieved 29 March 2020.
- ^ Andy Coghlan (3 February 2018). "A more humane way of slaughtering chickens might get EU approval". New Scientist.
- ^ "What is CO2 stunning?". RSPCA. Archived from the original on 9 April 2014.
- ^ a b Campbell, Archie (10 March 2018). "Humane execution and the fear of the tumbril". New Scientist.
- ^ Nordestgaard, B.G.; Rostgaard, J. (1985). "Critical‐point drying versus freeze drying for scanning electron microscopy: a quantitative and qualitative study on isolated hepatocytes". Journal of Microscopy. 137 (2): 189–207. doi:10.1111/j.1365-2818.1985.tb02577.x. PMID 3989858. S2CID 32065173.
- ^ National Fire Protection Association Code 12
- ^ Carbon Dioxide as a Fire Suppressant: Examining the Risks, US EPA. 2000.
- ^ Whiting, David; Roll, Michael; Vickerman, Larry (August 2010). "Plant Growth Factors: Photosynthesis, Respiration, and Transpiration". CMG GardenNotes. Colorado Master Gardener Program. Archived from the original on 2 September 2014. Retrieved 10 October 2011.
- ^ Waggoner, Paul E. (February 1994). "Carbon dioxide". How Much Land Can Ten Billion People Spare for Nature?. Retrieved 10 October 2011.
- ^ Stafford, Ned (7 February 2007). "Future crops: The other greenhouse effect". Nature. 448 (7153): 526–528. Bibcode:2007Natur.448..526S. doi:10.1038/448526a. PMID 17671477.
- ^ "Appendix A: CO2 for use in enhanced oil recovery (EOR)". Accelerating the uptake of CCS: industrial use of captured carbon dioxide. Global CCS Institute. 20 December 2011. Retrieved 2 January 2017.
- ^ Austell, J Michael (2005). "CO2 for Enhanced Oil Recovery Needs – Enhanced Fiscal Incentives". Exploration & Production: The Oil & Gas Review. Archived from the original on 7 February 2012. Retrieved 28 September 2007.
- ^ "Enhanced coal bed methane recovery". ETH Zurich. 31 August 2006. Archived from the original on 6 July 2011.
- ^ Clayton, Mark (11 January 2006). "Algae – like a breath mint for smokestacks". The Christian Science Monitor. Retrieved 11 October 2007.
- ^ Atsum, Shota; Higashide, Wendy; Liauo, James C. (November 2009). "Direct photosynthetic recycling of carbon dioxide to isobutyraldehyde". Nature Biotechnology. 27 (12): 1177–1180. doi:10.1038/nbt.1586. PMID 19915552. S2CID 1492698.
- ^ "The Coca-Cola Company Announces Adoption of HFC-Free Insulation in Refrigeration Units to Combat Global Warming". The Coca-Cola Company. 5 June 2006. Retrieved 11 October 2007.
- ^ "Modine reinforces its CO2 research efforts". R744.com. 28 June 2007. Archived from the original on 10 February 2008.
- ^ TCE, the Chemical Engineer. Institution of Chemical Engineers. 1990.
- ^ "2020 AVMA Guidelines for the Euthanasia of Animals" (PDF). Retrieved 22 August 2020.
- ^ "Monthly Average Mauna Loa CO2". National Oceanic and Atmospheric Administration Earth System Research Laboratory, Global Monitoring Division.
- ^ Tans, Pieter (6 May 2019) "Annual CO2 mole fraction increase (ppm)" for 1959–2018. National Oceanic and Atmospheric Administration Earth System Research Laboratory, Global Monitoring Division (additional details.)
- ^ National Oceanic & Atmospheric Administration (NOAA) – Earth System Research Laboratory (ESRL), Trends in Carbon Dioxide: Globally averaged marine surface monthly mean data Values given are dry air mole fractions expressed in parts per million (ppm). For an ideal gas mixture this is equivalent to parts per million by volume (ppmv).
- ^ Pashley, Alex (10 March 2016). "CO2 levels make largest recorded annual leap, Noaa data shows". The Guardian. Retrieved 14 March 2016.
- ^ George, K.; Ziska, L.H.; Bunce, J.A.; Quebedeaux, B. (2007). "Elevated atmospheric CO2 concentration and temperature across an urban–rural transect". Atmospheric Environment. 41 (35): 7654–7665. Bibcode:2007AtmEn..41.7654G. doi:10.1016/j.atmosenv.2007.08.018.
- ^ Li, Anthony H. F. (2016). "Hopes of Limiting Global Warming?". China Perspectives. 2016: 49–54. doi:10.4000/chinaperspectives.6924.
- ^ a b "The NOAA Annual Greenhouse Gas Index (AGGI) - An Introduction". NOAA Global Monitoring Laboratory/Earth System Research Laboratories. Retrieved 18 December 2020.
- ^ a b Friedlingstein, Pierre; et al. (2019). "Global Carbon Budget 2019". Earth System Science Data. 11 (4): 1783–1838. Bibcode:2019ESSD...11.1783F. doi:10.5194/essd-11-1783-2019..
- ^ "Global Warming Frequently Asked Questions". Climate.gov. NOAA. Archived from the original on 11 January 2017.
- ^ Gerlach, T.M. (4 June 1991). "Present-day CO2 emissions from volcanoes". Eos, Transactions, American Geophysical Union. 72 (23): 249, 254–255. Bibcode:1991EOSTr..72..249.. doi:10.1029/90EO10192.
- ^ a b Buis, Alan; Ramsayer, Kate; Rasmussen, Carol (12 November 2015). "A breathing planet, off balance". NASA. Retrieved 13 November 2015.
- ^ a b Staff (12 November 2015). "Audio (66:01) – NASA News Conference – Carbon & Climate Telecon". NASA. Retrieved 12 November 2015.
- ^ a b St. Fleur, Nicholas (10 November 2015). "Atmospheric Greenhouse Gas Levels Hit Record, Report Says". The New York Times. Retrieved 11 November 2015.
- ^ a b Ritter, Karl (9 November 2015). "UK: In 1st, global temps average could be 1 degree C higher". Associated Press. Retrieved 11 November 2015.
- ^ Atkins, Peter; de Paula, Julio (2006). Atkins' Physical Chemistry (8th ed.). W.H. Freeman. p. 462. ISBN 978-0-7167-8759-4.
- ^ UCAR (2012). "Carbon Dioxide Absorbs and Re-emits Infrared Radiation". UCAR Center for Science Education. Retrieved 9 September 2017.
- ^ David Archer (15 March 2005). "How long will global warming last?". RealClimate. Retrieved 5 March 2021.
- ^ Archer, David (2009). "Atmospheric lifetime of fossil fuel carbon dioxide". Annual Review of Earth and Planetary Sciences. 37 (1): 117–34. Bibcode:2009AREPS..37..117A. doi:10.1146/annurev.earth.031208.100206.
- ^ Joos, F., Roth, R., Fuglestvedt, J.D.; et al. (2013). "Carbon dioxide and climate impulse response functions for the computation of greenhouse gas metrics: A multi-model analysis". Atmospheric Chemistry and Physics. 13 (5): 2793–2825. doi:10.5194/acpd-12-19799-2012.CS1 maint: multiple names: authors list (link)
- ^ "Figure 8.SM.4" (PDF). Intergovernmental Panel on Climate Change Fifth Assessment Report. p. 8SM-16.
- ^ Genthon, G.; Barnola, J.M.; Raynaud, D.; Lorius, C.; Jouzel, J.; Barkov, N.I.; Korotkevich, Y.S.; Kotlyakov, V.M. (1987). "Vostok ice core: climatic response to CO2 and orbital forcing changes over the last climatic cycle". Nature. 329 (6138): 414–418. Bibcode:1987Natur.329..414G. doi:10.1038/329414a0. S2CID 4333499.
- ^ "Climate and CO2 in the Atmosphere". Retrieved 10 October 2007.
- ^ Berner, Robert A.; Kothavala, Zavareth (2001). "GEOCARB III: A revised model of atmospheric CO2 over Phanerozoic Time" (PDF). American Journal of Science. 301 (2): 182–204. Bibcode:2001AmJS..301..182B. CiteSeerX 10.1.1.393.582. doi:10.2475/ajs.301.2.182. Retrieved 15 February 2008.
- ^ van Gardingen, P.R.; Grace, J.; Jeffree, C.E.; Byari, S.H.; Miglietta, F.; Raschi, A.; Bettarini, I. (1997). "Long-term effects of enhanced CO2 concentrations on leaf gas exchange: research opportunities using CO2 springs". In Raschi, A.; Miglietta, F.; Tognetti, R.; van Gardingen, P.R. (eds.). Plant responses to elevated CO2: Evidence from natural springs. Cambridge: Cambridge University Press. pp. 69–86. ISBN 978-0-521-58203-2.
- ^ Martini, M. (1997). "CO2 emissions in volcanic areas: case histories and hazards". In Raschi, A.; Miglietta, F.; Tognetti, R.; van Gardingen, P.R. (eds.). Plant responses to elevated CO2: Evidence from natural springs. Cambridge: Cambridge University Press. pp. 69–86. ISBN 978-0-521-58203-2.
- ^ Doney, Scott C.; Levine, Naomi M. (29 November 2006). "How Long Can the Ocean Slow Global Warming?". Oceanus. Retrieved 21 November 2007.
- ^ Nienhuis, S.; Palmer, A.; Harley, C. (2010). "Elevated CO2 affects shell dissolution rate but not calcification rate in a marine snail". Proceedings of the Royal Society B: Biological Sciences. 277 (1693): 2553–2558. doi:10.1098/rspb.2010.0206. PMC 2894921. PMID 20392726.
- ^ Gattuso, J.-P.; Frankignoulle, M.; Bourge, I.; Romaine, S. & Buddemeier, R.W. (1998). "Effect of calcium carbonate saturation of seawater on coral calcification". Global and Planetary Change. 18 (1–2): 37–46. Bibcode:1998GPC....18...37G. doi:10.1016/S0921-8181(98)00035-6.
- ^ Gattuso, J.-P.; Allemand, D.; Frankignoulle, M (1999). "Photosynthesis and calcification at cellular, organismal and community levels in coral reefs: a review on interactions and control by carbonate chemistry". American Zoologist. 39: 160–183. doi:10.1093/icb/39.1.160.
- ^ Langdon, C; Atkinson, M. J. (2005). "Effect of elevated pCO2 on photosynthesis and calcification of corals and interactions with seasonal change in temperature/irradiance and nutrient enrichment". Journal of Geophysical Research. 110 (C09S07): C09S07. Bibcode:2005JGRC..110.9S07L. doi:10.1029/2004JC002576.
- ^ Riebesell, Ulf; Zondervan, Ingrid; Rost, Björn; Tortell, Philippe D.; Zeebe, Richard E. & François M.M. Morel (2000). "Reduced calcification of marine plankton in response to increased atmospheric CO2" (PDF). Nature. 407 (6802): 364–367. Bibcode:2000Natur.407..364R. doi:10.1038/35030078. PMID 11014189. S2CID 4426501.
- ^ Zondervan, I.; Zeebe, R.E.; Rost, B.; Rieblesell, U. (2001). "Decreasing marine biogenic calcification: a negative feedback on rising atmospheric CO2" (PDF). Global Biogeochemical Cycles. 15 (2): 507–516. Bibcode:2001GBioC..15..507Z. doi:10.1029/2000GB001321.
- ^ Zondervan, I.; Rost, B.; Rieblesell, U. (2002). "Effect of CO2 concentration on the PIC/POC ratio in the coccolithophore Emiliania huxleyi grown under light limiting conditions and different day lengths" (PDF). Journal of Experimental Marine Biology and Ecology. 272 (1): 55–70. doi:10.1016/S0022-0981(02)00037-0.
- ^ Delille, B.; Harlay, J.; Zondervan, I.; Jacquet, S.; Chou, L.; Wollast, R.; Bellerby, R.G.J.; Frankignoulle, M.; Borges, A.V.; Riebesell, U.; Gattuso, J.-P. (2005). "Response of primary production and calcification to changes of pCO2 during experimental blooms of the coccolithophorid Emiliania huxleyi". Global Biogeochemical Cycles. 19 (2): GB2023. Bibcode:2005GBioC..19.2023D. doi:10.1029/2004GB002318.
- ^ Kuffner, I.B.; Andersson, A.J.; Jokiel, P.L.; Rodgers, K.S.; Mackenzie, F.T. (2007). "Decreased abundance of crustose coralline algae due to ocean acidification". Nature Geoscience. 1 (2): 114–117. Bibcode:2008NatGe...1..114K. doi:10.1038/ngeo100.
- ^ Phillips, Graham; Chris Branagan (13 September 2007). "Ocean Acidification – The BIG global warming story". ABC TV Science: Catalyst. Australian Broadcasting Corporation. Retrieved 18 September 2007.
- ^ Gazeau, F.; Quiblier, C.; Jansen, J.M.; Gattuso, J.-P.; Middelburg, J.J. & Heip, C.H.R. (2007). "Impact of elevated CO2 on shellfish calcification". Geophysical Research Letters. 34 (7): L07603. Bibcode:2007GeoRL..34.7603G. CiteSeerX 10.1.1.326.1630. doi:10.1029/2006GL028554. hdl:20.500.11755/a8941c6a-6d0b-43d5-ba0d-157a7aa05668.
- ^ Comeau, C.; Gorsky, G.; Jeffree, R.; Teyssié, J.-L.; Gattuso, J.-P. (2009). "Impact of ocean acidification on a key Arctic pelagic mollusc (Limacina helicina)". Biogeosciences. 6 (9): 1877–1882. Bibcode:2009BGeo....6.1877C. doi:10.5194/bg-6-1877-2009.
- ^ Duana, Zhenhao; Rui Sun (2003). "An improved model calculating CO2 solubility in pure water and aqueous NaCl solutions from 273 to 533 K and from 0 to 2000 bar". Chemical Geology. 193 (3–4): 257–271. Bibcode:2003ChGeo.193..257D. doi:10.1016/S0009-2541(02)00263-2.
- ^ Cai, W.-J.; Chen, L.; Chen, B.; Gao, Z.; et al. (2010). "Decrease in the CO2 Uptake Capacity in an Ice-Free Arctic Ocean Basin". Science. 329 (5991): 556–559. Bibcode:2010Sci...329..556C. doi:10.1126/science.1189338. PMID 20651119. S2CID 206526452.
- ^ Garrison, Tom (2004). Oceanography: An Invitation to Marine Science. Thomson Brooks. p. 125. ISBN 978-0-534-40887-9.
- ^ Ries, J.B.; Cohen, A.L.; McCorkle, D.C. (2009). "Marine calcifiers exhibit mixed responses to CO2-induced ocean acidification". Geology. 37 (12): 1131–1134. Bibcode:2009Geo....37.1131R. doi:10.1130/G30210A.1.
- ^ Climate Change 2007: Synthesis Report, IPCC
- ^ "PMEL Ocean Acidification Home Page". Pmel.noaa.gov. Retrieved 14 January 2014.
- ^ Lupton, J.; Lilley, M.; Butterfield, D.; Evans, L.; Embley, R.; Olson, E.; Proskurowski, G.; Resing, J.; Roe, K.; Greene, R.; Lebon, G. (2004). "Liquid Carbon Dioxide Venting at the Champagne Hydrothermal Site, NW Eifuku Volcano, Mariana Arc". American Geophysical Union. Fall. Meeting (abstract #V43F–08): V43F–08. Bibcode:2004AGUFM.V43F..08L.
- ^ Fumio Inagaki (2006). "Microbial community in a sediment-hosted CO2 lake of the southern Okinawa Trough hydrothermal system". PNAS. 103 (38): 14164–14169. Bibcode:2006PNAS..10314164I. doi:10.1073/pnas.0606083103. PMC 1599929. PMID 16959888. Videos can be downloaded at Supporting Information.
- ^ Dhingra A, Portis AR, Daniell H (2004). "Enhanced translation of a chloroplast-expressed RbcS gene restores small subunit levels and photosynthesis in nuclear RbcS antisense plants". Proc. Natl. Acad. Sci. U.S.A. 101 (16): 6315–6320. Bibcode:2004PNAS..101.6315D. doi:10.1073/pnas.0400981101. PMC 395966. PMID 15067115.
(Rubisco) is the most prevalent enzyme on this planet, accounting for 30–50% of total soluble protein in the chloroplast;
- ^ G., Falkowski, Paul; H., Knoll, Andrew; (2006.01.), Symposium (1 January 2007). Evolution of primary producers in the sea. Elsevier, Academic Press. ISBN 978-0-12-370518-1. OCLC 845654016.CS1 maint: numeric names: authors list (link)
- ^ Blom, T.J.; W.A. Straver; F.J. Ingratta; Shalin Khosla; Wayne Brown (December 2002). "Carbon Dioxide In Greenhouses". Retrieved 12 June 2007.
- ^ Ainsworth, Elizabeth A. (2008). "Rice production in a changing climate: a meta-analysis of responses to elevated carbon dioxide and elevated ozone concentration" (PDF). Global Change Biology. 14 (7): 1642–1650. Bibcode:2008GCBio..14.1642A. doi:10.1111/j.1365-2486.2008.01594.x. Archived from the original (PDF) on 19 July 2011.
- ^ Long, S.P.; Ainsworth, E.A.; Leakey, A.D.; Nösberger, J.; Ort, D.R. (2006). "Food for thought: lower-than-expected crop yield stimulation with rising CO2 concentrations" (PDF). Science. 312 (5782): 1918–1921. Bibcode:2006Sci...312.1918L. CiteSeerX 10.1.1.542.5784. doi:10.1126/science.1114722. PMID 16809532. S2CID 2232629.
- ^ F. Woodward; C. Kelly (1995). "The influence of CO2 concentration on stomatal density". New Phytologist. 131 (3): 311–327. doi:10.1111/j.1469-8137.1995.tb03067.x.
- ^ Drake, Bert G.; Gonzalez-Meler, Miquel A.; Long, Steve P. (1997). "More efficient plants: A consequence of rising atmospheric CO2?". Annual Review of Plant Physiology and Plant Molecular Biology. 48 (1): 609–639. doi:10.1146/annurev.arplant.48.1.609. PMID 15012276. S2CID 33415877.
- ^ Loladze, I (2002). "Rising atmospheric CO2 and human nutrition: toward globally imbalanced plant stoichiometry?". Trends in Ecology & Evolution. 17 (10): 457–461. doi:10.1016/S0169-5347(02)02587-9.
- ^ Carlos E. Coviella; John T. Trumble (1999). "Effects of Elevated Atmospheric Carbon Dioxide on Insect-Plant Interactions". Conservation Biology. 13 (4): 700–712. doi:10.1046/j.1523-1739.1999.98267.x. JSTOR 2641685. S2CID 52262618.
- ^ Davey, M.P.; Harmens, H.; Ashenden, T.W.; Edwards, R.; Baxter, R. (2007). "Species-specific effects of elevated CO2 on resource allocation in Plantago maritima and Armeria maritima". Biochemical Systematics and Ecology. 35 (3): 121–129. doi:10.1016/j.bse.2006.09.004.
- ^ Davey, M.; Bryant, D.N.; Cummins, I.; Ashenden, T.W.; Gates, P.; Baxter, R.; Edwards, R. (2004). "Effects of elevated CO2 on the vasculature and phenolic secondary metabolism of Plantago maritima". Phytochemistry. 65 (15): 2197–2204. doi:10.1016/j.phytochem.2004.06.016. PMID 15587703.
- ^ "Global Environment Division Greenhouse Gas Assessment Handbook – A Practical Guidance Document for the Assessment of Project-level Greenhouse Gas Emissions". World Bank. Archived from the original on 3 June 2016. Retrieved 10 November 2007.
- ^ Luyssaert, Sebastiaan; Schulze, E.-Detlef; Börner, Annett; Knohl, Alexander; Hessenmöller, Dominik; Law, Beverly E.; Ciais, Philippe; Grace, John (2008). "Old-growth forests as global carbon sinks". Nature. 455 (7210): 213–215. Bibcode:2008Natur.455..213L. doi:10.1038/nature07276. PMID 18784722. S2CID 4424430.
- ^ Falkowski P, Scholes RJ, Boyle E, Canadell J, Canfield D, Elser J, Gruber N, Hibbard K, Högberg P, Linder S, Mackenzie FT, Moore B 3rd, Pedersen T, Rosenthal Y, Seitzinger S, Smetacek V, Steffen W (2000). "The global carbon cycle: a test of our knowledge of earth as a system". Science. 290 (5490): 291–296. Bibcode:2000Sci...290..291F. doi:10.1126/science.290.5490.291. PMID 11030643. S2CID 1779934.
- ^ a b Friedman, Daniel. Toxicity of Carbon Dioxide Gas Exposure, CO2 Poisoning Symptoms, Carbon Dioxide Exposure Limits, and Links to Toxic Gas Testing Procedures. InspectAPedia
- ^ "CarbonTracker CT2011_oi (Graphical map of CO2)". esrl.noaa.gov.
- ^ "Carbon Dioxide as a Fire Suppressant: Examining the Risks". U.S. Environmental Protection Agency. Archived from the original on 2 October 2015.
- ^ Volcano Under the City. PBS.org (1 November 2005).
- ^ Glatte Jr H.A.; Motsay G.J.; Welch B.E. (1967). "Carbon Dioxide Tolerance Studies". Brooks AFB, TX School of Aerospace Medicine Technical Report. SAM-TR-67-77. Archived from the original on 9 May 2008. Retrieved 2 May 2008.
- ^ Lambertsen, C.J. (1971). "Carbon Dioxide Tolerance and Toxicity". Environmental Biomedical Stress Data Center, Institute for Environmental Medicine, University of Pennsylvania Medical Center. IFEM. Report No. 2-71. Archived from the original on 24 July 2011. Retrieved 2 May 2008.
- ^ a b Satish U.; Mendell M.J.; Shekhar K.; Hotchi T.; Sullivan D.; Streufert S.; Fisk W.J. (2012). "Is CO2 an Indoor Pollutant? Direct Effects of Low-to-Moderate CO2 Concentrations on Human Decision-Making Performance" (PDF). Environmental Health Perspectives. 120 (12): 1671–1677. doi:10.1289/ehp.1104789. PMC 3548274. PMID 23008272. Archived from the original (PDF) on 5 March 2016. Retrieved 11 December 2014.
- ^ a b Joseph G. Allen; Piers MacNaughton; Usha Satish; Suresh Santanam; Jose Vallarino; John D. Spengler (2016). "Associations of Cognitive Function Scores with Carbon Dioxide, Ventilation, and Volatile Organic Compound Exposures in Office Workers: A Controlled Exposure Study of Green and Conventional Office Environments". Environmental Health Perspectives. 124 (6): 805–812. doi:10.1289/ehp.1510037. PMC 4892924. PMID 26502459.
- ^ "Exposure Limits for Carbon Dioxide Gas – CO2 Limits". InspectAPedia.com.
- ^ Law J.; Watkins S.; Alexander, D. (2010). "In-Flight Carbon Dioxide Exposures and Related Symptoms: Associations, Susceptibility and Operational Implications" (PDF). NASA Technical Report. TP–2010–216126. Archived from the original (PDF) on 27 June 2011. Retrieved 26 August 2014.
- ^ Schaefer, K.E. (1979). "Effect of Prolonged Exposure to 0.5% CO2 on Kidney Calcification and Ultrastructure of Lungs". Undersea Biomed Res. S6: 155–161. PMID 505623. Retrieved 19 October 2014.
- ^ Allen Joseph G.; MacNaughton Piers; Satish Usha; Santanam Suresh; Vallarino Jose; Spengler John D. (1 June 2016). "Associations of Cognitive Function Scores with Carbon Dioxide, Ventilation, and Volatile Organic Compound Exposures in Office Workers: A Controlled Exposure Study of Green and Conventional Office Environments". Environmental Health Perspectives. 124 (6): 805–812. doi:10.1289/ehp.1510037. PMC 4892924. PMID 26502459.
- ^ Romm, Joe (26 October 2015). "Exclusive: Elevated CO2 Levels Directly Affect Human Cognition, New Harvard Study Shows". ThinkProgress. Retrieved 14 October 2019.
- ^ Didenko, Katerina (29 February 2020) Three die in dry-ice incident at Moscow pool party. BBC
- ^ a b "ABG (Arterial Blood Gas)". Brookside Associates. Retrieved 2 January 2017.
- ^ "How much carbon dioxide do humans contribute through breathing?". EPA.gov. Archived from the original on 2 February 2011. Retrieved 30 April 2009.
- ^ Charles Henrickson (2005). Chemistry. Cliffs Notes. ISBN 978-0-7645-7419-1.
Further reading
- Seppänen, O.A.; Fisk, W.J.; Mendell, M.J. (December 1999). "Association of Ventilation Rates and CO2 Concentrations with Health and Other Responses in Commercial and Institutional Buildings" (PDF). Indoor Air. 9 (4): 226–252. doi:10.1111/j.1600-0668.1999.00003.x. PMID 10649857. Archived from the original (PDF) on 27 December 2016.
- Shendell, D.G.; Prill, R.; Fisk, W.J.; Apte, M.G.; Blake, D.; Faulkner, D. (October 2004). "Associations between classroom CO2 concentrations and student attendance in Washington and Idaho" (PDF). Indoor Air. 14 (5): 333–341. doi:10.1111/j.1600-0668.2004.00251.x. hdl:2376/5954. PMID 15330793. Archived from the original (PDF) on 27 December 2016.
- Soentgen, Jens (February 2014). "Hot air: The science and politics of CO2". Global Environment. 7 (1): 134–171. doi:10.3197/197337314X13927191904925.
- Good plant design and operation for onshore carbon capture installations and onshore pipelines: a recommended practice guidance document. Global CCS Institute. Energy Institute and Global Carbon Capture and Storage Institute. 1 September 2010. Archived from the original on 7 November 2018. Retrieved 2 January 2018.
This new title is an essential guide for engineers, managers, procurement specialists and designers working on global carbon capture and storage projects.
External links
| Wikimedia Commons has media related to Carbon dioxide. |
| Library resources about Carbon dioxide |
|
- International Chemical Safety Card 0021
- Current global map of carbon dioxide concentration
- [1] by Amerigas.
- CDC – NIOSH Pocket Guide to Chemical Hazards – Carbon Dioxide
- CO2 Carbon Dioxide Properties, Uses, Applications
- Dry Ice information
- Trends in Atmospheric Carbon Dioxide (NOAA)
- "A War Gas That Saves Lives". Popular Science, June 1942, pp. 53–57.
- Reactions, Thermochemistry, Uses, and Function of Carbon Dioxide
- Carbon Dioxide – Part One and Carbon Dioxide – Part Two at The Periodic Table of Videos (University of Nottingham)
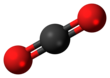

![K_{\mathrm {h} }={\frac {\rm {[H_{2}CO_{3}]}}{\rm {[CO_{2}(aq)]}}}=1.70\times 10^{-3}](https://wikimedia.org/api/rest_v1/media/math/render/svg/880be9280cefa51b14dc80f037e4296c81a15e6b)
![K_{a1}={\frac {\rm {[HCO_{3}^{-}][H^{+}]}}{\rm {[H_{2}CO_{3}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/81950791f8b36374241d6fa82828522bd875668a)
![K_{\mathrm {a1} }{\rm {(apparent)}}={\frac {\rm {[HCO_{3}^{-}][H^{+}]}}{\rm {[H_{2}CO_{3}]+[CO_{2}(aq)]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d4cac9482fd21cb58444f2621f245d7b1d835485)