Factor de cable
 | |
| Identificadores | |
|---|---|
| |
Modelo 3D ( JSmol ) | |
PubChem CID | |
| |
| Propiedades | |
| C 130 H 250 O 15 | |
| Masa molar | 2 053 0,415 g · mol -1 |
Salvo que se indique lo contrario, los datos se proporcionan para materiales en su estado estándar (a 25 ° C [77 ° F], 100 kPa). | |
| Referencias de Infobox | |
El factor del cordón , o dimicolato de trehalosa , es una molécula de glicolípido que se encuentra en la pared celular de Mycobacterium tuberculosis y especies similares. Es el lípido principal que se encuentra en el exterior de las células de M. tuberculosis . [1] El factor cordón influye en la disposición de las células de M. tuberculosis en formaciones largas y delgadas, lo que le da su nombre. [2] El factor del cordón es virulento hacia las células de los mamíferos y es fundamental para la supervivencia de M. tuberculosis en los hospedadores, pero no fuera de los hospedadores. [3] [4] Se ha observado que el factor del cordón influye en las respuestas inmunitarias , induce la formación degranulomas e inhiben el crecimiento tumoral . [5] Se cree que el fármaco antimicobacteriano SQ109 inhibe los niveles de producción de TDM y de esta manera interrumpe el ensamblaje de la pared celular. [6]
Estructura
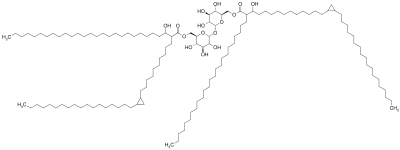
Una molécula de factor del cordón está compuesta por una molécula de azúcar , trehalosa (un disacárido ), compuesta por dos moléculas de glucosa unidas entre sí. La trehalosa se esterifica a dos residuos de ácido micólico. [7] [8] Uno de los dos residuos de ácido micólico está unido al sexto carbono de una glucosa, mientras que el otro residuo de ácido micólico está unido al sexto carbono de la otra glucosa. [7] Por lo tanto, el factor del cordón también se denomina trehalosa-6,6'-dimicolato. [7] La cadena de carbono de los residuos de ácido micólico varía en longitud dependiendo de la especie de bacteria en la que se encuentra, pero el rango general es de 20 a 80 átomos de carbono. [3]La naturaleza anfifílica del factor del cordón conduce a estructuras variables cuando muchas moléculas del factor del cordón están muy próximas. [3] Sobre una superficie hidrófoba, forman espontáneamente una monocapa cristalina. [9] Esta monocapa cristalina es extremadamente duradera y firme; es más fuerte que cualquier otro anfífilo encontrado en biología. [10] Esta monocapa también se forma en superficies de aceite-agua, plástico-agua y aire-agua. [1] En un ambiente acuoso libre de superficies hidrofóbicas, el factor de cordón forma una micela. [11] Además, el factor del cordón se entrelaza con el lipoarabinomanano (LAM), que también se encuentra en la superficie de las células de M. tuberculosis , para formar una bicapa asimétrica.[1] [12] Estas propiedades hacen que las bacterias que producen el factor cordón se conviertan en filamentos largos y entrelazados, dándoles una apariencia de cuerda o cordón cuando se tiñen y se ven a través de un microscopio (de ahí el nombre). [13]
Evidencia de virulencia
Se encuentra una gran cantidad de factor del cordón en M. tuberculosis virulento , pero no en M. tuberculosis avirulento . [1] Además, M. tuberculosis pierde su virulencia si su capacidad para producir moléculas de factor del cordón se ve comprometida. [1] En consecuencia, cuando se eliminan todos los lípidos del exterior de las células de M. tuberculosis , la supervivencia de la bacteria se reduce dentro de un huésped. [14] Cuando el factor del cordón se agrega nuevamente a esas células, M. tuberculosis sobrevive a una tasa similar a la de su estado original. [14] El factor del cordón aumenta la virulencia de la tuberculosis en ratones, pero tiene un efecto mínimo sobre otras infecciones.[1]
Función biológica
La función del factor del cordón depende en gran medida del entorno en el que se encuentre y, por lo tanto, de su conformación. [15] Esto es evidente, ya que el factor cordón es dañino cuando se inyecta con una solución de aceite, pero no cuando lo es con una solución salina, incluso en cantidades muy grandes. [15] El factor de cordón protege a M. tuberculosis de las defensas del huésped. [1] Específicamente, el factor del cordón en la superficie de las células de M. tuberculosis previene la fusión entre las vesículas fagosómicas que contienen las células de M. tuberculosis y los lisosomas que las destruirían. [5] [16]Los componentes individuales del factor del cordón, los azúcares de trehalosa y los residuos de ácido micólico, no pueden demostrar esta actividad; las moléculas del factor del cordón deben estar completamente intactas. [5] La actividad de la esterasa que se dirige al factor del cordón produce la lisis de las células de M. tuberculosis . [17] Sin embargo, las células de M. tuberculosis aún deben estar vivas para evitar esta fusión; las células muertas por calor con factor de cordón no pueden evitar ser digeridas. [16] Esto sugiere que se requiere una molécula adicional de M. tuberculosis . [16] Independientemente, la capacidad del factor del cordón para prevenir la fusión está relacionada con una mayor fuerza de hidratación o mediante un impedimento estérico. [5]El factor del cordón permanece en la superficie de las células de M. tuberculosis hasta que se asocia con una gota de lípido, donde forma una monocapa. [15] Entonces, como el factor de cable está en una configuración monocapa, tiene una función diferente; se vuelve fatal o dañino para el organismo huésped. [18] Los macrófagos pueden morir cuando entran en contacto con monocapas de factor de cordón, pero no cuando el factor de cordón se encuentra en otras configuraciones. [1] A medida que aumenta el área de superficie de la monocapa del factor del cordón, también lo hace su toxicidad. [19] También se ha demostrado que la longitud de la cadena de carbono en el factor cordón afecta la toxicidad; una cadena más larga muestra una mayor toxicidad. [20] Además, el fibrinógenoha demostrado que se adsorbe en monocapas de factor de cordón y actúa como cofactor de sus efectos biológicos. [21]
Respuestas del huésped y citocinas
Numerosas respuestas que varían en efecto son el resultado de la presencia del factor del cordón en las células huésped. Después de la exposición al factor del cordón durante 2 horas, se regulan al alza 125 genes en el genoma del ratón. [22] Después de 24 horas, 503 genes se regulan positivamente y 162 genes se regulan negativamente. [22] No se conocen completamente los mecanismos químicos exactos por los cuales actúa el factor del cordón. Sin embargo, es probable que los ácidos micólicos del factor del cordón deban sufrir una modificación con ciclopropilo para dar lugar a una respuesta del sistema inmunológico del huésped a la infección inicial. [23] Además, los enlaces éster en el factor cordón son importantes por sus efectos tóxicos. [24] Existe evidencia de que el factor del cordón es reconocido por el receptor de Mincle , que se encuentra en los macrófagos.[25] [26] Un receptor de Mincle activado conduce a una vía que finalmente da como resultado la producción de varias citocinas . [27] [28] Estas citocinas pueden conducir a una mayor producción de citocinas que promueven respuestas inflamatorias. [29] El factor del cordón, a través del receptor de Mincle, también provoca el reclutamiento de neutrófilos, que también conducen a citocinas proinflamatorias. [30] Sin embargo, también hay evidencia de que el receptor tipo toll 2 (TLR2) junto con la proteína MyD-88 es responsable de la producción de citocinas en lugar del receptor Mincle. [22]
La presencia del factor del cordón aumenta la producción de las citocinas interleucina-12 (IL-12), interleucina-1 beta (IL-1β), interleucina-6 (IL-6), factor de necrosis tumoral (TNFα) y proteína inflamatoria de macrófagos-2 (MIP-2), que son todas citocinas proinflamatorias importantes para la formación de granulomas. [16] [27] [31] IL-12 es particularmente importante en la defensa contra M. tuberculosis ; sin él, M. tuberculosis se propaga sin obstáculos. [32] [33]La IL-12 desencadena la producción de más citocinas a través de las células T y las células asesinas naturales (NK), mientras que también conduce a células Th1 maduras y, por lo tanto, conduce a la inmunidad. [34] Luego, con IL-12 disponible, las células Th1 y las células NK producen moléculas de interferón gamma (IFN-γ) y posteriormente las liberan. [35] Las moléculas de IFN-γ, a su vez, activan los macrófagos. [36]
Cuando los macrófagos son activados por el factor del cordón, pueden organizarse en granulomas alrededor de las células de M. tuberculosis . [15] [37] Los macrófagos y neutrófilos activados también causan un aumento en el factor de crecimiento endotelial vascular (VEGF), que es importante para la angiogénesis, un paso en la formación de granulomas. [38] Los granulomas pueden formarse con o sin células T, lo que indica que pueden ser del tipo de cuerpo extraño o del tipo de hipersensibilidad. [36] Esto significa que el factor del cordón puede estimular una respuesta actuando como una molécula extraña o provocando reacciones dañinas del sistema inmunológico si el huésped ya está inmunizado. [36]Por tanto, el factor del cordón puede actuar como un irritante inespecífico o un antígeno dependiente de células T. [36] Los granulomas encierran las células de M. tuberculosis para detener la propagación de las bacterias, pero también permiten que las bacterias permanezcan en el huésped. [16] A partir de ahí, el tejido puede dañarse y la enfermedad puede transmitirse más con el factor del cordón. [39] Alternativamente, los macrófagos activados pueden matar las células de M. tuberculosis a través de intermediarios de nitrógeno reactivo para eliminar la infección. [40]
Además de inducir la formación de granulomas, los macrófagos activados que resultan de IL-12 e IFN-γ pueden limitar el crecimiento tumoral. [41] Además, la producción de factor de cordón de TNF-α, también conocida como caquectina, también puede inducir caquexia, o pérdida de peso, dentro de los huéspedes. [42] [43] El factor del cordón también aumenta la actividad NADasa en el huésped y, por lo tanto, reduce la NAD; En consecuencia, las enzimas que requieren NAD disminuyen su actividad. [3] El factor del cordón es capaz de obstruir la fosforilación oxidativa y la cadena de transporte de electrones en las membranas mitocondriales. [3] En ratones, se ha demostrado que el factor del cordón causa atrofia en el timo a través de la apoptosis; de manera similar, en conejos se produjo atrofia del timo y el bazo. [44] [45] Esta atrofia ocurre junto con la formación de granulomas, y si se altera la formación de granulomas, también lo hace la progresión de la atrofia. [45]
Aplicaciones y usos científicos
La infección por M. tuberculosis sigue siendo un problema grave en el mundo y el conocimiento del factor del cordón puede ser útil para controlar esta enfermedad. [23] Por ejemplo, la glicoproteína conocida como lactoferrina es capaz de mitigar la producción de citocinas y la formación de granulomas provocada por el factor del cordón. [46] Sin embargo, el factor del cordón puede servir como un modelo útil para todos los glicolípidos patógenos y, por lo tanto, puede proporcionar información sobre algo más que él mismo como factor de virulencia. [11] [47] Las perlas hidrofóbicas cubiertas con factor de cordón son una herramienta eficaz para dicha investigación; son capaces de reproducir la respuesta de un organismo al factor del cordón a partir de las células de M. tuberculosis . [11] [47]Las perlas de factor de cordón se crean y aplican fácilmente a los organismos para su estudio, y luego se recuperan fácilmente. [47]
Es posible formar liposomas de factor de cordón a través de una emulsión de agua; estos liposomas no son tóxicos y pueden usarse para mantener un suministro constante de macrófagos activados. [48] El factor del cordón bajo un control adecuado puede ser potencialmente útil en la lucha contra el cáncer porque la IL-12 y el IFN-γ pueden limitar el crecimiento de los tumores. [49]
Ver también
- Nocardia
Referencias
- ^ a b c d e f g h Hunter, RL; Olsen, MR; Jagannath, C; Actor, JK (otoño de 2006). "Múltiples funciones del factor del cordón en la patogenia de la tuberculosis primaria, secundaria y cavitaria, incluida una descripción revisada de la patología de la enfermedad secundaria". Anales de ciencia clínica y de laboratorio . 36 (4): 371–86. PMID 17127724 .
- ^ Saita, N .; Fujiwara, N .; Yano, I .; Soejima, K .; Kobayashi, K. (1 de octubre de 2000). "Trehalosa 6,6'-dimicolato (factor de cordón) de Mycobacterium tuberculosis induce la angiogénesis corneal en ratas" . Infección e inmunidad . 68 (10): 5991–5997. doi : 10.1128 / IAI.68.10.5991-5997.2000 . PMC 101563 . PMID 10992511 .
- ^ a b c d e Rajni; Rao, N; Meena, LS (2011). "Biosíntesis y comportamiento virulento de lípidos producidos por Mycobacterium tuberculosis: LAM y factor de cordón: una visión general" . Internacional de Investigación en Biotecnología . 2011 : 274693. doi : 10.4061 / 2011/274693 . PMC 3039431 . PMID 21350659 .
- ↑ Silva, CL; Ekizlerian, SM; Fazioli, RA (febrero de 1985). "Papel del factor del cordón en la modulación de la infección causada por micobacterias" . La Revista Estadounidense de Patología . 118 (2): 238–47. PMC 1887869 . PMID 3881973 .
- ^ a b c d Spargo, BJ; Crowe, LM; Ioneda, T; Beaman, BL; Crowe, JH (1 de febrero de 1991). "Factor de cordón (alfa, alfa-trehalosa 6,6'-dimicolato) inhibe la fusión entre vesículas de fosfolípidos" . Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 88 (3): 737–40. Código Bibliográfico : 1991PNAS ... 88..737S . doi : 10.1073 / pnas.88.3.737 . PMC 50888 . PMID 1992465 .
- ^ TAHLAN, K., R. WILSON, DB KASTRINSKY, K. ARORA, V. NAIR, E. FISCHER, SW BARNES, JR WALKER, D. ALLAND, CE BARRY a HI BOSHOFF. SQ109 se dirige a MmpL3, un transportador de membrana de monomicolato de trehalosa involucrado en la donación de ácido micólico al núcleo de la pared celular de Mycobacterium tuberculosis. Agentes antimicrobianos y quimioterapia. 2012-03-16, vol. 56, número 4, s. 1797-1809. DOI: 10.1128 / AAC.05708-11. http://aac.asm.org/cgi/doi/10.1128/AAC.05708-11
- ^ a b c NOLL, H; BLOCH, H; ASSELINEAU, J; LEDERER, E (mayo de 1956). "La estructura química del factor de cordón de Mycobacterium tuberculosis". Biochimica et Biophysica Acta . 20 (2): 299-309. doi : 10.1016 / 0006-3002 (56) 90289-x . PMID 13328853 .
- ^ Jonsson, BE; Gilljam, M .; Lindblad, A .; Ridell, M .; Wold, AE; Welinder-Olsson, C. (21 de marzo de 2007). "Epidemiología molecular de Mycobacterium abscessus, con especial atención a la fibrosis quística" . Revista de microbiología clínica . 45 (5): 1497–1504. doi : 10.1128 / JCM.02592-06 . PMC 1865885 . PMID 17376883 .
- ^ Retzinger, GS; Meredith, SC; Hunter, RL; Takayama, K; Kézdy, FJ (agosto de 1982). "Identificación del estado fisiológicamente activo del glicolípido micobacteriano trehalosa 6,6'-dimicolato y el papel del fibrinógeno en las actividades biológicas de las monocapas de trehalosa 6,6'-dimicolato". Revista de inmunología . 129 (2): 735–44. PMID 6806381 .
- ^ Hunter, RL; Venkataprasad, N; Olsen, MR (septiembre de 2006). "El papel del dimicolato de trehalosa (factor de cordón) en la morfología de M. tuberculosis virulenta in vitro". Tuberculosis (Edimburgo, Escocia) . 86 (5): 349–56. doi : 10.1016 / j.tube.2005.08.017 . PMID 16343989 .
- ^ a b c Retzinger, GS; Meredith, SC; Takayama, K; Hunter, RL; Kézdy, FJ (10 de agosto de 1981). "El papel de la superficie en las actividades biológicas de trehalosa 6,6'-dimicolato. Propiedades de la superficie y desarrollo de un sistema modelo" . La revista de química biológica . 256 (15): 8208–16. doi : 10.1016 / S0021-9258 (18) 43410-2 . PMID 7263645 .
- ^ Brennan, PJ (2003). "Estructura, función y biogénesis de la pared celular de Mycobacterium tuberculosis". Tuberculosis (Edimburgo, Escocia) . 83 (1–3): 91–7. doi : 10.1016 / s1472-9792 (02) 00089-6 . PMID 12758196 .
- ^ Bartelt, MA. (2000). Bacteriología diagnóstica: una guía de estudio . Filadelfia, Estados Unidos: FA Davis Company. pag. 500. ISBN 978-0-8036-0301-1.
- ^ a b Indrigo, J; Hunter RL, Jr; Actor, JK (julio de 2002). "Influencia de trehalosa 6,6'-dimicolato (TDM) durante la infección por micobacterias de los macrófagos de la médula ósea" . Microbiología . 148 (Parte 7): 1991–8. doi : 10.1099 / 00221287-148-7-1991 . PMID 12101287 .
- ^ a b c d Hunter, Robert L .; Olsen, Margaret; Jagannath, Chinnaswamy; Actor, Jeffrey K. (abril de 2006). "Trehalosa 6,6′-dimicolato y lípido en la patogenia de granulomas caseificantes de tuberculosis en ratones" . La Revista Estadounidense de Patología . 168 (4): 1249-1261. doi : 10.2353 / ajpath.2006.050848 . PMC 1606544 . PMID 16565499 .
- ^ a b c d e Indrigo, J; Hunter RL, Jr; Actor, JK (agosto de 2003). "Cord factor trehalosa 6,6'-dimicolato (TDM) media los eventos de tráfico durante la infección por micobacterias de macrófagos murinos". Microbiología . 149 (Parte 8): 2049–59. doi : 10.1099 / mic.0.26226-0 . PMID 12904545 .
- ^ Yang, Y .; Bhatti, A .; Ke, D .; González-Juarrero, M .; Lenaerts, A .; Kremer, L .; Guerardel, Y .; Zhang, P .; Ojha, AK (15 de noviembre de 2012). "La exposición a una serina esterasa similar a cutinasa desencadena una rápida lisis de múltiples especies de micobacterias" . Revista de Química Biológica . 288 (1): 382–392. doi : 10.1074 / jbc.M112.419754 . PMC 3537035 . PMID 23155047 .
- ^ Schabbing, RW; García, A; Hunter, RL (febrero de 1994). "Caracterización de la monocapa superficial de trehalosa 6,6'-dimicolato mediante microscopía de túnel de barrido" . Infección e inmunidad . 62 (2): 754–6. doi : 10.1128 / IAI.62.2.754-756.1994 . PMC 186174 . PMID 8300239 .
- ^ Geisel, RE; Sakamoto, K; Russell, DG; Rhoades, ER (15 de abril de 2005). "La actividad in vivo de los lípidos de la pared celular liberados del bacilo Calmette-Guérin de Mycobacterium bovis se debe principalmente a los miccolatos de trehalosa" . Revista de inmunología . 174 (8): 5007-15. doi : 10.4049 / jimmunol.174.8.5007 . PMID 15814731 .
- ^ Fujita, Y; Okamoto, Y; Uenishi, Y; Sunagawa, M; Uchiyama, T; Yano, I (julio de 2007). "Diferencias relacionadas con la estructura molecular y supra-molecular en la toxicidad y la actividad granulomatógena del factor del cordón micobacteriano en ratones". Patogenia microbiana . 43 (1): 10-21. doi : 10.1016 / j.micpath.2007.02.006 . PMID 17434713 .
- ↑ Sakamoto, K .; Geisel, RE; Kim, M.-J .; Wyatt, BT; Vendedores, LB; Smiley, ST; Cooper, AM; Russell, DG; Rhoades, ER (22 de diciembre de 2009). "El fibrinógeno regula la citotoxicidad del dimicolato de trehalosa micobacteriana, pero no es necesario para el reclutamiento celular, la respuesta de citocinas o el control de la infección por micobacterias" . Infección e inmunidad . 78 (3): 1004–1011. doi : 10.1128 / IAI.00451-09 . PMC 2825938 . PMID 20028811 .
- ↑ a b c Sakamoto, K .; Kim, MJ; Rhoades, ER; Allavena, RE; Ehrt, S .; Wainwright, HC; Russell, DG; Rohde, KH (21 de diciembre de 2012). "Dimicolato de trehalosa micobacteriana reprograma la expresión génica global de macrófagos y activa metaloproteinasas de matriz" . Infección e inmunidad . 81 (3): 764–776. doi : 10.1128 / IAI.00906-12 . PMC 3584883 . PMID 23264051 .
- ^ a b Rao, V; Fujiwara, N; Porcelli, SA; Glickman, MS (21 de febrero de 2005). "Mycobacterium tuberculosis controla la activación inmune innata del huésped mediante la modificación con ciclopropano de una molécula efectora de glicolípidos" . La Revista de Medicina Experimental . 201 (4): 535–43. doi : 10.1084 / jem.20041668 . PMC 2213067 . PMID 15710652 .
- ^ Kato, M (marzo de 1970). "Acción de un glicolípido tóxico de Corynebacterium diphtheriae sobre la estructura y función mitocondrial" . Revista de bacteriología . 101 (3): 709–16. doi : 10.1128 / JB.101.3.709-716.1970 . PMC 250382 . PMID 4314542 .
- ^ Ishikawa, E; Ishikawa, T; Morita, YS; Toyonaga, K; Yamada, H; Takeuchi, O; Kinoshita, T; Akira, S; Yoshikai, Y; Yamasaki, S (21 de diciembre de 2009). "Reconocimiento directo del glicolípido micobacteriano, dimicolato de trehalosa, por lectina Mincle tipo C" . La Revista de Medicina Experimental . 206 (13): 2879–88. doi : 10.1084 / jem.20091750 . PMC 2806462 . PMID 20008526 .
- ^ Schoenen, H; Bodendorfer, B; Hitchens, K; Manzanero, S; Werninghaus, K; Nimmerjahn, F; Agger, EM; Stenger, S; Andersen, P; Ruland, J; Brown, GD; Wells, C; Lang, R (15 de marzo de 2010). "Vanguardia: Mincle es esencial para el reconocimiento y adyuvante del factor del cordón micobacteriano y su análogo sintético trehalosa-dibeenato" . Revista de inmunología . 184 (6): 2756–60. doi : 10.4049 / jimmunol.0904013 . PMC 3442336 . PMID 20164423 .
- ↑ a b Werninghaus, K .; Babiak, A .; Gross, O .; Holscher, C .; Dietrich, H .; Agger, EM; Magos, J .; Mocsai, A .; Schoenen, H .; Finger, K .; Nimmerjahn, F .; Brown, GD; Kirschning, C .; Heit, A .; Andersen, P .; Wagner, H .; Ruland, J .; Lang, R. (12 de enero de 2009). "La coadyuvancia de un análogo de factor de cordón sintético para la subunidad de vacunación contra Mycobacterium tuberculosis requiere activación inmune innata dependiente de FcR -Syk-Card9" . Revista de Medicina Experimental . 206 (1): 89–97. doi : 10.1084 / jem.20081445 . PMC 2626670 . PMID 19139169 .
- ^ Yamasaki, S; Ishikawa, E; Sakuma, M; Hara, H; Ogata, K; Saito, T (octubre de 2008). "Mincle es un receptor activador acoplado a ITAM que detecta las células dañadas". Inmunología de la naturaleza . 9 (10): 1179–88. doi : 10.1038 / ni.1651 . PMID 18776906 . S2CID 205361789 .
- ^ Galés, KJ; Abbott, AN; Hwang, S.-A .; Indrigo, J .; Armitige, LY; Blackburn, MR; Hunter, RL; Actor, JK (1 de junio de 2008). "Un papel para el factor de necrosis tumoral, el complemento C5 y la interleucina-6 en el inicio y desarrollo de la respuesta granulomatosa inducida por el factor del cordón micobacteriano trehalosa 6,6'-dimicolato" . Microbiología . 154 (6): 1813–1824. doi : 10.1099 / mic.0.2008 / 016923-0 . PMC 2556040 . PMID 18524936 .
- ^ Lee, WB; Kang, JS; Yan, JJ; Lee, MS; Jeon, BY; Cho, SN; Kim, YJ (2012). "Los neutrófilos promueven la inflamación pulmonar inducida por micobacterias trehalosa dimicolato a través de la vía de Mincle" . PLOS Patógenos . 8 (4): e1002614. doi : 10.1371 / journal.ppat.1002614 . PMC 3320589 . PMID 22496642 .
- ^ Cucaracha, DR; Bean, AG; Demangel, C; Francia, diputado; Briscoe, H; Britton, WJ (1 de mayo de 2002). "El TNF regula la inducción de quimiocinas esencial para el reclutamiento celular, la formación de granulomas y la eliminación de la infección por micobacterias" . Revista de inmunología . 168 (9): 4620–7. doi : 10.4049 / jimmunol.168.9.4620 . PMID 11971010 .
- ^ Cooper, AM (1 de diciembre de 1993). "Tuberculosis diseminada en ratones alterados por el gen del interferón gamma" . Revista de Medicina Experimental . 178 (6): 2243–2247. doi : 10.1084 / jem.178.6.2243 . PMC 2191280 . PMID 8245795 .
- ^ Cooper, AM; Magram, J; Ferrante, J; Orme, IM (7 de julio de 1997). "La interleucina 12 (IL-12) es crucial para el desarrollo de inmunidad protectora en ratones infectados por vía intravenosa con Mycobacterium tuberculosis" . La Revista de Medicina Experimental . 186 (1): 39–45. doi : 10.1084 / jem.186.1.39 . PMC 2198958 . PMID 9206995 .
- ^ Trinchieri, G (1995). "Interleucina-12: una citocina proinflamatoria con funciones inmunorreguladoras que puentean la resistencia innata y la inmunidad adaptativa específica de antígeno". Revisión anual de inmunología . 13 (1): 251–76. doi : 10.1146 / annurev.iy.13.040195.001343 . PMID 7612223 .
- ^ Magram, Jeanne; Connaughton, Suzanne E; Warrier, Rajeev R; Carvajal, Daisy M; Wu, Chang-you; Ferrante, Jessica; Stewart, Colin; Sarmiento, Ulla; Faherty, Denise A; Gately, Maurice K (mayo de 1996). "Los ratones deficientes en IL-12 son defectuosos en la producción de IFNγ y las respuestas de citocinas de tipo 1" . La inmunidad . 4 (5): 471–481. doi : 10.1016 / S1074-7613 (00) 80413-6 . PMID 8630732 .
- ^ a b c d Yamagami, H; Matsumoto, T; Fujiwara, N; Arakawa, T; Kaneda, K; Yano, yo; Kobayashi, K (febrero de 2001). "Trehalosa 6,6'-dimicolato (factor de cordón) de Mycobacterium tuberculosis induce granulomas de tipo cuerpo extraño e hipersensibilidad en ratones" . Infección e inmunidad . 69 (2): 810–5. doi : 10.1128 / IAI.69.2.810-815.2001 . PMC 97956 . PMID 11159972 .
- ^ Bekierkunst, A (octubre de 1968). "Respuesta granulomatosa aguda producida en ratones por trehalosa-6,6-dimicolato" . Revista de bacteriología . 96 (4): 958–61. doi : 10.1128 / JB.96.4.958-961.1968 . PMC 252404 . PMID 4971895 .
- ^ Sakaguchi, yo; Ikeda, N; Nakayama, M; Kato, Y; Yano, yo; Kaneda, K (abril de 2000). "Trehalosa 6,6'-dimicolato (factor de cordón) mejora la neovascularización a través de la producción de factor de crecimiento endotelial vascular por neutrófilos y macrófagos" . Infección e inmunidad . 68 (4): 2043–52. doi : 10.1128 / iai.68.4.2043-2052.2000 . PMC 97384 . PMID 10722600 .
- ^ Kobayashi, Kazuo; Kaneda, Kenji; Kasama, Tsuyoshi (15 de mayo de 2001). "Inmunopatogénesis de hipersensibilidad de tipo retardado". Investigación y técnica de microscopía . 53 (4): 241–245. doi : 10.1002 / jemt.1090 . PMID 11340669 . S2CID 1851137 .
- ^ Chan, J; Xing, Y; Magliozzo, RS; Bloom, BR (1 de abril de 1992). "Matanza de Mycobacterium tuberculosis virulento por intermedios de nitrógeno reactivo producido por macrófagos murinos activados" . La Revista de Medicina Experimental . 175 (4): 1111–22. doi : 10.1084 / jem.175.4.1111 . PMC 2119182 . PMID 1552282 .
- ^ Oswald, IP; Dozois, CM; Petit, JF; Lemaire, G (abril de 1997). "La síntesis de interleucina-12 es un paso necesario en la activación de macrófagos peritoneales de ratón inducida por dimicolato de trehalosa" . Infección e inmunidad . 65 (4): 1364–9. doi : 10.1128 / IAI.65.4.1364-1369.1997 . PMC 175141 . PMID 9119475 .
- ^ Semenzato, G (marzo de 1990). "Factor de necrosis tumoral: una citocina con múltiples actividades biológicas" . Revista británica de cáncer . 61 (3): 354–361. doi : 10.1038 / bjc.1990.78 . PMC 1971301 . PMID 2183871 .
- ↑ Silva, CL; Faccioli, LH (diciembre de 1988). "El factor de necrosis tumoral (caquectina) media la inducción de caquexia por factor de cordón de micobacterias" . Infección e inmunidad . 56 (12): 3067–71. doi : 10.1128 / IAI.56.12.3067-3071.1988 . PMC 259702 . PMID 3053451 .
- ^ Hamasaki, N; Isowa, K; Kamada, K; Terano, Y; Matsumoto, T; Arakawa, T; Kobayashi, K; Yano, I (junio de 2000). "La administración in vivo del factor del cordón micobacteriano (trehalosa 6, 6'-dimicolato) puede inducir granulomas de pulmón e hígado y atrofia tímica en conejos" . Infección e inmunidad . 68 (6): 3704–9. doi : 10.1128 / iai.68.6.3704-3709.2000 . PMC 97662 . PMID 10816531 .
- ^ a b Ozeki, Y; Kaneda, K; Fujiwara, N; Morimoto, M; Oka, S; Yano, I (mayo de 1997). "Inducción in vivo de apoptosis en el timo mediante la administración de factor de cordón micobacteriano (trehalosa 6,6'-dimicolato)" . Infección e inmunidad . 65 (5): 1793–9. doi : 10.1128 / IAI.65.5.1793-1799.1997 . PMC 175219 . PMID 9125563 .
- ^ Galés, Kerry J .; Hwang, Shen-An; Hunter, Robert L .; Kruzel, Marian L .; Actor, Jeffrey K. (octubre de 2010). "Modulación de lactoferrina del factor de cordón micobacteriano trehalosa 6-6'-dimicolato indujo respuesta granulomatosa" . Investigación traslacional . 156 (4): 207–215. doi : 10.1016 / j.trsl.2010.06.001 . PMC 2948024 . PMID 20875896 .
- ↑ a b c Retzinger, GS (abril de 1987). "Difusión de perlas recubiertas con trehalosa 6,6'-dimicolato: un posible papel de la coagulación en el proceso de difusión". Patología experimental y molecular . 46 (2): 190–8. doi : 10.1016 / 0014-4800 (87) 90065-7 . PMID 3556532 .
- ^ Lepoivre, M; Tenu, JP; Lemaire, G; Petit, JF (agosto de 1982). "Actividad antitumoral y liberación de peróxido de hidrógeno por macrófagos provocada por diésteres de trehalosa". Revista de inmunología . 129 (2): 860–6. PMID 6806386 .
- ^ Oswald, IP; Afroun, S; Bray, D; Petit, JF; Lemaire, G (septiembre de 1992). "Baja respuesta de macrófagos BALB / c a señales de cebado y activación". Revista de biología de leucocitos . 52 (3): 315-22. doi : 10.1002 / jlb.52.3.315 . PMID 1381743 . S2CID 2190434 .
- Factores virulentos

