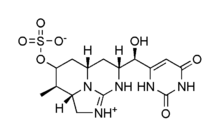
Cilindrospermopsina
 | |
| Nombres | |
|---|---|
| Nombre IUPAC 2,4 (1H, 3H) -pirimidindiona, 6 - [(R) -hidroxi [(2aS, 3R, 4S, 5aS, 7R) -2,2a, 3,4,5,5a, 6,7-octahidro- 3-metil-4- (sulfooxi) -1H-1,8,8b-triazaacenaftilen-7-il] metil] - | |
| Otros nombres Cylindrospermopsine [ cita requerida ] | |
| Identificadores | |
| |
Modelo 3D ( JSmol ) | |
| CHEBI |
|
| CHEMBL | |
| ChemSpider | |
| Tarjeta de información ECHA | 100.229.780 |
| KEGG | |
PubChem CID | |
| UNII | |
Tablero CompTox ( EPA ) | |
| |
| |
| Propiedades | |
| C 15 H 21 N 5 O 7 S | |
| Masa molar | 415,43 |
| Apariencia | Blanco sólido |
| Elevado | |
| Riesgos | |
| Pictogramas GHS |   |
| Palabra de señal GHS | Peligro |
| H300 , H341 , H370 | |
| P201 , P202 , P260 , P264 , P270 , P281 , P301 + 310 , P307 + 311 , P308 + 313 , P321 , P330 , P405 , P501 | |
Salvo que se indique lo contrario, los datos se proporcionan para materiales en su estado estándar (a 25 ° C [77 ° F], 100 kPa). | |
| Referencias de Infobox | |
La cilindrospermopsina (abreviada como CYN o CYL ) es una cianotoxina producida por una variedad de cianobacterias de agua dulce . [1] CYN es un derivado de uracilo policíclico que contiene grupos guanidino y sulfato . También es bipolar , lo que lo hace altamente soluble en agua . El CYN es tóxico para el tejido hepático y renal y se cree que inhibe la síntesis de proteínas y modifica covalentemente el ADN y / o ARN . No se sabe si la cilindrospermopsina es un carcinógeno , pero parece que no tiene actividad iniciadora de tumores en ratones. [2]
CYN se descubrió por primera vez después de un brote de una misteriosa enfermedad en Palm Island , Queensland , Australia . El brote se remonta a una floración de Cylindrospermopsis raciborskii en el suministro de agua potable local, y posteriormente se identificó la toxina. El análisis de la toxina condujo a una estructura química propuesta en 1992, que se revisó después de que se logró la síntesis en 2000. Se han aislado o sintetizado varios análogos de CYN, tanto tóxicos como no tóxicos.
C. raciborskii se ha observado principalmente en tropicales áreas, sin embargo también ha sido recientemente descubierto en las regiones templadas de Australia , Norte , América del Sur , Nueva Zelanda y Europa . [3] Sin embargo, la cepa de C. raciborskii productora de CYN no ha sido identificada en Europa, varias otras especies de cianobacterias que se encuentran en todo el continente pueden sintetizarla. [3]
Descubrimiento
En 1979, 138 habitantes de Palm Island , Queensland , Australia , ingresaron en el hospital con diversos síntomas de gastroenteritis . Todos estos eran niños; además, 10 adultos se vieron afectados pero no hospitalizados. Los síntomas iniciales, incluidos el dolor abdominal y los vómitos , se parecían a los de la hepatitis ; los síntomas posteriores incluyeron insuficiencia renal y diarrea con sangre . El análisis de orina reveló altos niveles de proteínas , cetonas y azúcar en muchos pacientes, junto consangre y urobilinógeno en menor número. El análisis de orina, junto con la microscopía fecal y la detección de intoxicaciones , no pudieron proporcionar un vínculo estadístico con los síntomas. Todos los pacientes se recuperaron en un plazo de 4 a 26 días y, en ese momento, no había una causa aparente para el brote. Los pensamientos iniciales sobre la causa incluyeron la mala calidad del agua y la dieta, sin embargo, ninguno fue concluyente, y la enfermedad se denominó "Enfermedad misteriosa de Palm Island". [4]
En ese momento, se notó que este brote coincidió con una severa floración de algas en el suministro de agua potable local, y poco después la atención se centró en la presa en cuestión. Un estudio epidemiológico de esta “enfermedad misteriosa” confirmó más tarde que la presa Solomon estaba implicada, ya que los que se enfermaron habían usado agua de la presa. Se hizo evidente que un tratamiento reciente de la floración de algas con sulfato de cobre provocó la lisis de las células de las algas, liberando una toxina en el agua. [5] Un estudio de la presa reveló que las floraciones periódicas de algas fueron causadas principalmente por tres cepas de cianobacterias : dos del géneroAnabaena y Cylindrospermopsis raciborskii , previamente desconocidas en aguas australianas. [6] Un bioensayo en ratones de los tres demostró que, aunque las doscepas de Anabaena no eran tóxicas, C. raciborskii era altamente tóxico. [7] El aislamiento posterior del compuesto responsable llevó a la identificación de la toxina cilindrospermopsina. [8]
Un informe posterior propuso alternativamente que el exceso de cobre en el agua era la causa de la enfermedad. La dosificación excesiva se debió al uso de contratistas de menor costo para controlar las algas, que no estaban calificados en el campo. [9]
Química
Determinación de estructura
El aislamiento de la toxina usando cianobacterias cultivadas de la cepa Palm Island original se logró mediante filtración en gel de un extracto acuoso , seguido de HPLC de fase inversa . La elucidación de la estructura se logró mediante experimentos de espectrometría de masas (MS) y resonancia magnética nuclear (RMN), y se propuso una estructura (que luego se demostró ligeramente incorrecta) (Figura 1). [8]
Esta molécula casi correcta posee un grupo guanidina tricíclico (anillos A, B y C), junto con un anillo de uracilo (D). La naturaleza zwiteriónica de la molécula la hace altamente soluble en agua, ya que la presencia de áreas cargadas dentro de la molécula crea un efecto dipolar , adecuado al disolvente polar . La sensibilidad de las señales clave en el espectro de RMN a pequeños cambios en el pH sugirió que el anillo de uracilo existe en una relación tautomérica ceto / enol , donde un hidrógeno la transferencia da como resultado dos estructuras distintas (Figura 2). Originalmente se propuso que un enlace de hidrógeno entre los grupos uracilo y guanidina en el tautómero enol haría de esta la forma dominante. [8]
Análogos
Se identificó un segundo metabolito de C. raciborskii a partir de extractos de las cianobacterias después de la observación de un pico frecuente que acompaña al de CYN durante los experimentos de UV y MS. El análisis por métodos de MS y NMR concluyó que a este nuevo compuesto le faltaba el oxígeno adyacente al anillo de uracilo y se denominó desoxicilindrospermopsina (Figura 3). [10]
En 1999, un epímero de CYN, denominado 7-epiciclindrospermopsina (epiCYN), también se identificó como un metabolito menor de Aphanizomenon ovalisporum . Esto ocurrió mientras se aislaba CYN de cianobacterias extraídas del lago Kinneret en Israel . [11] La estructura propuesta de esta molécula difería de CYN solo en la orientación del grupo hidroxilo adyacente al anillo de uracilo (Figura 4).
Síntesis total
Los enfoques sintéticos de CYN comenzaron con el anillo de piperidina (A) y progresaron hasta la anulación de los anillos B y C. [12] La primera síntesis total de CYN se informó en 2000 a través de un proceso de 20 pasos. [13]
Las mejoras en los métodos sintéticos llevaron a una revisión de la estereoquímica de CYN en 2001. Un proceso sintético que controlaba cada uno de los seis centros estereogénicos de epiCYN estableció que las asignaciones originales de CYN y epiCYN eran de hecho una inversión de las estructuras correctas. [14] Un enfoque alternativo de White y Hansen apoyó estas configuraciones absolutas (Figura 5). [15] En el momento de esta asignación correcta, se sugirió que la forma enol no era dominante. [14]
Estabilidad
Uno de los factores clave asociados con la toxicidad de CYN es su estabilidad . Aunque se ha descubierto que la toxina se degrada rápidamente en un extracto de algas cuando se expone a la luz solar , es resistente a la degradación por cambios de pH y temperatura , y no muestra degradación ni en forma sólida pura ni en agua pura. Como resultado, en agua turbia e inmóvil, la toxina puede persistir durante largos períodos y, aunque el agua hirviendo matará las cianobacterias, es posible que no elimine la toxina. [dieciséis]
Toxicología
Efectos tóxicos
Hawkins y col. . demostraron los efectos tóxicos de CYN mediante bioensayo en ratones, utilizando un extracto de la cepa original de Palm Island. Los ratones con intoxicación aguda mostraron anorexia , diarrea y respiración entrecortada . Los resultados de la autopsia revelaron hemorragias en los pulmones , hígados , riñones , intestino delgado y glándulas suprarrenales . La histopatología reveló necrosis de hepatocitos relacionada con la dosis , acumulación de lípidos y formación de trombos de fibrina envasos sanguíneos del hígado y los pulmones, junto con necrosis de células epiteliales variables en áreas de los riñones. [7]
Un bioensayo más reciente en ratones de los efectos de la cilindrospermopsina reveló un aumento en el peso del hígado, con dosis letales y no letales; además, los hígados parecían de color oscuro. Fue visible una necrosis extensa de los hepatocitos en los ratones a los que se les administró una dosis letal, y también se observó algún daño localizado en los ratones a los que se les administró una dosis no letal. [17]
Toxicidad
Una estimación inicial de la toxicidad de CYN en 1985 fue que un LD 50 en 24 horas fue de 64 ± 5 mg de la cultura / kg de peso corporal del ratón en liofilizado intraperitoneal inyección . [7] Un experimento adicional en 1997 mide el LD 50 como 52 mg / kg a las 24 horas y 32 mg / kg a los 7 días, sin embargo, los datos sugieren que otro compuesto tóxico estaba presente en el aislado de sonicadas células utilizadas; [18] predicciones hechas por Ohtani et al. [8] aproximadamente la toxicidad de 24 horas fue considerablemente mayor, y se propuso que otro metabolito estaba presente para explicar el nivel de toxicidad de 24 horas relativamente bajo medido. [18]
Debido a que la vía humana más probable de absorción de CYN es la ingestión, se realizaron experimentos de toxicidad oral en ratones. El LD oral de 50 se encontró que era 4.4 a 6.9 mg CYN / kg, y además de algunos ulceración del esófago gástrica mucosa , síntomas fueron consistentes con la de la dosificación intraperitoneal. El contenido del estómago incluyó material de cultivo , lo que indicó que estas cifras de LD 50 podrían estar sobreestimadas. [19]
Mecanismo de acción
Se informó que los cambios patológicos asociados con la intoxicación por CYN se encuentran en cuatro etapas distintas: inhibición de la síntesis de proteínas , proliferación de membranas , acumulación de lípidos dentro de las células y, finalmente , muerte celular . El examen de los hígados de los ratones extraídos en la autopsia mostró que en la inyección intraperitoneal de CYN, después de 16 horas, los ribosomas del retículo endoplásmico rugoso (rER) se habían desprendido, y a las 24 horas, una marcada proliferación de los sistemas de membranas del RE liso y del aparato de Golgi.había ocurrido. A las 48 horas, se habían acumulado pequeñas gotas de lípidos en los cuerpos celulares ya las 100 horas, los hepatocitos en los lóbulos hepáticos se destruyeron más allá de su función. [20]
Se ha demostrado que el proceso de inhibición de la síntesis de proteínas es irreversible, sin embargo, no es de manera concluyente el método de citotoxicidad del compuesto. Froscio y col. . propuso que CYN tiene al menos dos modos de acción separados: la inhibición de la síntesis de proteínas reportada anteriormente y un método aún poco claro de causar la muerte celular. Se ha demostrado que las células pueden sobrevivir durante largos períodos (hasta 20 horas) con un 90% de inhibición de la síntesis de proteínas y aún así mantener la viabilidad. [21] Dado que el CYN es citotóxico dentro de las 16-18 horas [22], se ha sugerido que otros mecanismos son la causa de la muerte celular.
El citocromo P450 se ha relacionado con la toxicidad de CYN, ya que el bloqueo de la acción de P450 reduce la toxicidad de CYN. [23] Se ha propuesto que un metabolito (o metabolitos) derivado de P450 activado del CYN es la principal causa de toxicidad. [21] Shaw y col. . demostraron que la toxina podía metabolizarse in vivo , lo que resultaba en metabolitos unidos en el tejido hepático, y que el daño era más frecuente en los hepatocitos de rata que en otros tipos de células. [24]
Debido a la estructura de CYN, que incluye grupos sulfato , guanidina y uracilo , se ha sugerido que CYN actúa sobre el ADN o el ARN . Shaw y col. . informó de la unión covalente de CYN o sus metabolitos al ADN en ratones, [24] y también se ha observado la rotura de la cadena de ADN. [25] Humpage y col. también apoyó esto, y además postuló que CYN (o un metabolito) actúa sobre el huso o centrómeros durante la división celular , induciendo la pérdida de cromosomas completos . [26]
El grupo uracilo de CYN se ha identificado como un farmacóforo de la toxina. En dos experimentos, el átomo de hidrógeno vinílico en el anillo de uracilo se reemplazó con un átomo de cloro para formar 5-clorocilindrospermopsina, y el grupo uracilo se truncó a un ácido carboxílico , para formar ácido cilindrospermico (Figura 6). Ambos productos se evaluaron como no tóxicos , incluso a 50 veces la DL 50 de CYN. [27]En la determinación previa de la estructura de la desoxicilindrospermopsina, se llevó a cabo una evaluación de la toxicidad del compuesto. Los ratones inyectados intraperitonealmente con cuatro veces la dosis letal mediana de 5 días de CYN no mostraron efectos tóxicos. Como se demostró que este compuesto era relativamente abundante, se concluyó que este análogo era comparativamente no tóxico. [10] Dado que tanto CYN como epiCYN son tóxicos, [11] el grupo hidroxilo en el puente de uracilo puede considerarse necesario para la toxicidad. Hasta el momento, no se han comparado las toxicidades relativas de CYN y epiCYN.
Biosíntesis
El grupo de genes biosintéticos de cilindrospermopsina (BGC) se describió en Cylindrospermopsis raciborskii AWT205 en 2008. [28]
Floraciones tóxicas relacionadas y su impacto.
Desde el brote de Palm Island, se han identificado varias otras especies de cianobacterias productoras de CYN: Anabaena bergii , Anabaena lapponica , [29] Aphanizomenon ovalisporum , [30] Umezakia natans , [31] Raphidiopsis curvata . [32] y Aphanizomenon issatschenkoi . [33] En Australia, existen tres cianobacterias tóxicas principales: Anabaena circinalis , especies de Microcystis y C. raciborskii.. De estos, el último, que produce CYN, ha atraído una atención considerable, no solo debido al brote de Palm Island, sino también porque la especie se está extendiendo a áreas más templadas . Anteriormente, las algas se clasificaban solo como tropicales , sin embargo, recientemente se han descubierto en regiones templadas de Australia, Europa , [3] América del Norte y del Sur , [6] y también Nueva Zelanda . [34]
En agosto de 1997, tres vacas y diez terneros murieron por intoxicación con cilindrospermopsina en una granja en el noroeste de Queensland. Se analizó una presa cercana que contenía una floración de algas y se identificó C. raciborskii . El análisis por HPLC / espectrometría de masas reveló la presencia de CYN en una muestra de la biomasa . Una autopsia de uno de los terneros reportó inflamación del hígado y la vesícula biliar , junto con hemorragias del corazón y del intestino delgado . Examen histológico del hígado.tejido fue consistente con lo informado en ratones afectados por CYN. [17] Este fue el primer informe de C. raciborskii causando mortalidad en animales en Australia.
El efecto de una floración de C. raciborskii en una acuicultura estanque en Townsville , Australia se evaluó en 1997. El estanque contenía Redclaw cangrejos , junto con una población de Lago Eacham Rainbowfish para controlar el exceso de comida. El análisis reveló que el agua contenía CYN tanto extracelular como intracelular , y que los cangrejos de río lo habían acumulado principalmente en el hígado, pero también en el tejido muscular . El examen del contenido intestinal reveló células cianobacterianas , lo que indica que el cangrejo de río había ingeridotoxina intracelular. Un experimento que utilizó un extracto de flor mostró que también era posible absorber la toxina extracelular directamente en los tejidos. Tal bioacumulación , particularmente en la industria de la acuicultura, era motivo de preocupación, especialmente cuando los seres humanos eran los usuarios finales del producto. [35]
El impacto de las floraciones de cianobacterias se ha evaluado en términos económicos . En diciembre de 1991, la floración de algas más grande del mundo se produjo en Australia, donde se vieron afectados 1000 km del río Darling - Barwon . [36] Se perdió un millón de personas-día de agua potable y los costos directos incurridos ascendieron a más de 1,3 millones de dólares australianos. Además, también se perdieron 2000 días-sitio de recreación y el costo económico se estimó en 10 millones de dólares australianos, después de tener en cuenta las industrias afectadas indirectamente, como el turismo , el alojamiento y el transporte . [37]
Métodos actuales de análisis en muestras de agua.
Los métodos actuales incluyen cromatografía líquida acoplada a espectrometría de masas ( LC-MS ), [38] [39] bioensayo en ratón, [40] ensayo de inhibición de la síntesis de proteínas y análisis de HPLC-PDA (Photo Diode Array) de fase inversa. Se ha desarrollado un ensayo de síntesis de proteína libre de células que parece ser comparable a HPLC-MS. [41]
Ver también
- Cianotoxina
- Lyngbyatoxin
- Microcistina
- Nodularin
- Saxitoxina
Referencias
- ^ Fastner J, Heinze R, Humpage AR, Mischke U, Eaglesham GK, Chorus I (septiembre de 2003). "Ocurrencia de cilindrospermopsina en dos lagos alemanes y evaluación preliminar de la toxicidad y la producción de toxinas de aislados de Cylindrospermopsis raciborskii (Cyanobacteria)". Toxicon . 42 (3): 313-21. doi : 10.1016 / S0041-0101 (03) 00150-8 . PMID 14559084 .
- ^ Falconer IR, Humpage AR (2001). "Evidencia preliminar de la iniciación del tumor in vivo mediante la administración oral de extractos del alga cylindrospermopsis raciborskii azul-verde que contiene la toxina cylindrospermopsin". Toxicología ambiental . 16 (2): 192–5. doi : 10.1002 / tox.1024 . PMID 11339720 .
- ↑ a b c Poniedziałek B, Rzymski P, Kokociński M (2012). "Cilindrospermopsina: amenaza potencial ligada al agua para la salud humana en Europa". Toxicología y Farmacología Ambiental . 34 (3): 651–60. doi : 10.1016 / j.etap.2012.08.005 . PMID 22986102 .
- ^ Byth S (julio de 1980). "Enfermedad misteriosa de Palm Island". La Revista Médica de Australia . 2 (1): 40–42. doi : 10.5694 / j.1326-5377.1980.tb131814.x . PMID 7432268 .
- ^ Bourke, ATC; Hawes, RB; Neilson, A .; Stallman, ND (1983). "Un brote de hepatoenteritis (la enfermedad misteriosa de Palm Island) posiblemente causado por intoxicación por algas". Toxicon . 3 : 45–48. doi : 10.1016 / 0041-0101 (83) 90151-4 .
- ↑ a b Griffiths DJ, Saker ML (abril de 2003). "La enfermedad misteriosa de Palm Island 20 años después: una revisión de la investigación sobre la cianotoxina cylindrospermopsin". Toxicología ambiental . 18 (2): 78–93. doi : 10.1002 / tox.10103 . PMID 12635096 .
- ^ a b c Hawkins PR, Runnegar MT, Jackson AR, Falconer IR (noviembre de 1985). "Hepatotoxicidad severa causada por la cianobacteria tropical (alga azul-verde) Cylindrospermopsis raciborskii (Woloszynska) Seenaya y Subba Raju aislado de un depósito de suministro de agua doméstico" . Microbiología aplicada y ambiental . 50 (5): 1292–5. doi : 10.1128 / AEM.50.5.1292-1295.1985 . PMC 238741 . PMID 3937492 .
- ^ a b c d Ohtani, I .; Moore, RE; Runnegar, MTC (1992). "Cylindrospermopsin: una potente hepatotoxina del alga azul-verde Cylindrospermopsis raciborskii". Mermelada. Chem. Soc. 114 (20): 7941–7942. doi : 10.1021 / ja00046a067 .
- ^ Prociv P (septiembre de 2004). "Toxinas de algas o envenenamiento por cobre - revisando la" epidemia "de Palm Island " . La Revista Médica de Australia . 181 (6): 344. doi : 10.5694 / j.1326-5377.2004.tb06316.x . PMID 15377259 .
- ^ a b Norris RL, Eaglesham GK, Shaw GR, et al. (Octubre de 2001). "Extracción y purificación de los iones híbridos cylindrospermopsin y deoxycylindrospermopsin de Cylindrospermopsis raciborskii". Toxicología ambiental . 16 (5): 391–6. doi : 10.1002 / tox.1048 . PMID 11594025 .
- ↑ a b Banker R, Teltsch B, Sukenik A, Carmeli S (marzo de 2000). "7-epicilindrospermopsina, un metabolito menor tóxico de la cianobacteria Aphanizomenon ovalisporum del lago Kinneret, Israel". Revista de productos naturales . 63 (3): 387–9. doi : 10.1021 / np990498m . PMID 10757726 .
- ^ Heintzelman, GR; Weinreb, SM; Parvez, M. (1996). "Construcción basada en Imino Diels-Alder de una unidad de anillo A de piperidina para la síntesis total de la hepatotoxina marina Cylindrospermopsin". La Revista de Química Orgánica . 125 (5): 4594–4599. doi : 10.1021 / jo960035a . PMID 11667385 .
- ^ Xie, CY; Runnegar, MTC; Snider, BB (2000). "Síntesis total de (+/-) - cilindrospermopsina". Mermelada. Chem. Soc. 122 (21): 5017–5024. doi : 10.1021 / ja000647j .
- ^ a b Heintzelman, GR; Fang, WK; Keen, SP; Wallace, GA; Weinreb, SM (2001). "Síntesis total estereoselectiva de la hepatotoxina cianobacteriana 7-epicilindrospermopsina: revisión de la estereoquímica de la cilindrospermopsina". Mermelada. Chem. Soc. 123 (36): 8851–3. doi : 10.1021 / ja011291u . PMID 11535093 .
- ^ Blanco, JD; Hansen, JD (2005). "Síntesis total de (-) - 7-epicilindrospermopsina, un metabolito tóxico de la cianobacteria de agua dulce Aphanizomenon ovalisporum, y asignación de su configuración absoluta". J. Org. Chem. 70 (6): 1963-1977. doi : 10.1021 / jo0486387 . PMID 15760174 .
- ^ Chiswell, RK; Shaw, GR; Eaglesham, G .; Smith, MJ; Norris, RL; Seawright, AA; Moore, MR (1999). "Estabilidad de la cilindrospermopsina, la toxina de la cianobacteria, Cylindrospermopsis raciborskii: efecto del pH, la temperatura y la luz solar sobre la descomposición". Toxicología ambiental . 14 (1): 155-161. doi : 10.1002 / (SICI) 1522-7278 (199902) 14: 1 <155 :: AID-TOX20> 3.0.CO; 2-Z .
- ^ a b Saker, ML; Thomas, AD; Norton, JH (1999). "Mortalidad de ganado atribuida a la cianobacteria tóxica Cylindrospermopsis raciborskii en una región del interior del norte de Queensland". Toxicología ambiental . 14 (1): 179–182. doi : 10.1002 / (SICI) 1522-7278 (199902) 14: 1 <179 :: AID-TOX23> 3.3.CO; 2-7 .
- ^ a b Hawkins PR, Chandrasena NR, Jones GJ, Humpage AR, Falconer IR (marzo de 1997). "Aislamiento y toxicidad de Cylindrospermopsis raciborskii de un lago ornamental". Toxicon . 35 (3): 341–6. doi : 10.1016 / S0041-0101 (96) 00185-7 . PMID 9080590 .
- ^ Seawright, AA; Nolan, CC; Shaw, GR; Chiswell, RK; Norris, RL; Moore, MR; Smith, MJ (1999). "La toxicidad oral para ratones de la cianobacteria tropical Cylindrospermopsis raciborskii (Woloszynska). (1999)". Reinar. Toxicol . 14 : 135-142. doi : 10.1002 / (SICI) 1522-7278 (199902) 14: 1 <135 :: AID-TOX17> 3.0.CO; 2-L .
- ^ Terao K, Ohmori S, Igarashi K, et al. (Julio de 1994). "Estudios de microscopía electrónica sobre envenenamiento experimental en ratones inducido por cylindrospermopsin aislado de alga azul-verde Umezakia natans". Toxicon . 32 (7): 833–43. doi : 10.1016 / 0041-0101 (94) 90008-6 . PMID 7940590 .
- ^ a b Froscio SM, Humpage AR, Burcham PC, Falconer IR (agosto de 2003). "Inhibición de la síntesis de proteínas inducida por cilindrospermopsina y su disociación de la toxicidad aguda en hepatocitos de ratón". Toxicología ambiental . 18 (4): 243–51. doi : 10.1002 / tox.10121 . PMID 12900943 .
- ^ Runnegar MT, Kong SM, Zhong YZ, Ge JL, Lu SC (mayo de 1994). "El papel del glutatión en la toxicidad de un nuevo alcaloide cianobacteriano cilindrospermopsina en hepatocitos de rata en cultivo". Comunicaciones de investigación bioquímica y biofísica . 201 (1): 235–41. doi : 10.1006 / bbrc.1994.1694 . PMID 8198579 .
- ^ Runnegar MT, Kong SM, Zhong YZ, Lu SC (enero de 1995). "Inhibición de la síntesis de glutatión reducida por cilindrospermopsina alcaloide cianobacteriano en hepatocitos de rata en cultivo". Farmacología bioquímica . 49 (2): 219-25. doi : 10.1016 / S0006-2952 (94) 00466-8 . PMID 7840799 .
- ↑ a b Shaw GR, Seawright AA, Moore MR, Lam PK (febrero de 2000). "Cilindrospermopsina, un alcaloide cianobacteriano: evaluación de su actividad toxicológica". Monitoreo de fármacos terapéuticos . 22 (1): 89–92. doi : 10.1097 / 00007691-200002000-00019 . PMID 10688267 .
- ^ Shen X, Lam PK, Shaw GR, Wickramasinghe W (octubre de 2002). "Investigación de genotoxicidad de una toxina cianobacteriana, cilindrospermopsina". Toxicon . 40 (10): 1499–501. doi : 10.1016 / S0041-0101 (02) 00151-4 . PMID 12368121 .
- ^ Humpage AR, Fenech M, Thomas P, Falconer IR (diciembre de 2000). "La inducción de micronúcleos y la pérdida de cromosomas en glóbulos blancos humanos transformados indican la acción clastogénica y aneugénica de la toxina cianobacteriana, cilindrospermopsina". Investigación de mutaciones . 472 (1–2): 155–61. doi : 10.1016 / S1383-5718 (00) 00144-3 . PMID 11113708 .
- ^ Banquero R, Carmeli S, Werman M, Teltsch B, Porat R, Sukenik A (febrero de 2001). "Se requiere una fracción de uracilo para la toxicidad de la cianobacteriana hepatotoxina cylindrospermopsin". Diario de Toxicología y Salud Ambiental, Parte A . 62 (4): 281–8. doi : 10.1080 / 009841001459432 . PMID 11245397 . S2CID 32363711 .
- ^ Mihali, Troco Kaan; Kellmann, Ralf; Muenchhoff, Julia; Barrow, Kevin D .; Neilan, Brett A. (7 de diciembre de 2007). "Caracterización del grupo de genes responsable de la biosíntesis de cilindrospermopsina" . Microbiología aplicada y ambiental . Sociedad Americana de Microbiología. 74 (3): 716–722. doi : 10.1128 / aem.01988-07 . ISSN 0099-2240 . PMC 2227734 .
- ^ Parodia L, Berg KA, Rapala J, et al. (Diciembre de 2006). "Primera observación de cylindrospermopsin en Anabaena lapponica aislada del ambiente boreal (Finlandia)". Toxicología ambiental . 21 (6): 552–60. doi : 10.1002 / tox.20216 . PMID 17091499 .
- ^ Banquero, R .; Carmeli, S .; Hadas, O .; Teltsch, B .; Porat, R .; Sukenik, A. (1997). "Identificación de Cylindrospermopsin en Aphanizomenon Ovalisporum (cyanophyceae) aislado del lago Kinneret, Israel 1". Revista de Phycology . 33 (4): 613–616. doi : 10.1111 / j.0022-3646.1997.00613.x .
- ^ Harada KI, Ohtani I, Iwamoto K, et al. (Enero de 1994). "Aislamiento de cilindrospermopsina de una cianobacteria Umezakia natans y su método de detección". Toxicon . 32 (1): 73–84. doi : 10.1016 / 0041-0101 (94) 90023-X . PMID 9237339 .
- ^ Li, R .; Carmichael, WW; Brittain, S .; Eaglesham, GK; Shaw, GR; Liu, Y .; Watanabe, MM (2001). "Primer informe de las cianotoxinas Cylindrospermopsin y Deoxycylindrospermopsin de Raphidiopsis Curvata (cianobacterias)". J Phycol . 37 (6): 1121–1126. doi : 10.1046 / j.1529-8817.2001.01075.x .
- ^ Madera, SA; JP Rasmussen; PT Holanda; R. Campbell y ALM Crowe (2007). "Primer informe de la cianotoxina Anatoxina-A de Aphanizomenon issatschenkoi (cianobacterias)". Revista de Phycology . 43 (2): 356–365. doi : 10.1111 / j.1529-8817.2007.00318.x .
- ^ Stirling DJ, Quilliam MA (agosto de 2001). "Primer informe de la toxina cianobacteriana cylindrospermopsin en Nueva Zelanda". Toxicon . 39 (8): 1219–22. doi : 10.1016 / S0041-0101 (00) 00266-X . PMID 11306133 .
- ^ Saker ML, Eaglesham GK (1999). "La acumulación de cylindrospermopsin de la cyanobacterium Cylindrospermopsis raciborskii en tejidos del cangrejo de río Cherax quadricarinatus". Toxicon . 37 (7): 1065–77. doi : 10.1016 / S0041-0101 (98) 00240-2 . PMID 10484741 .
- ^ Fuerza, NSWBGAT (1992). "Informe final de la Fuerza de Tarea de Algas Verdes Azules de Nueva Gales del Sur". Parramatta: Departamento de Recursos Hídricos de Nueva Gales del Sur .
- ^ Herath, G. (1995). "El problema de la floración de algas en las vías fluviales de Australia: una evaluación económica". Revisión de Economía Agrícola y Comercialización . 63 (1): 77–86.
- ^ Welker M, Bickel H, Fastner J (noviembre de 2002). "Detección HPLC-PDA de cilindrospermopsina - oportunidades y límites". Investigación del agua . 36 (18): 4659–63. doi : 10.1016 / S0043-1354 (02) 00194-X . PMID 12418670 .
- ^ Eaglesham, GK; Norris, RL; Shaw, GR; Smith, MJ; Chiswell, RK; Davis, BC; Neville, GR; Seawright, AA; Moore, MR (1999). "Uso de HPLC-MS / MS para controlar la cilindrospermopsina, una toxina de algas azul-verde, con fines de salud pública". Toxicología ambiental . 14 (1): 151-154. doi : 10.1002 / (SICI) 1522-7278 (199902) 14: 1 <151 :: AID-TOX19> 3.3.CO; 2-4 .
- ^ Cetrero, IR; Hardy, SJ; Humpage, AR; Froscio, SM; Tozer, GJ; Hawkins, PR (1999). "Toxicidad hepática y renal de las algas verdiazules (cianobacterias): cylindrospermosis raciborskii en ratones albinos suizos machos". Toxicología ambiental . 14 (1): 143–150. doi : 10.1002 / (SICI) 1522-7278 (199902) 14: 1 <143 :: AID-TOX18> 3.0.CO; 2-H .
- ^ Froscio SM, Humpage AR, Burcham PC, Falconer IR (octubre de 2001). "Ensayo de inhibición de la síntesis de proteínas libres de células para la toxina cianobacteriana cilindrospermopsina". Toxicología ambiental . 16 (5): 408-12. doi : 10.1002 / tox.1050 . PMID 11594027 .
- Neurotoxinas
- Heterociclos de nitrógeno
- Alcaloides bacterianos
- Cianotoxinas
- Alcaloides de guanidina
- Zwitteriones
- Síntesis total
- Derivados de uracilo
- Inhibidores de la síntesis de proteínas
- Ésteres de sulfato