Proteína que interactúa con el receptor de glutamato
La proteína que interactúa con el receptor de glutamato (GRIP) se refiere a una familia de proteínas que se unen al receptor de glutamato o específicamente a la proteína GRIP1 dentro de esta familia. Se ha demostrado que las proteínas de la familia de proteínas que interactúan con el receptor de glutamato (GRIP) interactúan con GluR2 , una subunidad común en el receptor AMPA . [1] Esta subunidad también interactúa con otras proteínas, como la proteína que interactúa con la C-quinasa1 ( PICK1 ) y la proteína de fusión sensible a N-etilmaleimida ( NSF ). Los estudios han comenzado a dilucidar su función; sin embargo, aún queda mucho por aprender sobre estas proteínas.
El descubrimiento de la proteína que interactúa con el receptor de glutamato (GRIP-1) se produjo como resultado de la observación de que los receptores de glutamato, como el receptor de NMDA , se agrupan en las sinapsis. [2] Poco después de esta observación, los investigadores identificaron una región en la región C-terminal de los receptores NMDA llamada motivo tSXV que tiene la capacidad de unirse al dominio PDZ de la proteína PSD-95 . [3]
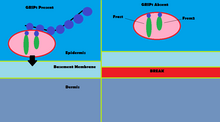
La investigación sobre la localización del receptor de NMDA allanó el camino para la investigación de receptores que no son de NMDA, como los receptores de AMPA. Al igual que los receptores NMDA, se descubrió que los receptores AMPA se localizan en la terminal sináptica de las neuronas del sistema nervioso central . [4] Mediante el uso de anticuerpos GFP ( proteína verde fluorescente ) que corresponden a la proteína GRIP, los investigadores pudieron usar la fluorescencia para determinar la ubicación de GRIP en las neuronas del hipocampo. Luego se usó otro anticuerpo GFP para marcar la subunidad GluR2 de los receptores AMPA. [4] Mediante el uso de inmunocitoquímica y la comparación de la ubicación de los receptores GRIP y AMPA, se determinó que los receptores GRIP y AMPA experimentan colocalización.en las neuronas del hipocampo. [4] Estos hallazgos confirmaron la hipótesis inicial de que la proteína GRIP juega un papel importante en la unión de los receptores AMPA a las sinapsis excitadoras.
La estructura de GRIP contiene siete dominios PDZ y se une al terminal C de la subunidad GluR2 de los receptores AMPA. [4] Aunque el número de dominios PDZ es diferente para las proteínas PSD-95 y GRIP, el dominio PDZ es un motivo estructural común en las proteínas que ayudan a mediar las interacciones proteína-proteína. [5] La secuencia de aminoácidos del receptor AMPA a la que se une la proteína GRIP es ESVKI. El aminoácido serina conservado en el extremo C-terminal de los receptores AMPA y NMDA sugiere que juega un papel importante en la facilitación de la interacción para GRIP y PSD-95. [6]
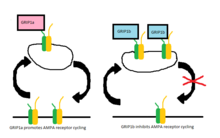
Los receptores AMPA se transportan constantemente entre la membrana celular y el espacio intracelular y originalmente se pensó que GRIP podría ser responsable de la agrupación de receptores AMPA en la sinapsis excitadora. [1] Aunque todavía no está claro el papel exacto de GRIP en este tráfico, parece que PICK1 es más directamente responsable de la agrupación de receptores AMPA en la superficie y que GRIP está involucrado en la estabilización de los receptores AMPA intracelularmente. [7] Un estudio mostró que cuando se interrumpe la interacción entre GluR2 y GRIP, no hay cambios en la expresión superficial de los receptores AMPA o la internalización constitutiva de los receptores AMPA. [8]Sin embargo, hay una cantidad reducida de receptores que permanecen internalizados cuando el ciclo del receptor se modifica mediante la aplicación de AMPA-1. La relación vuelve a la normalidad cuando se permite que ocurra el reciclaje constitutivo, lo que sugiere que la estabilización de los receptores intracelulares es crítica solo bajo la internalización inducida por AMPA. [8]