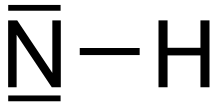 | |||
| Nombres | |||
|---|---|---|---|
| Nombre IUPAC λ 1 -Azanilideno [1] | |||
| Otros nombres Aminileno Azanilen hydridonitrogen | |||
| Identificadores | |||
Modelo 3D ( JSmol ) | |||
| CHEBI | |||
| ChemSpider | |||
| 66 | |||
PubChem CID | |||
Tablero CompTox ( EPA ) | |||
| |||
| |||
| Propiedades | |||
| H N | |||
| Masa molar | 15.015 g · mol −1 | ||
| Ácido conjugado | Ion de nitrenio | ||
| Estructura | |||
| lineal | |||
| Termoquímica | |||
Capacidad calorífica ( C ) | 21,19 JK −1 mol −1 | ||
Entropía molar estándar ( S | 181,22 kJ K −1 mol −1 | ||
| 358,43 kJ mol −1 | |||
Salvo que se indique lo contrario, los datos se proporcionan para materiales en su estado estándar (a 25 ° C [77 ° F], 100 kPa). | |||
| Referencias de Infobox | |||
Imidogen es un compuesto inorgánico con la fórmula química NH. [2] Al igual que otros radicales simples , es muy reactivo y, en consecuencia, de corta duración, excepto como gas diluido. Su comportamiento depende de su multiplicidad de espines , es decir, el estado fundamental del triplete frente al singlete .
Producción y propiedades [ editar ]
El imidogeno se puede generar por descarga eléctrica en una atmósfera de amoniaco . [3]
Imidogen tiene una gran división rotacional y una débil interacción espín-espín, por lo que será menos probable que experimente transiciones Zeeman inducidas por colisión . [3] El imidogeno en estado fundamental se puede atrapar magnéticamente usando la carga de gas tampón de un haz molecular. [3]
El primer estado excitado (a 1 Δ) tiene una larga vida útil como su relajación a estado fundamental (X 3 Σ - ) está prohibido-giro. [4] [5] Imidogen sufre un cruce entre sistemas inducido por colisión . [6]
Reactividad [ editar ]
Ignorando los átomos de hidrógeno, el imidogeno es isoelectrónico con los átomos de carbeno (CH 2 ) y oxígeno (O), y presenta una reactividad comparable. [4] El primer estado excitado puede detectarse mediante fluorescencia inducida por láser (LIF). [4] Los métodos LIF permiten la detección del agotamiento, la producción y los productos químicos del NH. Reacciona con óxido nítrico (NO):
- NH + NO → N 2 + OH
- NH + NO → N 2 O + H
La primera reacción es más favorable con un Δ H 0 de−408 ± 2 kJ / mol en comparación con un Δ H 0 de−147 ± 2 kJ / mol para la última reacción. [7]
Nomenclatura [ editar ]
El nombre trivial nitreno es el nombre preferido de la IUPAC . Los nombres sistemáticos, λ 1 -azano e hidridonitrógeno , nombres válidos de la IUPAC , se construyen de acuerdo con las nomenclaturas sustituta y aditiva, respectivamente.
En contextos apropiados, el imidogeno puede verse como amoniaco con dos átomos de hidrógeno eliminados y, como tal, el azilideno puede usarse como un nombre sistemático específico del contexto, de acuerdo con la nomenclatura sustitutiva. Por defecto, este nombre no tiene en cuenta la radicalidad de la molécula de imidogen. Aunque, en un contexto aún más específico, también puede nombrar el estado no radical, mientras que el estado dirradical se llama azanediyl .
Astroquímica [ editar ]
El NH interestelar se identificó en las nubes difusas hacia ζ Persei y HD 27778 a partir de espectros de alta resolución de señal a ruido de la banda de absorción NH A 3 Π → X 3 Σ (0,0) cerca de 3358 Å. [8] Una temperatura de aproximadamente 30 K (-243 ° C) favoreció una producción eficiente de CN a partir de NH dentro de la nube difusa. [9] [10] [8]
Reacciones relevantes para la astroquímica [ editar ]
Reacciones químicas [11] [12] Reacción Tarifa constante Tasa / [H 2 ] 2 N + H - → NH + e - 1 × 10 −9 3,5 × 10 −18 NH 2 + O → NH + OH 2,546 × 10 −13 1,4 × 10 −13 NUEVA HAMPSHIRE+
2+ e - → NH + H3.976 × 10 −7 2,19 × 10 −21 NUEVA HAMPSHIRE+
3+ e - → NH + H + H8,49 × 10 −7 2,89 × 10 −19 NH + N → N 2 + H 4,98 × 10 −11 4,36 × 10 −16 NH + O → OH + N 1,16 × 10 −11 1,54 × 10 −14 NH + C + → CN + + H 7,8 × 10 −10 4,9 × 10 −19 NH + H 3 + → NH+
2+ H 21,3 × 10 −9 3,18 × 10 −19 NH + H + → NH + + H 2,1 × 10 −9 4.05 × 10 −20
Dentro de las nubes difusas, H - + N → NH + e - es un mecanismo de formación importante. Cerca del equilibrio químico, importantes mecanismos de formación de NH son las recombinaciones de NH+ 2y NH+ 3iones con electrones. Dependiendo del campo de radiación en la nube difusa, el NH 2 también puede contribuir.
El NH se destruye en las nubes difusas por fotodisociación y fotoionización . En las nubes densas, el NH se destruye por reacciones con el oxígeno y el nitrógeno atómicos. O + y N + forman OH y NH en nubes difusas. NH participa en la creación de N 2 , OH, H, CN + , CH, N, NH+
2, NH + para el medio interestelar.
Se ha informado de NH en el medio interestelar difuso, pero no en nubes moleculares densas. [13] El propósito de detectar NH es a menudo obtener una mejor estimación de las constantes rotacionales y los niveles vibracionales de NH. [14] También es necesario para confirmar los datos teóricos que predicen las abundancias de N y NH en las estrellas que producen N y NH y otras estrellas con trazas de N y NH restantes. [15] El uso de valores actuales para constantes rotacionales y vibraciones de NH, así como de OH y CH, permite estudiar las abundancias de carbono, nitrógeno y oxígeno sin recurrir a una síntesis de espectro completo con un modelo de atmósfera 3D. [dieciséis]
Ver también [ editar ]
- Diimida (dímero)
Referencias [ editar ]
- ^ Libro rojo de la IUPAC 2005
- ^ Greenwood, Norman N .; Earnshaw, Alan (1997). Química de los Elementos (2ª ed.). Butterworth-Heinemann . ISBN 978-0-08-037941-8.
- ^ a b c Campbell, WC; Tsikata, E .; van Buuren, L .; Lu, H .; Doyle, JM (2007). "Atrapamiento magnético y relajación Zeeman de NH (X 3 Σ - )". Cartas de revisión física . 98 (21): 213001. arXiv : física / 0702071 . doi : 10.1103 / PhysRevLett.98.213001 .
- ^ a b c Hack, W .; Rathmann, K. (1990). "Reacción elemental de imidogen (a 1 Δ) con monóxido de carbono". Revista de Química Física . 94 (9): 3636–3639. doi : 10.1021 / j100372a050 .
- ^ Instituto Nacional de Estándares y Tecnología [ cita completa necesaria ]
- ^ Adams, JS; Pasternack, L. (1991). "Cruce entre sistemas inducido por colisión en imidogen (a 1 Δ) → imidogen (X 3 Σ - )". Revista de Química Física . 95 (8): 2975–2982. doi : 10.1021 / j100161a009 .
- ^ Patel-Misra, D .; Dagdigian, PJ (1992). "Dinámica de la reacción imidogeno (X 3 Σ - ) + óxido nítrico (X 2 Π): distribución del estado interno del producto hidroxilo (X 2 Π)". Revista de Química Física . 96 (8): 3232–3236. doi : 10.1021 / j100187a011 .
- ^ a b Meyer, David M .; Roth, Katherine C. (1 de agosto de 1991). "Descubrimiento de NH interestelar". Revista astrofísica . 376 : L49 – L52. Código Bibliográfico : 1991ApJ ... 376L..49M . doi : 10.1086 / 186100 .
- ^ Wagenblast, R .; Williams, DA; Millar, TJ; Nejad, LAM (1993). "Sobre el origen del NH en las nubes interestelares difusas" . Avisos mensuales de la Royal Astronomical Society . 260 (2): 420–424. Código bibliográfico : 1993MNRAS.260..420W . doi : 10.1093 / mnras / 260.2.420 .
- ^ Crutcher, RM; Watson, WD (1976). "Límite superior e importancia de la molécula de NH en nubes interestelares difusas". Revista astrofísica . 209 (1): 778–781. Código Bibliográfico : 1976ApJ ... 209..778C . doi : 10.1086 / 154775 .
- ^ Prasad, SS; Cazadora, WT (1980). "Un modelo de química en fase gaseosa en nubes interestelares. I. El modelo básico, biblioteca de reacciones químicas y química entre compuestos C, N y O". Serie de suplementos de revistas astrofísicas . 43 : 1. Bibcode : 1980ApJS ... 43 .... 1P . doi : 10.1086 / 190665 .
- ^ "La base de datos UMIST para astroquímica 2012 / astrochemistry.net" .
- ↑ Cernicharo, José; Goicoechea, Javier R .; Caux, Emmanuel (2000). "Detección de infrarrojo lejano de C 3 en Sagitario B2 e IRC +10216". Cartas de revistas astrofísicas . 534 (2): L199 – L202. Código Bibliográfico : 2000ApJ ... 534L.199C . doi : 10.1086 / 312668 . hdl : 10261/192089 . ISSN 1538-4357 .
- ^ Carnero, RS; Bernath, PF; Hinkle, KH (1999). "Espectroscopia de emisión infrarroja de NH: Comparación de un espectrógrafo criogénico echelle con un espectrómetro de transformada de Fourier". La Revista de Física Química . 110 (12): 5557. Código Bibliográfico : 1999JChPh.110.5557R . doi : 10.1063 / 1.478453 .
- ↑ Grevesse, N .; Lambert, DL; Sauval, AJ; Van Dishoeck, EF; Farmer, CB; Norton, RH (1990). "Identificación de las líneas de vibración-rotación solar de NH y la abundancia de nitrógeno solar". Astronomía y Astrofísica . 232 (1): 225. Bibcode : 1990A & A ... 232..225G . ISSN 0004-6361 .
- ^ Frebel, Anna; Collet, Remo; Eriksson, Kjell; Christlieb, Norbert; Aoki, Wako (2008). "HE 1327-2326, una estrella no evolucionada con [Fe / H] <–5.0. II. Nuevas abundancias corregidas 3D-1D de un espectro UVES de telescopio muy grande". Revista astrofísica . 684 (1): 588–602. arXiv : 0805.3341 . Código Bibliográfico : 2008ApJ ... 684..588F . doi : 10.1086 / 590327 . ISSN 0004-637X .
Enlaces externos [ editar ]
- Buchowiecki, Marcin (28 de enero de 2021). "Incertidumbre de las capacidades térmicas de alta temperatura: el estudio de caso del radical NH". El Journal of Physical Chemistry A . 125 (3): 795–800. doi : 10.1021 / acs.jpca.0c09512 .