En química, la isomerización o isomerización es el proceso en el que una molécula , ión o fragmento molecular se transforma en un isómero con una estructura química diferente . [1] La enolización es un ejemplo de isomerización, al igual que la tautomerización . [2] Cuando la isomerización ocurre intramolecularmente, se puede llamar reacción de reordenamiento .
Cuando la energía de activación para la reacción de isomerización es suficientemente pequeña, ambos isómeros existirán en un equilibrio dependiente de la temperatura entre sí. Se han calculado muchos valores de la diferencia de energía libre estándar , con una buena concordancia entre los datos observados y calculados. [3]
Ejemplos y aplicaciones [ editar ]
Alcanos [ editar ]
La isomerización esquelética ocurre en el proceso de craqueo , utilizado en la industria petroquímica . Además de reducir la longitud media de la cadena, los hidrocarburos de cadena lineal se convierten en isómeros ramificados en el proceso, como se ilustra en la siguiente reacción.
Los combustibles que contienen hidrocarburos ramificados se prefieren para los motores de combustión interna por su índice de octanaje más alto . [4]
Alquenos [ editar ]
Los alquenos terminales se isomerizan a alquenos internos en presencia de catalizadores metálicos. Este proceso se emplea en el proceso Shell de olefinas superiores para convertir alfa-olefinas en olefinas internas, que se someten a metátesis de olefinas . En ciertos tipos de reacciones de polimerización de alquenos, el caminar en cadena es un proceso de isomerización que introduce ramificaciones en los polímeros en crecimiento.
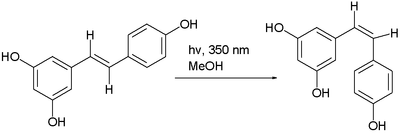
el isómero trans del resveratrol se puede convertir en el isómero cis en una reacción fotoquímica. [5]
Se ha observado una transposición térmica del azuleno a naftaleno .
Otros ejemplos [ editar ]
La isomería aldosa-cetosa , también conocida como transformación de Lobry de Bruyn-van Ekenstein, proporciona un ejemplo en la química de los carbohidratos .
Un ejemplo de isomerización organometálica es la producción de decafenilferroceno, [(η 5 -C 5 Ph 5 ) 2 Fe] a partir de su isómero de enlace . [6] [7]
Ver también [ editar ]
- Isomerización de epóxido promovida por bases
- Epimerización
- Racemización
- Tautomerización
- Isomería de ligamiento
Referencias [ editar ]
- ^ IUPAC , Compendio de terminología química , 2ª ed. (el "Libro de oro") (1997). Versión corregida online: (2006–) " isomerización ". doi : 10.1351 / goldbook.I03295
- ^ Antonov L (2016). Tautomería: conceptos y aplicaciones en ciencia y tecnología (1ª ed.). Weinheim, Alemania: Wiley-VCH. ISBN 978-3-527-33995-2.
- ^ Cómo calcular las energías de isomerización de moléculas orgánicas con métodos químicos cuánticos Stefan Grimme , Marc Steinmetz y Martin Korth J. Org. Chem. ; 2007 ; 72 (6) págs. 2118 - 2126; (Artículo) doi : 10.1021 / jo062446p
- ^ Karl Griesbaum, Arno Behr, Dieter Biedenkapp, Heinz-Werner Voges, Dorothea Garbe, Christian Paetz, Gerd Collin, Dieter Mayer, Hartmut Höke (2002). "Hidrocarburos". Enciclopedia de química industrial de Ullmann . Weinheim: Wiley-VCH. doi : 10.1002 / 14356007.a13_227 .CS1 maint: uses authors parameter (link)
- ^ Fotoisomerización de resveratrol: un experimento de investigación guiada integradora Elyse Bernard, Philip Britz-McKibbin, Nicholas Gernigon Vol. 84 No. 7 de julio de 2007 Journal of Chemical Education 1159.
- ^ Marrón, KN; Field, LD; Lay, PA; Lindall, CM; Masters, AF (1990). "(η 5 -Pentaphenylcyclopentadienyl) {1- (η 6 -fenil) 2,3,4,5-tetraphenylcyclopentadienyl} de hierro (II), [Fe (η 5 -C 5 Ph 5 ) {(η 6 -C 6 H 5 ) C 5 Ph 4 }], un isómero de enlace de decafenilferroceno ". J. Chem. Soc., Chem. Comun. (5): 408–410. doi : 10.1039 / C39900000408 .
- ^ Campo, LD; Hambley, TW; Humphrey, PA; Lindall, CM; Gainsford, GJ; Masters, AF; Stpierre, TG; Webb, J. (1995). "Decafenilferroceno". Aust. J. Chem . 48 (4): 851–860. doi : 10.1071 / CH9950851 .