 | |
| Nombres | |
|---|---|
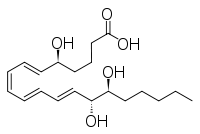
| Nombre IUPAC 5S, 14R, 15S-Trihidroxi-6E, 8Z, 10E, 12E -ácido eicosatetraenoico | |
| Otros nombres LXB4 | |
| Identificadores | |
Modelo 3D ( JSmol ) | |
| CHEBI | |
| ChemSpider | |
PubChem CID | |
| |
| |
| Propiedades | |
| C 20 H 32 O 5 | |
| Masa molar | 352,46508 g / mol |
Salvo que se indique lo contrario, los datos se proporcionan para materiales en su estado estándar (a 25 ° C [77 ° F], 100 kPa). | |
| Referencias de Infobox | |
Una lipoxina ( LX o Lx ), un acrónimo de producto de interacción lipoxigenasa , es un metabolito autacoide bioactivo del ácido araquidónico elaborado por varios tipos de células. Se clasifican como eicosanoides no clásicos y miembros de la familia especializada de mediadores pro-resolución (SPM) de metabolitos de ácidos grasos poliinsaturados (PUFA). Al igual que otros SPM, los LX se forman durante las respuestas inflamatorias y luego actúan para resolverlas . Inicialmente, se identificaron dos lipoxinas, lipoxina A 4 (LXA 4 ) y LXB 4, pero estudios más recientes han identificado epímeros de estos dos LX: las epi-lipoxinas , 15-epi-LXA 4 y 15-epi-LXB 4 respectivamente.
Historia [ editar ]
LXA 4 y LXB 4 fueron descritos por primera vez por Serhan, Hamberg y el laurato Nobel Samuelsson en 1984. [1] Informaron que los neutrófilos de la sangre humana , cuando se estimulan, producen estas dos lipoxinas y que los neutrófilos, cuando son estimulados por cualquiera de los LX, Generación y desgranulación del anión superóxido (O 2 - ) montadorespuestas. Ambas respuestas se consideran proinflamatorias en el sentido de que, si bien tienen como objetivo neutralizar los patógenos invasores y digerir material extraño, pueden contribuir a dañar los tejidos del huésped y, por lo tanto, prolongar y promover una mayor inflamación. Sin embargo, estudios posteriores encontraron que estas lipoxinas, así como sus epímeros, epi-LXA 4 y LXB 4 , actúan principalmente para amortiguar y resolver la inflamación, es decir, son agentes de señalización celular antiinflamatorios .
Bioquímica [ editar ]
Las lipoxinas se derivan enzimáticamente del ácido araquidónico , un ácido graso ω-6 . Estructuralmente, se definen como metabolitos del ácido araquidónico que contienen tres residuos hidroxilo (también denominados residuos hidroxi) y cuatro enlaces dobles . Esta definición estructural los distingue de otros SPM como las resolvinas , neuroprotectinas y maresinas , que son metabolitos de los ácidos grasos omega 3 , ácido eicosapentaenoico o ácido docosahexaenoico , así como una gama de metabolitos derivados de otros PUFA (ver pro- resolución de mediadores). Todos estos otros SPM tienen actividades y funciones similares, aunque no necesariamente idénticas, a las lipoxinas. [2] [3]
Síntesis [ editar ]
La formación de LX se conserva en una amplia gama de especies animales, desde peces hasta humanos. [4] La biosíntesis de los LX requiere dos ataques enzimáticos separados sobre el ácido araquidónico (AA). Un ataque implica la unión de un residuo de hidroperoxi (-O-OH) al carbono 15, la conversión de esta especie en un 14,15- epóxido y la resolución de este epóxido para formar 14,15-dihidroxi-eicosatetraenoato o 15-hidroxi -productos con eicosatetraenoato. Este paso es catalizado por enzimas con actividad de 15-lipoxigenasa que en humanos incluye ALOX15 , ALOX12 , ciclooxigenasa 2 tratada con aspirina y citocromo P450 de las subclases microsomal, mitocondrial o bacteriana.ALOX15B también puede conducir este metabolismo. El otro punto de ataque de la enzima forma un 5,6- epóxido que se resuelve en productos de 5,6-dihidroxi-eicosatetraenoato o 5-hidroxi-eicosatetraenoato; este paso catalizado por 5-lipoxigenasa (ALOX5). Por consiguiente, estas dobles oxigenaciones producen 5,6,15-trihidroxi- o 5,14,15-trihidroxi-eicosatetraenoatos. [5] [6] Las dobles oxigenaciones pueden realizarse dentro de un solo tipo de células que poseen ALOX5 y una enzima con actividad 15-lipoxigenasa o, alternativamente, por dos tipos de células diferentes, cada uno de los cuales posee una de estas actividades enzimáticas. En la última vía biosintética transcelular, un tipo de célula forma el 5,6-dihidroxi, 5-hidroxi, 14,15-dihidroxi o un 15-hidroxi-eicosatetraenoato, y luego pasa este intermedio a un segundo tipo de célula, que lo metaboliza a la LX final producto. [7] Por ejemplo, las LX están formadas por plaquetas que, al carecer de ALOX5, no pueden sintetizarlas. Más bien, los neutrófilos forman el 5,6-epóxido, leucotrieno A4 (LTA 4 ), a través de ALOX5 y lo pasan a las plaquetas que luego lo reducen en un producto de 5,6-dihidroxi-eicosateteraenoato y lo metabolizan más a través de ALOX12 para formar el 15- producto hidroxi, LXA 4 . [5] Los dos LX se distinguen de sus epímeros 15-epi-LTX por sus fórmulas estructurales:
- LxA 4 : 5 S , 6 R , 15 S -trihidroxi-7 E , 9 E , 11 Z , 13 E -ácido eicosatetraenoico
- LxB 4 : 5 S , 14 R , 15 S -trihidroxi-6 E , 8 Z , 10 E , 12 E -ácido eicosatetraenoico
- 15-epi-LxA 4 : 5 S , 6 R , 15 R -trihidroxi-7 E , 9 E , 11 Z , 13 E -ácido eicosatetraenoico
- 15-epi-LxB 4 : 5 S , 14 R , 15 R -trihidroxi-6 E , 8 Z , 10 E , 12 E -ácido eicosatrienoico
Tenga en cuenta que los dos LX tienen sus residuos 15-hidroxilo en la configuración de quiralidad S porque todas las enzimas ALOX forman productos 15 S -hidroxi AA. En contraste, los residuos 15-hidroxi de las dos epi-LX son 15 R productos de quiralidad, ya que se sintetizan por la ciclooxigenasa tratado con aspirina 2 o de la microsomal, mitocondrial, o bacterianas P450s citocromo ; estas enzimas forman casi total o parcialmente 15 R productos hidroxiácidos. [5] (15-Epi-LTA4 4 y 15-epi-LTB4 4 a veces se denominan AT-LxA 4 y AT-LxB 4, respectivamente, al reconocer su formación por la ciclooxigenasa 2 tratada con aspirina, es decir, por una ciclooxigenasa 2 manipulada con espirina T ).
Además de las rutas citadas anteriormente, se ha demostrado que otras rutas metabólicas transcelulares producen LX. Por ejemplo, la 5-lipoxigenasa (es decir, (ALOX5) en los neutrófilos y la 15-lipoxigenasa -1 (es decir, ALOX15) en los eritrocitos y reticulocitos inmaduros operan en serie para formar LxA4 4 y LxB4 4 ; esta vía también ocurre en interacciones seriales entre neutrófilos y eosinófilos. , entre el epitelio o los macrófagos / monocitos M2 y los neutrófilos, y el endotelio o el músculo esquelético y los neutrófilos. [5] [6] [7]
Estimulación de la síntesis [ editar ]
Las lipoxinas se forman comúnmente como consecuencia de estimular la producción de metabolitos proinflamatorios del ácido araquidónico. Sin embargo, ciertas citocinas como IFN-γ e IL-1β aumentan aún más la producción de lipoxinas (así como de otros metabolitos y proteínas antiinflamatorios de PUFA, por ejemplo, IL4 . [8]
Mayor metabolismo [ editar ]
Las LX se metabolizan rápidamente, principalmente por los macrófagos, a productos inactivos al oxidarse en el carbono 15 para formar productos 15- ceto (también denominados 15-oxo) LX por una 15-hidroxiprostaglandina deshidrogenasa ; 15-oxo-LXA 4 puede metabolizarse adicionalmente a 13,14-dihidro-LXA 4 por una oxidorreductasa . 15-Epi-LXA 4 y 15-epi-LXB 4 son más resistentes a la enzima de deshidrogenación que sus epímeros LX. [4] Como consecuencia del funcionamiento de esta vía anabólica , los LX tienen vidas medias muy cortas in vivo , los epi-LX tienen más tiempo in vivoSe han preparado semividas y, por tanto, mayores potencias que sus epímeros LX, y se han preparado lipoxinas sintéticas que son metabólicamente resistentes a esta vía, se han utilizado en modelos animales para estudiar las actividades de LX y se han probado como agentes terapéuticos potenciales en animales y seres humanos. [5] [7]
De manera similar a varios otros metabolitos AA como LTA4 y ácido 5-oxo-eicosatetraenoico , las células y los tejidos pueden convertir los LX en productos 20-hidroxi por oxidación omega ; también se ha demostrado que ligan LXA 4 al glutatión para formar cisteinil-lipoxinas , inicialmente LXC 4 , que luego se metaboliza secuencialmente a LXD 4 y LXE 4 . [9] El papel de estas vías para limitar o contribuir a la actividad de los LX no se ha evaluado completamente.
Sistema endocannabinoide [ editar ]
Se encuentra que el lípido antiinflamatorio lipoxina A 4 es un potenciador alostérico endógeno del receptor cannabinoide CB1 . La lipoxina A 4 mejora la afinidad de la anandamida en este receptor para ejercer efectos cannabimiméticos en el cerebro , mejorando alostéricamente la señalización de la AEA y potenciando así los efectos de este endocannabinoide tanto in vitro como in vivo . Además de esto, la lipoxina A 4 muestra un efecto protector dependiente del receptor CB1 contra la memoria espacial inducida por β-amiloidedeterioro en ratones. [10]
Análogos de lipoxina [ editar ]
Los análogos sintéticos relativamente estables, es decir, metabólicamente resistentes de los LX y los 15-epi-LXA 4 activados por aspirina pueden imitar muchas de las acciones antiinflamatorias, "pro-resolución" deseables de los LX nativos y se están probando para uso clínico. [11] [12] Estructuralmente, estos análogos de LX a menudo imitan a los LX en ser o muy parecido a un ácido graso trihidroxi de 20 carbonos, pero son resistentes a la inactivación metabólica de la 15-hidroxiprostaglandina deshidrogenasa al tener una modificación estructural voluminosa u otra cerca de su 15- residuos hidroxi. [5] Por ejemplo, ciertos análogos simplemente alteran la estructura de un LX al: reemplazar un átomo de hidrógeno con un residuo de metilo en el carbono 15 en LXA 4 para formar 15-metil-LXA 4; cambiar los últimos 4 carbonos de LXA 4 o 15-epi-LXA 4 a un residuo de 1-fenoxi o un residuo de 1-fenoxi-4-flúor para formar 16-fenoxi-LX 4 , 15-epi-15-fenoxi-LXA 4 , 16- (para-fluoro-fenoxi-LXA 4 , o 15-epi-16- (para-fluoro-fenoxi-LXA 4 ; y formando un enlace entre el carbono 9 y el carbono 14 de LXA 4 para formar un análogo de anillo de fenilo interno denominado aromático LXA 4 ; otros análogos estructurales más complejos en desarrollo incluyen los análogos de 15-epi-LXA 4 denominados ZK-142 y ZK994. [5]
Actividad biológica [ editar ]
Estudios celulares [ editar ]
En las fases iniciales de muchas respuestas inflamatorias agudas, los tejidos dañados, los patógenos invasores y otros eventos locales hacen que las células cercanas produzcan y liberen metabolitos proinflamatorios derivados del ácido araquidónico como: leucotrienos (LT), por ejemplo, LTB 4 , LTB 4 , LTC 4 , LTD 4 y LTE 4 ; ácidos hidroxieicosatetraenoicos (HETE), por ejemplo, 5-HETE y 12-HETE ; y oxoeicosanoides (oxo-ETE), por ejemplo, ácido 5-oxo-eicosatetraenoico (5-oxo-ETE) y 12-oxo-ETE. Estos metabolitos actúan directa o indirectamente para reclutar leucocitos circulantes, macrófagos tisulares y tejidos.células dendríticas al sitio del tejido alterado. La consecuente congregación de los diversos tipos de células promueve las vías transcelulares en la formación de mediadores pro-resolutivos (SPM) especializados, incluidos los LX, que luego proceden a estimular las respuestas celulares y tisulares que tienden a revertir las acciones de los mediadores proinflamatorios, amortiguando y disminuyendo. revertir la respuesta inflamatoria e iniciar la reparación tisular. [13]
LXA 4 y 15-epi-LXA 4 son ligandos del receptor de alta afinidad y activadores del receptor FPR2 . FPR2, que ahora se denomina receptor ALX, ALX / FPR o ALX / FPR2, es un receptor acoplado a proteína G inicialmente identificado como un receptor para el factor quimiotáctico de leucocitos , N-formilmetionina-leucil-fenilalanina (FMLP), en base a su similitud de la secuencia de aminoácidos con el receptor FMLP conocido, FPR1 . En ratones se encuentran al menos seis homólogos de este receptor. ALX / FPR es un receptor promiscuo (es decir, que interactúa con diversos ligandos) que se une y es activado por otros ligandos, incluidos: a)varios oligopéptidos de N-formilo que, como el FMLP, son liberados por microbios y mitocondrias o son análogos de los liberados por microbios y mitocondrias; b) oligopéptidos distintos de formilo derivados de microbios; c) ciertos polipéptidos que están asociados con el desarrollo de amiloidosis crónica y / o inflamación, incluidas las proteínas amiloide A sérico (SAA)), un péptido de 42 aminoácidos en forma de beta amiloide denominado Aβ42, Humanina y un fragmento soluble escindido (aminoácidos 274 -388) del receptor de uroquinasa ; y d) otros SPM, incluidos Resolvins RvD1, RvD2, RvD5, AT-RvD1 y RvD3 (vermediadores pro-resolutivos especializados ). [5] [7] [14]
LXA 4 y 15-epi-LXA 4 inhiben la quimiotaxis , la transmigración , la generación de superóxido, la activación de NF-κB y / o la generación de citocinas proinflamatorias (p. Ej. , IL8 , IL13 , IL12 e IL5 ) por neutrófilos, eosinófilos, monocitos , innatos células linfoides y / o macrófagos , así como suprimir la proliferación y producción de anticuerpos IgM e IgG por linfocitos B. Estas acciones parecen implicar la estimulación de vías de señalización antiinflamatorias, pero también el bloqueo de las acciones de otros ligandos ALX / FPR que simulan vías proinflamatorias. [5] [6] [13] [15] Los ratones transgénicos hechos para sobreexpresar ALX / FPR exhiben respuestas inflamatorias marcadamente reducidas a diversas agresiones. [4] LXA 4 y 15-epi-LXA 4 , cuando se introducen por administración intratecal en roedores, suprimen la percepción de dolor inflamatorio; esta acción puede involucrar al receptor ALX / FPR que se ha demostrado que está presente en los astrocitos espinales del animal de prueba y, según los estudios que utilizan 15-epi-LXA, la inhibición de NALP1 complejo de señalización del inflamasoma . [6] [16]
Por mecanismos que aún no se han identificado claramente, los dos LX también: a) estimulan la capacidad de matar bacterias de los leucocitos y las células epiteliales de las vías respiratorias; b) bloquear la producción de la citocina proinflamatoria, TNFα , mientras aumenta la producción de la citocina antiinflamatoria, CCR5 por los linfocitos T ; c) 'mejorar la capacidad de los monocitos y macrófagos para fagocitos (es decir, ingerir) y, por lo tanto, eliminar los neutrófilos y eosinófilos apoptóticos potencialmente dañinos de los sitios inflamatorios (véase Eferocitosis ), ya sea al afectar directamente a estas células o al estimular a las células NK para que lo hagan; d) hacen que varios tipos de células reduzcan la producción de proinflamatoriosespecies reactivas de oxígeno y expresión de moléculas de adhesión celular y aumento de la producción del inhibidor plaquetario, PGI2 y del vasodilatador, óxido nítrico ; e) inhibir la producción de citocinas proinflamatorias por células mesangiales , fibroblastos y otros tipos de células proinflamatorias; yf) reducir la percepción del dolor debido a la inflamación. [5] [6] [13] [15]
LXA 4 y 15-epi-LTA 4 también actúan movilizando factores de transcripción que regulan la expresión de varios genes reguladores de la inflamación. LXA 4 estimula varios tipos de células para promover la entrada de Nrf2 en el núcleo y, por lo tanto, aumentar la expresión de genes como la hemo oxigenasa-1 (HMOX1), que aumenta la producción del agente de señalización gaseoso antiinflamatorio, monóxido de carbono y genes. participa en la síntesis de glutatión , un producto que neutraliza el estrés oxidativo y el daño tisular inducido por oxidantes. [17] [18] Análogos estructurales metabólicamente resistentes de LXB 4 y 15-epi-LXA4 inhiben la formación de peroxinitrito (es decir, ONOO - ) para atenuar la movilización de factores de transcripción NFκB y AP-1 al reducir su acumulación en el núcleo de neutrófilos, monocitos y linfocitos; NFκB y AP-1 aumentan la expresión de genes proinflamatorios. Los dos LXB también desencadenan la activación de proteínas supresoras de señalización de citocinas (ver proteínas SOCS ) que, a su vez, inhiben la activación de factores de transcripción de proteínas STAT que regulan positivamente muchos genes que producen productos proinflamatorios. [7]
LXA 4 y 15-epi-LXA 4 también son antagonistas de alta afinidad del receptor de cisteinil leucotrienos 1 para los cuales los leucotrienos (LT) LTC4 , LTD4 y LTE4 son agonistas , es decir, los tres leucotrienos se unen y estimulan así la contracción del músculo liso, quimiotactaxis de eosinófilos , secreción de glándulas mucosas y varias otras respuestas proalérgicas en las células del pulmón, la piel y otros tejidos. [4] [19] (CysLT1 y ATX / FPR2 tienen una identidad de secuencia de aminoácidos del 47%. [19]) La capacidad de estos LX para bloquear las acciones de los tres LT puede contribuir a su capacidad para resolver reacciones alérgicas; por ejemplo, LXA4 relaja la contracción del músculo liso causada por los cisteinil leucotrienos en el ensayo de la bolsa de la mejilla de hámster y un análogo de 15-epi-LXAA 4 metabólicamente resistente inhibe de forma potente la hipersensibilidad e inflamación de las vías respiratorias provocada por alérgenos en un modelo de ratón. [4] [19] [20]
A concentraciones más altas (> 30 nmoles / litro), LXA 4 se une a AHR , el receptor de arilhidrocarburo; después de esta unión, AHR ingresa al núcleo, donde se une con el translocador nuclear AhR (ARNT). El complejo AHR / ARNT se une a elementos de respuesta xenobióticos para activar la transcripción de genes, la mayoría de los cuales están involucrados principalmente en el metabolismo xenobiótico. Estos genes incluyen SOCS2 (es decir, supresor de la señalización de citocinas 2), CYP1A1 , CYP1A2 , CYP1B1 , subunidad de glutatión S-transferasa Ya, quinona oxidorreductasa, UDP-glucuronosiltransferasa y familia de aldehído deshidrogenasa 3, miembro A1. Esta actividad de LXA 4 se ha demostrado solo en células murinas. [21] [22]
LXA 4 se une y activa el receptor alfa de estrógeno . En esta capacidad, imita una molécula estrogénica para estimular las células epiteliales endometriales humanas in vitro y el tejido uterino de ratón in vivo . [23] [24]
Las acciones de LXB 4 y 15-epi-LXB 4 han sido mucho menos definidas que las de sus análogos LXA 4 . Se desconoce su mecanismo de estimulación de las células diana (por ejemplo, receptores). Se ha demostrado que uno o ambos de estos análogos inhiben el reclutamiento de neutrófilos en los sitios de inflamación, inhiben la citotoxicidad de las células NK , estimulan el reclutamiento de monocitos en los sitios inflamatorios, aumentan la fagocitosis de los macrófagos y suprimen la percepción del dolor inflamatorio en roedores. [5] [6] [25]
Estudios de modelos animales [ editar ]
Inflamación no infecciosa [ editar ]
Se ha demostrado que una o más de las lipoxinas o sus análogos metabólicamente resistentes suprimen, limitan la gravedad y / o aumentan la supervivencia en una amplia gama de enfermedades inflamatorias y alérgicas según se evaluó en estudios de modelos de ratones y ratas. Estos estudios incluyen modelos de evocación experimental: endometriosis [26] , colitis , peritonitis ; pancreatitis ; inflamación de los riñones y glomerulonefritis ; asma pulmonar , lesión pulmonar inducida por ácido, fibrosis quística , pleuresía , inflamación del cerebro y el componente inflamatorio de la enfermedad de Alzheimer; lesiones por isquemia-reperfusión vascular en varios órganos, incluidos el corazón y las extremidades traseras; alógrafo Rechazo de trasplantes de corazón, riñón y médula ósea ; artritis ; dermatitis ; periodontitis ; inflamación de la córnea ; y dolor e hiperalgesia basados en inflamación . [5] [7] [4]
[ editar ]
Las lipoxinas tienen efectos protectores en modelos animales de inflamación basada en infecciones: a) LXA 4 y un análogo de LXA 4 reducen la inflamación sistémica y mejoran la supervivencia en modelos de rata de sepsis bacteriana gramnegativa ; [13] [27] b) 15-epi-LXA 4 suprimió la lesión pulmonar (es decir, choque pulmonar o síndrome de dificultad respiratoria aguda ) causada por la inyección intraperitoneal de Escherichia coli en ratones; c) los ratones transgénicos con deficiencia en la síntesis de lipoxinas por deleción de su gen Alox5 eran más susceptibles a los efectos inflamatorios y letales de Toxoplasma gondiiy fueron rescatados de estos defectos por LXA4 4 ; [28] d) LXA 4 restauró la función de los macrófagos causada por el virus sincitial respiratorio en ratones transgénicos con síntesis deficiente de lipoxinas por deleción del gen Alox5 ; [13] e) LXA 4 mejoró la periodontitis infecciosa en modelos de conejos y porcinos. [13] f) 15-epi-LXA 4 disminuyó los niveles sanguíneos del parásito, disminuyó la inflamación cardíaca y aumentó la supervivencia en un modelo de ratón de la enfermedad de Chagas inducida por Trypanosoma cruzi ; [28] f) '15-epi-LXA 4supervivencia prolongada en un modelo de ratón de paludismo cerebral inducido por Plasmodium berghei ; [28] y g) LXA 4 acorta la duración de la respuesta alérgica a la infestación parasitaria, costaricensis Angiostrongylus . [13]
Sin embargo, las lipoxinas también tienen efectos nocivos en estos modelos: la infección por aerosol con Mycobacterium tuberculosis en ratones transgénicos defectuosos en ALOX5, que contribuye a la síntesis de LX, exhibió una inflamación mucho menos severa y mejor supervivencia que los ratones de control; [28] y el tratamiento de los ratones transgénicos con LXA 4 oral revirtió el efecto protector de la deleción de ALOX5. [28]
Estudios humanos [ editar ]
Estudios preclínicos [ editar ]
Se han detectado LX y epi-LX en varios tejidos humanos que experimentan una amplia gama de reacciones inflamatorias, reacciones alérgicas y otras afecciones, como en la sangre de pacientes sometidos a angioplastia coronaria o ejercicio extenuante. [5] [6] [25] LXA 4 inhibe la acción de contracción bronquial de LTC4 y relaja los bronquios precontraídos en individuos asmáticos. [4]
El herpesvirus asociado al sarcoma de Kaposi (KSHV) provoca la transformación maligna de las células humanas y es responsable del sarcoma de Kaposi y del linfoma de efusión primaria , dos cánceres que afectan en particular a los seres humanos infectados por el VIH . Los estudios en el sarcoma de Kaposi humano y en las células del linfoma de derrame primario encuentran que: a) El KSHV promueve la producción de citocinas proinflamatorias, lipoxigenasas, ciclooxigenasa y metabolitos de las dos últimas clases de enzimas, mientras que suprime la producción de agentes de señalización antiinflamatorios como LXA 4, aparentemente como una estrategia para promover su latencia y capacidad de transformación maligna; b) las células del sarcoma de Karposi y del linfoma de derrame primario expresan el receptor ALX / FPR; yc) el tratamiento de estas últimas células con LXA 4 o 15-epi-LXA 4 invierte este perfil de pro-malignidad de señalización proinflamatoria por un mecanismo dependiente de ALX / FPR. Estos estudios sugieren que las dos LX o sus análogos deberían probarse en modelos animales para determinar si podrían ser útiles para tratar las dos neoplasias malignas humanas. [7] [29]
Estudios clínicos [ editar ]
En un ensayo controlado aleatorio , la aplicación tópica de 15-epi-LXA4 o un análogo comparativamente estable de LXB4, 15 R / S -metil-LXB4, redujo la gravedad del eccema en un estudio de 60 lactantes. [30] [31]
Actualmente, BLXA4, un análogo de lipoxina, se encuentra en fase de ensayo clínico 1 y actualmente está reclutando voluntarios para el tratamiento de la gingivitis oral (consulte: Seguridad y eficacia preliminar del enjuague oral BLXA4-ME análogo de lipoxina para el tratamiento de la gingivitis (BLXA4) en https: // Clinicaltrials.gov/ct2/show/NCT02342691?term=Lipoxin&rank=3 ). [7]
Ver también [ editar ]
- Epi-lipoxinas
- Mediadores pro-resolutivos especializados
- Ácido 15-hidroxieicosatetraenoico
Referencias [ editar ]
- ^ Serhan CN, Hamberg M, Samuelsson B (1984). "Trihidroxitetraenos: una nueva serie de compuestos formados a partir del ácido araquidónico en leucocitos humanos". Comunicaciones de investigación bioquímica y biofísica . 118 (3): 943–9. doi : 10.1016 / 0006-291x (84) 91486-4 . PMID 6422933 .
- ^ Qu Q, Xuan W, Fan GH (2015). "Funciones de las resolvinas en la resolución de la inflamación aguda". Cell Biology International . 39 (1): 3-22. doi : 10.1002 / cbin.10345 . PMID 25052386 . S2CID 10160642 .
- ^ Weylandt KH (2016). "Mediadores y metabolitos derivados del ácido docosapentaenoico - El nuevo mundo de la medicina mediadora de lípidos en pocas palabras". Revista europea de farmacología . 785 : 108-15. doi : 10.1016 / j.ejphar.2015.11.002 . PMID 26546723 .
- ↑ a b c d e f g Levy BD (2005). "Lipoxinas y análogos de lipoxinas en el asma". Prostaglandinas, leucotrienos y ácidos grasos esenciales . 73 (3–4): 231–7. doi : 10.1016 / j.plefa.2005.05.010 . PMID 16046112 .
- ↑ a b c d e f g h i j k l m Romano M, Cianci E, Simiele F, Recchiuti A (2015). "Lipoxinas y lipoxinas activadas por aspirina en la resolución de la inflamación". Revista europea de farmacología . 760 : 49–63. doi : 10.1016 / j.ejphar.2015.03.083 . PMID 25895638 .
- ↑ a b c d e f g Markworth JF, Maddipati KR, Cameron-Smith D (2016). "Funciones emergentes de mediadores de lípidos pro-resolución en respuestas inmunológicas y adaptativas a la lesión muscular inducida por el ejercicio". Ejercicio de revisión de inmunología . 22 : 110–34. PMID 26853678 .
- ↑ a b c d e f g h Chandrasekharan JA, Sharma-Walia N (2015). "Lipoxinas: la forma de la naturaleza para resolver la inflamación" . Revista de investigación sobre inflamación . 8 : 181–92. doi : 10.2147 / JIR.S90380 . PMC 4598198 . PMID 26457057 .
- ^ McMahon, Blaithin y ahijado, Catherine (2004). "Lipoxinas: reguladores endógenos de la inflamación" . Revista estadounidense de fisiología. Fisiología renal . 286 (2): F189-201. doi : 10.1152 / ajprenal.00224.2003 . PMID 14707005 . Archivado desde el original el 25 de enero de 2010 . Consultado el 7 de febrero de 2006 . CS1 maint: discouraged parameter (link) Artículo de revisión invitado.
- ^ Powell WS, Chung D, Gravel S (1995). "El ácido 5-oxo-6,8,11,14-eicosatetraenoico es un potente estimulador de la migración de eosinófilos humanos". J. Immunol . 154 (8): 4123–32. PMID 7706749 .
- ^ Pamplona, Fabricio A .; Ferreira, Juliano; Menezes de Lima, Octávio; Duarte, Filipe Silveira; Bento, Allisson Freire; Forner, Stefânia; Villarinho, Jardel G .; Bellocchio, Luigi; Wotjak, Carsten T. (18 de diciembre de 2012). "La lipoxina A4 antiinflamatoria es un potenciador alostérico endógeno del receptor cannabinoide CB1" . Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 109 (51): 21134–21139. doi : 10.1073 / pnas.1202906109 . ISSN 0027-8424 . PMC 3529012 . PMID 23150578 .
- ^ McMahon B, Mitchell S, Brady HR (2001). "Lipoxinas: revelaciones sobre resolución". Trends Pharmacol. Sci . 22 (8): 391–5. doi : 10.1016 / S0165-6147 (00) 01771-5 . PMID 11478982 .
- ^ Liposucción de Tampa
- ↑ a b c d e f g Basil MC, Levy BD (2016). "Mediadores pro-resolutivos especializados: reguladores endógenos de infección e inflamación" . Reseñas de la naturaleza. Inmunologia . 16 (1): 51–67. doi : 10.1038 / nri.2015.4 . PMC 5242505 . PMID 26688348 .
- ^ Ye RD, Boulay F, Wang JM, Dahlgren C, Gerard C, Parmentier M, Serhan CN, Murphy PM (2009). "Unión Internacional de Farmacología Básica y Clínica. LXXIII. Nomenclatura de la familia del receptor del péptido formilo (FPR)" . Revisiones farmacológicas . 61 (2): 119–61. doi : 10.1124 / pr.109.001578 . PMC 2745437 . PMID 19498085 .
- ^ a b Chiang N .; Arita M. y Serhan CN. (2005). "Circuito antiinflamatorio: lipoxina, lipoxinas activadas por aspirina y su receptor ALX". Prostaglandinas, Leucotrienos y Ácidos Grasos Esenciales . 73 (3-4): 163-177. doi : 10.1016 / j.plefa.2005.05.003 . PMID 16125378 .
- ^ Li Q, Tian Y, Wang ZF, Liu SB, Mi WL, Ma HJ, Wu GC, Wang J, Yu J, Wang YQ (2013). "Implicación del inflamasoma espinal NALP1 en el dolor neuropático y analgesia inducida por aspirina-15-epi-lipoxina A4". Neurociencia . 254 : 230–40. doi : 10.1016 / j.neuroscience.2013.09.028 . PMID 24076348 . S2CID 207253564 .
- ^ Chen XQ, Wu SH, Zhou Y, Tang YR (2013). "La hemo oxigenasa-1 inducida por lipoxina A4 protege a los cardiomiocitos contra la lesión por hipoxia / reoxigenación a través de la activación de p38 MAPK y el complejo Nrf2 / ARE" . PLOS ONE . 8 (6): e67120. doi : 10.1371 / journal.pone.0067120 . PMC 3691153 . PMID 23826208 .
- ^ Wu L, Li HH, Wu Q, Miao S, Liu ZJ, Wu P, Ye DY (2015). "La lipoxina A4 activa la vía Nrf2 y mejora el daño celular en astrocitos corticales cultivados expuestos a la privación de oxígeno-glucosa / agresiones por reperfusión". Revista de Neurociencia Molecular . 56 (4): 848–57. doi : 10.1007 / s12031-015-0525-6 . PMID 25702137 . S2CID 14077073 .
- ↑ a b c Gronert K, Martinsson-Niskanen T, Ravasi S, Chiang N, Serhan CN (2001). "Selectividad de los receptores de leucotrieno D (4), leucotrieno B (4) y lipoxina A (4) recombinantes humanos con 15-epi-LXA (4) activada por aspirina y regulación de las respuestas vasculares e inflamatorias" . La Revista Estadounidense de Patología . 158 (1): 3–9. doi : 10.1016 / S0002-9440 (10) 63937-5 . PMC 1850279 . PMID 11141472 .
- ^ Wan KS, Wu WF (2007). "Eicosanoides en el asma". Acta Paediatrica Taiwanica = Taiwán Er Ke Yi Xue Hui Za Zhi . 48 (6): 299-304. PMID 18437962 .
- ^ Schaldach CM, Riby J, Bjeldanes LF (junio de 1999). "Lipoxina A4: una nueva clase de ligando para el receptor Ah". Bioquímica . 38 (23): 7594–600. doi : 10.1021 / bi982861e . PMID 10360957 .
- ↑ Bennett M, Gilroy DW (2016). "Mediadores de lípidos en la inflamación" (PDF) . Espectro de microbiología . 4 (6): 343–366. doi : 10.1128 / microbiolspec.MCHD-0035-2016 . ISBN 9781555819187. PMID 27837747 .
- ^ Russell R, Gori I, Pellegrini C, Kumar R, Achtari C, Canny GO (diciembre de 2011). "Lipoxin A4 es un modulador de receptor de estrógeno novedoso". FASEB J . 25 (12): 4326–37. doi : 10.1096 / fj.11-187658 . PMID 21885654 . S2CID 2715055 .
- ^ Schaldach CM, Riby J, Bjeldanes LF (1999). "Lipoxina A4: una nueva clase de ligando para el receptor Ah". Bioquímica . 38 (23): 7594–600. doi : 10.1021 / bi982861e . PMID 10360957 .
- ↑ a b Elajami TK, Colas RA, Dalli J, Chiang N, Serhan CN, Welty FK (2016). "Mediadores lipídicos proresolving especializados en pacientes con enfermedad de las arterias coronarias y su potencial para la remodelación del coágulo" . Revista FASEB . 30 (8): 2792–801. doi : 10.1096 / fj.201500155R . PMC 4970606 . PMID 27121596 .
- ^ Kumar R, Clerc AC, Gori I, Russell R, Pellegrini C, Govender L, Wyss JC, Golshayan D, Canny GO (febrero de 2014). "La lipoxina A4 previene la progresión de la endometriosis de Novo y establecida en un modelo de ratón atenuando la producción de prostaglandina E2 y la señalización de estrógenos" . PLOS ONE . 9 (2): e89742, 1–14. doi : 10.1371 / journal.pone.0089742 . PMC 3933674 . PMID 24587003 .
- ^ Wu B, Walker J, Spur B, Rodríguez A, Yin K (2015). "Efectos de la lipoxina A4 sobre las acciones antimicrobianas de los neutrófilos en la sepsis". Prostaglandinas, leucotrienos y ácidos grasos esenciales . 94 : 55–64. doi : 10.1016 / j.plefa.2014.11.005 . PMID 25476955 .
- ↑ a b c d e Russell CD, Schwarze J (2014). "El papel de los mediadores de lípidos pro-resolución en enfermedades infecciosas" . Inmunologia . 141 (2): 166–73. doi : 10.1111 / imm.12206 . PMC 3904237 . PMID 24400794 .
- ↑ Chandrasekharan JA, Huang XM, Hwang A, Sharma-Walia N (2016). "Alterando el microambiente de lipoxinas antiinflamatorias: una nueva visión de la patogénesis del KSHV" . Revista de Virología . 90 (24): 11020–11031. doi : 10.1128 / JVI.01491-16 . PMC 5126361 . PMID 27681120 .
- ^ Wu SH, Chen XQ, Liu B, Wu HJ, Dong L (2013). "Eficacia y seguridad de la 15 (R / S) -metil-lipoxina A (4) en el tratamiento tópico del eccema infantil". The British Journal of Dermatology . 168 (1): 172–8. doi : 10.1111 / j.1365-2133.2012.11177.x . PMID 22834636 . S2CID 31721094 .
- ^ Aslam I, Sandoval LF, Feldman SR (2014). "Novedades en el tratamiento tópico de las enfermedades alérgicas de la piel". Opinión actual en alergia e inmunología clínica . 14 (5): 436–50. doi : 10.1097 / ACI.0000000000000093 . PMID 25061854 . S2CID 20136504 .
Enlaces externos [ editar ]
- Lipoxinas en los encabezados de temas médicos (MeSH) de la Biblioteca Nacional de Medicina de EE. UU .
