 | |
 | |
| Nombres | |
|---|---|
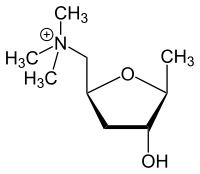
| Nombre IUPAC 2,5-Anhidro-1,4,6-tridesoxi-6- (trimetilamonio) - D - ribo -hexitol | |
| Otros nombres L - (+) - muscarina, muscarina, (2 S , 4 R , 5 S ) - (4-hidroxi-5-metil-tetrahidrofuran-2-ilmetil) -trimetil-amonio | |
| Identificadores | |
Modelo 3D ( JSmol ) | |
| CHEMBL | |
| ChemSpider | |
| Tarjeta de información ECHA | 100.005.541 |
PubChem CID | |
| UNII | |
Tablero CompTox ( EPA ) | |
| |
| |
| Propiedades | |
| C 9 H 20 NO 2 + | |
| Masa molar | 174,26 g / mol |
Salvo que se indique lo contrario, los datos se proporcionan para materiales en su estado estándar (a 25 ° C [77 ° F], 100 kPa). | |
| Referencias de Infobox | |
La muscarina , L - (+) - muscarina o muscarina es un producto natural que se encuentra en ciertos hongos , particularmente en las especies Inocybe y Clitocybe , como la mortal C. dealbata . También se ha descubierto que los hongos de los géneros Entoloma y Mycena contienen niveles de muscarina que pueden ser peligrosos si se ingieren. Se ha encontrado muscarina en trazas inofensivas en Boletus , Hygrocybe , Lactarius y Russula . También se encuentran trazas de concentraciones de muscarina en Amanita muscaria., Aunque el compuesto farmacológicamente más relevante de este hongo es el Z-drogas -como alcaloide muscimol . Los cuerpos fructíferos de A. muscaria contienen una dosis variable de muscarina, generalmente alrededor del 0,0003% del peso fresco. Esto es muy bajo y los síntomas de toxicidad ocurren muy raramente. Inocybe y Clitocybe contienen concentraciones de muscarina de hasta el 1,6%. [1]
La muscarina es un agonista no selectivo de los receptores muscarínicos de acetilcolina .
Historia [ editar ]
El nombre muscarina deriva del de Amanita muscaria , de la cual fue aislada por primera vez, por los químicos alemanes Oswald Schmiedeberg y Richard Koppe de la Universidad de Dorpat , quienes informaron sobre sus hallazgos en 1869. [2] El nombre específico del hongo a su vez proviene del Musca latina para mosca porque el hongo se usaba a menudo para atraer y atrapar moscas, de ahí también su nombre común, "agárico de mosca".
La muscarina fue la primera sustancia parasimpaticomimética jamás estudiada y causa una activación profunda del sistema nervioso parasimpático periférico que puede terminar en colapso circulatorio y muerte. Al ser una sal de amonio cuaternario , la muscarina se absorbe menos completamente en el tracto gastrointestinal que las aminas terciarias y no atraviesa la barrera hematoencefálica . [3]Los agonistas muscarínicos activan los receptores muscarínicos mientras que los agonistas nicotínicos activan los receptores de nicotina. Ambos son colinomiméticos de acción directa; producen sus efectos uniéndose y activando receptores colinérgicos. Franz Jellinek y sus colegas dieron la prueba final de la estructura en 1957 con la ayuda del análisis de difracción de rayos X ; [4] Jellinek describió además la estructura tridimensional de la molécula utilizando cloruro de muscarina. [5] Estos nuevos hallazgos pusieron en marcha la investigación sobre la farmacología de la muscarina y sustancias similares a la muscarina que están relacionadas estructuralmente con la acetilcolina .
Estructura y reactividad [ editar ]
La muscarina imita la función del neurotransmisor natural acetilcolina en la parte muscarínica del sistema nervioso colinérgico, a pesar de la estructura menos flexible debido al anillo de cinco miembros en el esqueleto molecular. Con la excepción del oxígeno de doble enlace, toda la estructura de acetilcolina está presente en el lado inferior derecho de la muscarina (consulte la Figura 3 a continuación para comparar ambas estructuras). [6]
Hay dos formas espejo de muscarina, llamadas: 2S-muscarina y 2R-muscarina.
Figura 1. La fórmula estructural de 2S-muscarina.
Figura 2. La fórmula estructural de 2R-muscarina.
Figura 3. Acetilcolina para comparación.
Síntesis eficiente de (+) - muscarina [ editar ]
El siguiente esquema representa una forma muy eficiente de síntesis de (+) - muscarina según los científicos Chan y Li en la revista canadiense de química en 1992. [7] S - (-) - Lactato de etilo (2) (Figura 4) ) se convierte en el 2,6-diclorobencil éter (3). La reducción con hidruro de diisobutilaluminio (DIBAL) del éter 2,6-diclorobencilo da el aldehído (4). El tratamiento del aldehído bruto con bromuro de alilo y polvo de zinc en agua con NH 4 Cl como catalizador dio como resultado una mezcla anti: sin de 5a y 5b. Tratamiento de 5a con yodo en CH 3CN a 0 ° C da el producto ciclado 6a. Finalmente, el tratamiento de 6a con un exceso de trimetilamina en etanol dio (+) - muscarina (2S, 4R, 5S). Una secuencia de reacción similar con 5b dio (+) - epimuscarina (7). [7]
Otras síntesis [ editar ]
Se puede sintetizar de varias formas a partir de sustancias completamente diferentes, [8] [9] [10] [11] [12] [13] [14] [15] [16] [17] particularmente a partir de 2,5-dimetil- 3-carboximetil flurano.
Farmacología [ editar ]
Farmacodinámica [ editar ]
Imita muscarina la acción del neurotransmisor acetilcolina por agonizar receptores muscarínicos de acetilcolina . Estos receptores recibieron el nombre de muscarina, para diferenciarlos de los otros receptores de acetilcolina ( receptores nicotínicos ), que comparativamente no responden a la muscarina. Hay 5 tipos diferentes de receptores muscarínicos; M 1 , M 2 , M 3 , M 4 y M 5 . La mayoría de los tejidos expresan una mezcla de subtipos. Los subtipos M 2 y M 3 median las respuestas muscarínicas enTejidos autonómicos periféricos . Los subtipos M 1 y M 4 son más abundantes en el cerebro y los ganglios autónomos . Los receptores impares, M 1 , M 3 y M 5 , interactúan con las proteínas G q para estimular la hidrólisis de fosfoinositidos y la liberación de calcio intracelular. Por el contrario, los receptores pares, M 2 y M 4 , interactúan con G iproteínas para inhibir la adenilil ciclasa, lo que da como resultado una disminución de la concentración intracelular de monofosfato de adenosina cíclico (cAMP). La mayoría de los agonistas de los receptores de muscarina no son selectivos para los subtipos. [18]
Los receptores muscarínicos también envían señales a través de otras vías, por ejemplo, a través de la modulación del complejo G beta-gamma de los canales de potasio . Esto permite que la muscarina module la excitabilidad celular a través del potencial de membrana .
Metabolismo [ editar ]
Existe una escasez de investigación sobre el metabolismo de la muscarina en el cuerpo humano, lo que sugiere que los humanos no metabolizan este compuesto. Aunque ha habido una extensa investigación en el campo del metabolismo de la acetilcolina por la acetilcolinesterasa , esta enzima no metaboliza la muscarina, lo que explica en parte la posible toxicidad del compuesto. La muscarina es fácilmente soluble en agua. La forma más probable de que la muscarina salga de la sangre es a través del aclaramiento renal; eventualmente dejará el cuerpo en la orina. [19]
Usos médicos [ editar ]
Esta sección necesita más referencias médicas para su verificación o se basa demasiado en fuentes primarias . ( noviembre de 2019 ) |
Los agonistas muscarínicos se utilizan como fármacos en el tratamiento del glaucoma , íleo posoperatorio , megacolon congénito , retención urinaria y xerostomía . La muscarina está contraindicada en personas con enfermedades que las hacen susceptibles a la estimulación parasimpática, personas que padecen asma o EPOC o personas que padecen úlcera péptica . Además, a las personas con una obstrucción en el tracto gastrointestinal o urinario no se les prescribe muscarina porque agravará la obstrucción y hará que se acumule presión que puede conducir a una perforación.
Eficacia [ editar ]
Dado que la muscarina actúa sobre el receptor muscarínico de acetilcolina , la mejor comparación se puede hacer con la acetilcolina, que normalmente actúa sobre este receptor. Se afirma que la muscarina pura en comparación con la acetilcolina pura en la mayoría de los casos es más potente, su acción es siempre más lenta pero más duradera que la acetilcolina. Una posible explicación de este comportamiento duradero podría ser que la muscarina no se hidroliza por la acetilcolinesterasa en la hendidura sináptica. [20]
Toxicología [ editar ]
La intoxicación por muscarina se caracteriza por miosis , visión borrosa, aumento de la salivación , sudoración excesiva , lagrimeo , secreciones bronquiales, broncoconstricción, bradicardia , calambres abdominales, aumento de la secreción de ácido gástrico, diarrea y poliuria . Si la muscarina llega al cerebro puede causar temblores , convulsiones e hipotermia . Los ventrículos cardíacos contienen receptores muscarínicos que median una disminución en la fuerza de las contracciones que conduce a una presión arterial más baja. Si se administra muscarina por vía intravenosa, la muscarina puede desencadenar unainsuficiencia circulatoria con paro cardíaco . [1] Los síntomas de intoxicación con hongos ricos en muscarina, especialmente Inocybe , son muy típicos: los síntomas comienzan temprano, después de un cuarto a dos horas, con dolor de cabeza, náuseas, vómitos y constricción de la faringe . Luego aparecieron salivación, lagrimeo y transpiración difusa, combinados con miosis, acomodación alterada y visión reducida. El cólico gástrico y del intestino delgado provoca diarrea y hay una necesidad dolorosa de orinar. La broncoconstricción conduce a ataques de asma y disnea severa , y bradicardia combinada con hipotensión marcada.y la vasodilatación produce un choque circulatorio . Se ha informado la muerte después de 8 a 9 horas en aproximadamente el 5% de los casos, pero se puede evitar por completo mediante un diagnóstico y tratamiento oportunos con atropina . [21]
Antídoto [ editar ]
Los antimuscarínicos como la atropina se pueden utilizar como antídoto para la muscarina. La atropina es, como la muscarina, un alcaloide pero, a diferencia de la muscarina, es un antagonista de los receptores muscarínicos. Por tanto, inhibe los efectos de la acetilcolina. Los antagonistas muscarínicos dilatan la pupila y relajan el músculo ciliar, se utilizan en el tratamiento de la uveítis inflamatoria y se asocian con glaucoma. También se utilizan para tratar la incontinencia urinaria y enfermedades caracterizadas por hipermotilidad intestinal como el síndrome del intestino irritable . Los antagonistas muscarínicos a menudo se denominan parasimpaticolíticos porque tienen el mismo efecto que los agentes que bloquean los nervios parasimpáticos posganglionares.
Referencias [ editar ]
- ^ a b Lurie, Y; Wasser, SP; Taha, M; Shehade, H; Nijim, J; Hoffmann, Y; Base, F; Vardi, M; Lavon, O; Suaed, S; Bisharat, B; Bentur, Y (julio de 2009). "Envenenamiento por hongos de especies del género Inocybe (hongo de cabeza de fibra): una serie de casos con identificación exacta de especies". Toxicología clínica . 47 (6): 562–5. doi : 10.1080 / 15563650903008448 . PMID 19566380 . S2CID 205902282 .
- ↑ Schmiedeberg, O .; Koppe, R. (1869). Das Muscarin, das giftige alcaloide des Fliegenpilzes ( Agaricus muscarius L.), seine Darstellung, Chemischen Eigenschaften, physiologischen Wirkungen, toxicologische Bedeutung und sein Verhältniss zur Pilzvergiftung im allgemeinen [ muscarina, el alcaloide venenoso de la mosca agárico ( Agaricus muscarius L.), su preparación, propiedades químicas, efectos fisiológicos, importancia toxicológica y su relación con la intoxicación por hongos en general ]. Leipzig: Verlag von FCW Vogel.
- ^ Pappano Achilles J, "Capítulo 7. Fármacos activadores de colinoceptores e inhibidores de la colinesterasa" (Capítulo). Katzung BG: Farmacología básica y clínica, 11e Archivado el 10 de septiembre de 2009 en la Wayback Machine.
- ↑ Kögl, F .; Salemink, CA; Schouten, H .; Jellinek, F. (1957). "Über Muscarin. III". Recueil des Travaux Chimiques des Pays-Bas (en alemán). 76 (2): 109-127. doi : 10.1002 / recl.19570760204 .
- ^ Jellinek, F. (1957). "La estructura de la muscarina". Acta Crystallographica . 10 (4): 277–280. doi : 10.1107 / S0365110X57000845 .
- ^ Frydenvang, K .; Jensen, B. (15 de mayo de 1993). "Estructuras de picrato de muscarina y tetrafenilborato de muscarina" . Acta Crystallographica Sección C . 49 (5): 985–990. doi : 10.1107 / S0108270192012198 .
- ^ a b Chan, TH; Li, CJ (noviembre de 1992). "Una síntesis concisa de (+) - muscarina". Revista canadiense de química . 70 (11): 2726–2729. doi : 10.1139 / v92-346 .
- ↑ Kögl, F .; Salemink, CA; Schouten, H .; Jellinek, F. (2010). "Über Muscarin. III". Recueil des Travaux Chimiques des Pays-Bas . 76 (2): 109. doi : 10.1002 / recl.19570760204 .
- ↑ Kögl, F .; Cox, HC; Salemink, CA (1957). "Über Muscarin". Experientia . 13 (4): 137–8. doi : 10.1007 / BF02158130 . PMID 13447893 . S2CID 38142806 .
- ↑ Corrodi, H .; Hardegger, E .; Kögl, F .; Zeller, P. (1957). "Synthese von Stereoisomeren des Muscarins". Experientia . 13 (4): 138–9. doi : 10.1007 / BF02158131 . PMID 13447894 . S2CID 28914321 .
- ^ Cox, HC; Hardegger, E .; Kögl, F .; Liechti, P .; Lohse, F .; Salemink, CA (1958). "Über Muscarin. 9. Mitteilung. Über die Synthese von racemischem Muscarin, seine Spaltung in die Antipoden und die Herstellung von (-) - Muscarin aus D-Glucosamin". Helvetica Chimica Acta . 41 : 229-234. doi : 10.1002 / hlca.660410129 .
- ^ Matsumoto, T .; Ichihara, A .; Ito, N. (1969). "Una síntesis simple, estereoespecífica de dl-muscarina y dl-alomuscarina". Tetraedro . 25 (24): 5889. doi : 10.1016 / S0040-4020 (01) 83096-9 .
- ^ Aún así, WC; Schneider, JA (1980). "Síntesis controlada por quelación de (. + -.) - muscarina". La Revista de Química Orgánica . 45 (16): 3375. doi : 10.1021 / jo01304a056 .
- ^ Merlán, J .; Au-Young, Y.-K .; Belleau, B. (1972). "Una síntesis conveniente de L (+) - Muscarine". Revista canadiense de química . 50 (20): 3322. doi : 10.1139 / v72-532 .
- ^ Mubarak, AM; Brown, DM (1980). "Una síntesis simple, estereoespecífica de (+) - muscarina". Letras de tetraedro . 21 (25): 2453. doi : 10.1016 / S0040-4039 (00) 93174-5 .
- ^ Mubarak, AM; Brown, DM (1982). "Una síntesis estereoespecífica de (+) - muscarina". Revista de la Sociedad Química, Perkin Transactions 1 : 809. doi : 10.1039 / P19820000809 .
- ^ Pochet, S .; Huynh Dinh Tam (1982). "Síntesis estereoespecífica de muscarinas y alomuscarinas en las series D y L". La Revista de Química Orgánica . 47 (2): 193. doi : 10.1021 / jo00341a003 .
- ^ Theodore M. Brody; Joseph Larner; Kenneth P. Minneman, eds. (1998). "Capítulo 9". Farmacología humana: molecular a clínica (3ª ed.). San Luis, Missouri: Mosby. ISBN 0815124562.
- ^ Roberts Bartholow, "Un tratado práctico sobre materia médica y terapéutica", 1908, ISBN 978-1-143-46767-7 ,
- ^ Fraser, PJ (marzo de 1957). "Acciones farmacológicas del cloruro de muscarina puro" . Br J Pharmacol Chemother . 12 (1): 47–52. doi : 10.1111 / j.1476-5381.1957.tb01361.x . PMC 1509643 . PMID 13413151 .
- ^ Peter G. Waser; Química y farmacología de muscarina, muscarona y algunos compuestos relacionados; Departamento de Farmacología, Universidad de Zurich, Suiza 1961
Enlaces externos [ editar ]
- Tratamiento de la intoxicación por muscarina
- Amanitas psicoactivas en Erowid
