Hipoclorito de sodio
Se ha sugerido que los lavados con hipoclorito de sodio se fusionen en este artículo. ( Discutir ) Propuesta desde mayo de 2021. |
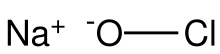 | |
 | |
| Nombres | |
|---|---|
| Nombre IUPAC Hipoclorito de sodio | |
Otros nombres
| |
| Identificadores | |
| |
Modelo 3D ( JSmol ) | |
| CHEBI | |
| ChemSpider | |
| Tarjeta de información ECHA | 100.028.790 |
| Número CE |
|
| KEGG | |
PubChem CID | |
| Número RTECS |
|
| UNII | |
| un numero | 1791 |
Tablero CompTox ( EPA ) | |
| |
| |
| Propiedades | |
| NaOCl | |
| Masa molar | 74,442 g / mol |
| Apariencia | sólido amarillo verdoso (pentahidrato) |
| Olor | similar al cloro y dulzón |
| Densidad | 1,11 g / cm 3 |
| Punto de fusion | 18 ° C (64 ° F; 291 K) pentahidrato |
| Punto de ebullición | 101 ° C (214 ° F; 374 K) (se descompone) |
| 29,3 g / 100 ml (0 ° C) [1] | |
| Acidez (p K a ) | 7.5185 |
| Basicidad (p K b ) | 6.4815 |
| Termoquímica | |
| -347,1 kJ / mol | |
| Farmacología | |
| D08AX07 ( OMS ) | |
| Riesgos | |
| Ficha de datos de seguridad | ICSC 1119 (solución,> 10% de cloro activo) ICSC 0482 (solución, <10% de cloro activo) |
Clasificación de la UE (DSD) (desactualizada) | Corrosivo ( C ) Peligroso para el medio ambiente ( N ) |
| Frases R (desactualizadas) | R31 , R34 , R50 |
| Frases S (desactualizadas) | (S1 / 2) , S28 , S45 , S50 , S61 |
| NFPA 704 (diamante de fuego) |  2 0 1 BUEY |
| Compuestos relacionados | |
Otros aniones | Cloruro de sodio Clorito de sodio Clorato de sodio Perclorato de sodio |
Otros cationes | Hipoclorito de litio Hipoclorito de calcio Hipoclorito de potasio |
Compuestos relacionados | Ácido hipocloroso |
Salvo que se indique lo contrario, los datos se proporcionan para materiales en su estado estándar (a 25 ° C [77 ° F], 100 kPa). | |
| Referencias de Infobox | |
El hipoclorito de sodio (comúnmente conocido en una solución diluida como lejía ) es un compuesto químico con la fórmula NaOCl o NaClO, que comprende un catión de sodio ( Na+
) y un anión hipoclorito ( OCl-
o ClO-
). También puede verse como la sal sódica del ácido hipocloroso . El compuesto anhidro es inestable y puede descomponerse explosivamente. [2] [3] Puede cristalizarse como un pentahidrato de NaOCl · 5 H
2O , un sólido de color amarillo verdoso pálido que no es explosivo y es estable si se mantiene refrigerado. [4] [5]
El hipoclorito de sodio se encuentra con mayor frecuencia como una solución diluida de color amarillo verdoso pálido conocida como blanqueador líquido, que es un químico doméstico ampliamente utilizado (desde el siglo XVIII) como desinfectante o agente blanqueador .
En solución, el compuesto es inestable y se descompone fácilmente, liberando cloro que es el principio activo de dichos productos. El hipoclorito de sodio es el blanqueador a base de cloro más antiguo y aún más importante . [6] [7]
Sus propiedades corrosivas, disponibilidad común y productos de reacción lo convierten en un riesgo de seguridad significativo. En particular, mezclar blanqueador líquido con otros productos de limpieza, como ácidos o amoníaco , producirá cloro gaseoso , un gas venenoso utilizado en la Primera Guerra Mundial . [8] [9] [10]
Química
Estabilidad del sólido
Se puede preparar hipoclorito de sodio anhidro pero, como muchos hipocloritos, es muy inestable y se descompone explosivamente por calentamiento o fricción. [2] La descomposición es acelerada por el dióxido de carbono a niveles atmosféricos . [3] [11] Es un sólido blanco con estructura cristalina ortorrómbica . [12]
El hipoclorito de sodio también se puede obtener como un pentahidrato cristalino NaOCl · 5 H
2O , que no es explosivo y es mucho más estable que el compuesto anhidro. [3] [4] La fórmula a veces se da como 2 NaOCl · 10 H
2O . [ cita requerida ] Los cristales ortorrómbicos transparentes, de color amarillo verdoso claro [13] [14] contienen 44% de NaOCl en peso y se funden a 25–27 ° C. El compuesto se descompone rápidamente a temperatura ambiente, por lo que debe mantenerse refrigerado. Sin embargo, a temperaturas más bajas, es bastante estable: según se informa, solo un 1% de descomposición después de 360 días a 7 ° C. [5] [15]
Una patente estadounidense de 1966 afirma que el hipoclorito de sodio sólido estable dihidrato NaOCl · 2 H
2O puede obtenerse excluyendo cuidadosamente los iones cloruro ( Cl-
), que están presentes en el resultado de los procesos de fabricación comunes y se dice que catalizan la descomposición del hipoclorito en clorato ( ClO-
3) y cloruro. En una prueba, se afirmó que el dihidrato mostraba solo un 6% de descomposición después de 13,5 meses de almacenamiento a -25 ° C. La patente también reivindica que el dihidrato se puede reducir a la forma anhidra mediante secado al vacío a aproximadamente 50 ° C, produciendo un sólido que no mostró descomposición después de 64 horas a -25 ° C. [dieciséis]
Equilibrios y estabilidad de soluciones
A temperaturas ambiente típicas, el hipoclorito de sodio es más estable en soluciones diluidas que contienen Na solvatado.+
y OCl-
iones. La densidad de la solución es 1.093 g / mL al 5% de concentración, [17] y 1.21 g / mL al 14%, 20 ° C. [18] Las soluciones estequiométricas son bastante alcalinas , con un pH de 11 o superior [5] ya que el ácido hipocloroso es un ácido débil :
- OCl-
+ H
2O ⇌ HOCl + OH-
Las siguientes especies y equilibrios están presentes en soluciones de NaOCl : [19]
- HOCl (aq) ⇌ H+
+ OCl- - HOCl (aq) + Cl-
+ H+
⇌ Cl
2(aq) + H
2O - Cl
2(aq) + Cl-
⇌ Cl-
3 - Cl
2(aq) ⇌ Cl
2 (gramo)
La segunda ecuación de equilibrio anterior se desplazará hacia la derecha si el cloro Cl
2se le permite escapar como gas. Las proporciones de Cl
2, HOCl y OCl-
en solución también dependen del pH. A un pH por debajo de 2, la mayor parte del cloro en la solución está en forma de Cl elemental disuelto.
2. A un pH superior a 7,4, la mayoría se encuentra en forma de hipoclorito ClO-
. [6] El equilibrio se puede cambiar agregando ácidos (como ácido clorhídrico ) o bases (como hidróxido de sodio ) a la solución:
- ClO-
(ac) + 2 HCl (ac) → Cl
2(g) + H
2O (ac) + Cl-
(aq) - Cl
2(g) + 2 OH-
→ ClO-
(aq) + Cl-
(aq) + H
2O (aq)
A un pH de aproximadamente 4, como el obtenido mediante la adición de ácidos fuertes como el ácido clorhídrico , la cantidad de HOCl no disociado (no ionizado) es máxima. La reacción se puede escribir como:
- ClO-
+ H+
⇌ HClO
Las soluciones de hipoclorito de sodio combinadas con ácido desprenden cloro gaseoso, particularmente fuerte a pH <2, por las reacciones:
- HOCl (aq) + Cl-
+ H+
⇌ Cl
2(aq) + H
2O - Cl
2(aq) ⇌ Cl
2 (gramo)
A pH> 8, el cloro está prácticamente todo en forma de aniones hipoclorito ( OCl-
). Las soluciones son bastante estables a pH 11-12. Aun así, un informe afirma que una solución de reactivo de NaOCl convencional al 13,6% perdió el 17% de su concentración después de almacenarse durante 360 días a 7 ° C. [5] Por esta razón, en algunas aplicaciones se pueden usar compuestos liberadores de cloro más estables, como hipoclorito de calcio Ca (ClO).
2o ácido tricloroisocianúrico (CNClO)
3.
El hipoclorito de sodio anhidro es soluble en metanol y las soluciones son estables. [ cita requerida ]
Descomposición en clorato u oxígeno
En solución, bajo ciertas condiciones, el anión hipoclorito también puede desproporcionarse ( autooxidarse ) a cloruro y clorato : [20]
- 3 ClO-
+ H+
→ HClO
3+ 2 Cl-
En particular, esta reacción ocurre en soluciones de hipoclorito de sodio a altas temperaturas, formando clorato de sodio y cloruro de sodio: [20] [21]
- 3 NaOCl (ac) → 2 NaCl (ac) + NaClO
3 (aq)
Esta reacción se aprovecha en la producción industrial de clorato de sodio.
Una descomposición alternativa del hipoclorito produce oxígeno en su lugar:
- 2 OCl-
→ 2 Cl-
+ O
2
En soluciones calientes de hipoclorito de sodio, esta reacción compite con la formación de clorato, produciendo cloruro de sodio y gas oxígeno: [20]
- 2 NaOCl (ac) → 2 NaCl (ac) + O
2 (gramo)
Estas dos reacciones de descomposición de las soluciones de NaClO se maximizan a un pH de alrededor de 6. La reacción de producción de clorato predomina a un pH superior a 6, mientras que la del oxígeno se vuelve significativa por debajo de eso. Por ejemplo, a 80 ° C, con concentraciones de NaOCl y NaCl de 80 mM , y un pH de 6 a 6,5, el clorato se produce con una eficiencia de ∼95%. Los predomina la vía de oxígeno a pH 10. [20] Esta descomposición es afectada por la luz [21] y de iones de metales catalizadores tales como cobre , níquel , cobalto , [20] y el iridio . [22] Catalizadores como el dicromato de sodio Na
2Cr
2O
7y molibdato de sodio Na
2Mugir
4se puede agregar industrialmente para reducir la vía del oxígeno, pero un informe afirma que solo el último es efectivo. [20]
Valoración
La titulación de las soluciones de hipoclorito a menudo se realiza agregando una muestra medida a una cantidad en exceso de solución acidificada de yoduro de potasio ( KI ) y luego titulando el yodo liberado ( I
2) con una solución estándar de tiosulfato de sodio u óxido de fenilarsina , utilizando almidón como indicador, hasta que desaparezca el color azul. [14]
Según una patente estadounidense, la estabilidad del contenido de hipoclorito de sodio en sólidos o soluciones se puede determinar controlando la absorción de infrarrojos debido al enlace O – Cl. La longitud de onda característica se da como 140.25 μm para soluciones acuosas, 140.05 μm para el sólido dihidrato NaOCl · 2 H
2O , y 139,08 μm para la sal mixta anhidra Na
2(OCl) (OH) . [dieciséis]
Oxidación de compuestos orgánicos.
La oxidación del almidón por hipoclorito de sodio, que agrega grupos carbonilo y carboxilo , es relevante para la producción de productos de almidón modificado . [23]
En presencia de un catalizador de transferencia de fase , los alcoholes se oxidan al correspondiente compuesto de carbonilo ( aldehído o cetona ). [24] [5] El hipoclorito de sodio también puede oxidar sulfuros orgánicos a sulfóxidos o sulfonas , disulfuros o tioles a cloruros o bromuros de sulfonilo , iminas a oxaziridinas . [5] También puede desaromatizar fenoles . [5]
Oxidación de metales y complejos.
Las reacciones heterogéneas del hipoclorito de sodio y metales como el zinc proceden lentamente para dar el óxido o hidróxido metálico :
- NaOCl + Zn → ZnO + NaCl
Las reacciones homogéneas con complejos de coordinación de metales proceden algo más rápido. Esto se ha aprovechado en la epoxidación de Jacobsen .
Otras reacciones
Si no se almacena correctamente en recipientes herméticos, el hipoclorito de sodio reacciona con el dióxido de carbono para formar carbonato de sodio :
- 2 NaOCl + CO
2+ H2O → Na
2CO
3 + 2 HOCl
El hipoclorito de sodio reacciona con la mayoría de los compuestos de nitrógeno para formar monocloramina volátil , dicloraminas y tricloruro de nitrógeno :
- NUEVA HAMPSHIRE
3+ NaOCl → NH
2Cl + NaOH - NUEVA HAMPSHIRE
2Cl + NaOCl → NHCl
2 + NaOH - NHCl
2+ NaOCl → NCl
3 + NaOH
Neutralización
El tiosulfato de sodio es un neutralizador de cloro eficaz. El enjuague con una solución de 5 mg / L, seguido de un lavado con agua y jabón, eliminará el olor a cloro de las manos. [25]
Producción
Cloración de refrescos
El hipoclorito de potasio fue producido por primera vez en 1789 por Claude Louis Berthollet en su laboratorio en el Quai de Javel en París , Francia, pasando cloro gaseoso a través de una solución de lejía potásica . El líquido resultante, conocido como " Eau de Javel " ("agua de Javel"), era una solución débil de hipoclorito de potasio. Antoine Labarraque reemplazó la lejía de potasa por la lejía de soda más barata , obteniendo así hipoclorito de sodio ( Eau de Labarraque ). [26] [27]
- Cl 2 (g) + 2 NaOH (ac) → NaCl (ac) + NaClO (ac) + H 2 O (ac)
Por tanto, el cloro se reduce y se oxida simultáneamente ; este proceso se conoce como desproporción .
El proceso también se utiliza para preparar el pentahidrato NaOCl · 5 H
2O para uso industrial y de laboratorio. En un proceso típico, se agrega cloro gaseoso a una solución de NaOH al 45-48%. Parte del cloruro de sodio precipita y se elimina por filtración, y luego se obtiene el pentahidrato enfriando el filtrado a 12 ° C. [5]
De hipoclorito de calcio
Otro método involucró la reacción de carbonato de sodio ("sosa de lavado") con cal clorada ("polvo blanqueador"), una mezcla de hipoclorito de calcio Ca (OCl)
2, cloruro de calcio CaCl
2e hidróxido de calcio Ca (OH)
2:
- N / A
2CO
3(aq) + Ca (OCl)
2(aq) → CaCO
3(s) + 2 NaOCl (aq) - N / A
2CO
3(aq) + CaCl
2(aq) → CaCO
3(s) + 2 NaCl (ac) - N / A
2CO
3(ac) + Ca (OH)
2(s) → CaCO
3(s) + 2 NaOH (ac)
Este método se usó comúnmente para producir soluciones de hipoclorito para su uso como antiséptico hospitalario que se vendió después de la Primera Guerra Mundial con el nombre "Eusol", una abreviatura de Solución de cal (clorada) de la Universidad de Edimburgo, una referencia al departamento de patología de la universidad, donde fue desarrollado. [28]
Electrólisis de salmuera
Hacia fines del siglo XIX, ES Smith patentó el proceso cloro-álcali : un método para producir hipoclorito de sodio que implica la electrólisis de salmuera para producir hidróxido de sodio y cloro gaseoso, que luego se mezclan para formar hipoclorito de sodio. [29] [27] [30] Las reacciones clave son:
- 2 Cl - → Cl 2 + 2 e - (en el ánodo )
- 2 H
2O + 2 e - → H
2+ 2 HO-
(en el cátodo )
Tanto la energía eléctrica como la solución de salmuera eran baratas en ese momento, y varios comercializadores emprendedores aprovecharon la situación para satisfacer la demanda del mercado de hipoclorito de sodio. Las soluciones embotelladas de hipoclorito de sodio se vendieron con numerosos nombres comerciales.
Hoy en día, una versión mejorada de este método, conocido como proceso Hooker (llamado así por Hooker Chemicals, adquirido por Occidental Petroleum ), es el único método industrial a gran escala de producción de hipoclorito de sodio. En el proceso, se forman hipoclorito de sodio (NaClO) y cloruro de sodio (NaCl) cuando el cloro pasa a una solución de hidróxido de sodio diluida fría . El cloro se prepara industrialmente por electrólisis con una separación mínima entre el ánodo y el cátodo . La solución debe mantenerse por debajo de 40 ° C (mediante serpentines de enfriamiento) para evitar la formación no deseada de clorato de sodio .
Las soluciones comerciales siempre contienen cantidades significativas de cloruro de sodio (sal común) como subproducto principal , como se ve en la ecuación anterior.
De ácido hipocloroso y soda.
Una patente de 1966 describe la producción de NaOCl · 2 H dihidrato estable sólido
2O haciendo reaccionar una solución sin cloruro de ácido hipocloroso HClO (tal como la preparada a partir de monóxido de cloro ClO y agua), con una solución concentrada de hidróxido de sodio. En una preparación típica, se agregan lentamente con agitación 255 mL de una solución con 118 g / L de HClO a una solución de 40 g de NaOH en agua a 0 ° C. Se precipita algo de cloruro de sodio y se elimina por filtración. La solución se evapora al vacío a 40–50 ° C y 1–2 mmHg hasta que cristaliza el dihidrato. Los cristales se secan al vacío para producir un polvo cristalino que fluye libremente. [dieciséis]
El mismo principio se utilizó en otra patente de 2050 para producir lechadas concentradas del pentahidrato NaClO · 5 H
2O . Normalmente, una solución al 35% (en peso) de HClO se combina con hidróxido de sodio a aproximadamente o por debajo de 25 ° C. La suspensión resultante contiene aproximadamente un 35% de NaClO y es relativamente estable debido a la baja concentración de cloruro. [31]
De ozono y sal
El hipoclorito de sodio se puede producir fácilmente con fines de investigación haciendo reaccionar el ozono con la sal.
- NaCl + O 3 → NaClO + O 2
Esta reacción ocurre a temperatura ambiente y puede ser útil para oxidar alcoholes.
Empaque y venta
El blanqueador doméstico que se vende para lavar ropa es una solución de hipoclorito de sodio al 3–8 % en el momento de la fabricación. La fuerza varía de una formulación a otra y disminuye gradualmente con el almacenamiento prolongado. El hidróxido de sodio generalmente se agrega en pequeñas cantidades a la lejía doméstica para ralentizar la descomposición del NaClO. [6]
Los productos para quitar manchas negras de patio de uso doméstico son soluciones de hipoclorito de sodio al ~ 10%.
Una solución al 10-25% de hipoclorito de sodio, según la hoja de seguridad de Univar, se suministra con sinónimos o nombres comerciales lejía, Hypo, Everchlor, Chloros, Hispec, Bridos, Bleacol o Vo-redox 9110. [32]
Una solución al 12% se usa ampliamente en las plantas de abastecimiento de agua para la cloración del agua , y una solución al 15% se usa más comúnmente [33] para la desinfección de aguas residuales en plantas de tratamiento. El hipoclorito de sodio también se puede utilizar para la desinfección del agua potable en el lugar de uso, [34] tomando de 0,2 a 2 mg de hipoclorito de sodio por litro de agua. [35]
Las soluciones diluidas (50 ppm a 1.5%) se encuentran en aerosoles desinfectantes y toallitas que se usan en superficies duras. [36] [37]
Usos
Blanqueamiento
La lejía doméstica es, en general, una solución que contiene de 3 a 8% de hipoclorito de sodio, por peso, y de 0,01 a 0,05% de hidróxido de sodio ; el hidróxido de sodio se usa para retardar la descomposición del hipoclorito de sodio en cloruro de sodio y clorato de sodio . [38]
Limpieza
El hipoclorito de sodio tiene propiedades decolorantes. [39] Entre otras aplicaciones, se puede utilizar para eliminar el moho manchas, manchas dentales causadas por fluorosis , [40] y las manchas en la vajilla, especialmente las causadas por los taninos en el té . También se ha utilizado en detergentes para ropa y como limpiador de superficies. También se utiliza en lavados con hipoclorito de sodio .
Sus efectos blanqueadores, limpiadores, desodorantes y cáusticos se deben a la oxidación e hidrólisis ( saponificación ). La suciedad orgánica expuesta al hipoclorito se vuelve soluble en agua y no volátil, lo que reduce su olor y facilita su eliminación.
Desinfección
El hipoclorito de sodio en solución exhibe una actividad antimicrobiana de amplio espectro y se usa ampliamente en centros de salud en una variedad de entornos. [41] Por lo general, se diluye en agua dependiendo de su uso previsto. La "solución de cloro fuerte" es una solución al 0.5% de hipoclorito (que contiene aproximadamente 5000 ppm de cloro libre) que se usa para desinfectar áreas contaminadas con fluidos corporales, incluidos los grandes derrames de sangre (el área se limpia primero con detergente antes de desinfectarla). [41] [42] Puede prepararse diluyendo lejía doméstica según corresponda (normalmente 1 parte de lejía por 9 partes de agua). [43] Se ha demostrado que estas soluciones inactivan tanto C. difficile [41] como el VPH .[44] La "solución de cloro débil" es una solución de hipoclorito al 0,05% que se utiliza para lavarse las manos, pero que normalmente se prepara congránulos de hipoclorito de calcio . [42]
La " solución de Dakin " es una solución desinfectante que contiene una baja concentración de hipoclorito de sodio y algo de ácido bórico o bicarbonato de sodio para estabilizar el pH. Se ha descubierto que es eficaz con concentraciones de NaOCl tan bajas como 0,025%. [45]
Las regulaciones del gobierno de los EE. UU. Permiten que los equipos de procesamiento de alimentos y las superficies en contacto con los alimentos se desinfecten con soluciones que contengan lejía, siempre que se permita que la solución se escurra adecuadamente antes de entrar en contacto con los alimentos y que las soluciones no superen las 200 partes por millón (ppm) de cloro disponible ( por ejemplo, una cucharada de lejía doméstica típica que contiene 5.25% de hipoclorito de sodio, por galón de agua). [46] Si se utilizan concentraciones más altas, la superficie debe enjuagarse con agua potable después de la desinfección.
Se usa una concentración similar de lejía en agua tibia para desinfectar las superficies antes de preparar cerveza o vino. Las superficies deben enjuagarse con agua esterilizada (hervida) para evitar impartir sabores a la infusión; los subproductos clorados de desinfectar superficies también son dañinos. El modo de acción desinfectante del hipoclorito de sodio es similar al del ácido hipocloroso.
Las soluciones que contienen más de 500 ppm de cloro disponible son corrosivas para algunos metales , aleaciones y muchos termoplásticos (como la resina acetálica ) y deben eliminarse completamente después, por lo que la desinfección con lejía a veces va seguida de una desinfección con etanol . Los líquidos que contienen hipoclorito de sodio como principal componente activo también se utilizan para la limpieza y desinfección del hogar, por ejemplo, limpiadores de inodoros . [47] Algunos limpiadores están formulados para ser viscosos para que no se escurran rápidamente de superficies verticales, como el interior de la taza del inodoro.
Se cree que el ácido hipocloroso no disociado (no ionizado) reacciona e inactiva las enzimas bacterianas y virales.
Los neutrófilos del sistema inmunológico humano producen pequeñas cantidades de hipoclorito dentro de los fagosomas , que digieren bacterias y virus.
Desodorizante
El hipoclorito de sodio tiene propiedades desodorantes, que van de la mano con sus propiedades limpiadoras. [39]
Tratamiento de aguas residuales
Se han utilizado soluciones de hipoclorito de sodio para tratar aguas residuales de cianuro diluido , como los residuos de galvanoplastia . En las operaciones de tratamiento por lotes, se ha utilizado hipoclorito de sodio para tratar desechos de cianuro más concentrados, como soluciones de recubrimiento de cianuro de plata. El cianuro tóxico se oxida a cianato (OCN - ) que no es tóxico, idealizado de la siguiente manera:
- CN - + OCl - → OCN - + Cl -
El hipoclorito de sodio se usa comúnmente como biocida en aplicaciones industriales para controlar la formación de babas y bacterias en sistemas de agua usados en plantas de energía, fábricas de pulpa y papel, etc., en soluciones típicamente de 10 a 15% en peso.
Endodoncia
El hipoclorito de sodio es el medicamento de elección debido a su eficacia contra los organismos patógenos y la digestión pulpar en la terapia endodóntica . Su concentración de uso varía del 0,5% al 5,25%. En concentraciones bajas, disuelve principalmente tejido necrótico; en concentraciones más altas, también disuelve tejidos vitales y especies bacterianas adicionales. Un estudio ha demostrado que Enterococcus faecalis todavía estaba presente en la dentina después de 40 minutos de exposición al 1,3% y al 2,5% de hipoclorito de sodio, mientras que 40 minutos a una concentración del 5,25% fue eficaz en la eliminación de E. faecalis . [48]Además de las concentraciones más altas de hipoclorito de sodio, una exposición más prolongada y el calentamiento de la solución (60 ° C) también aumentan su eficacia para eliminar los tejidos blandos y las bacterias dentro de la cámara del conducto radicular. [48] 2% es una concentración común ya que hay menos riesgo de un incidente de hipoclorito iatrogénico . [49] Un incidente de hipoclorito es una reacción inmediata de dolor intenso, seguida de edema , hematoma y equimosis como consecuencia de que la solución se escapa de los confines del diente y entra en el espacio periapical. Esto puede deberse a una presión excesiva o atascada en la jeringa de irrigante, o puede ocurrir si el diente tiene un foramen apical inusualmente grande.. [50]
Neutralización de agentes nerviosos
Esta sección no cita ninguna fuente . ( Marzo de 2020 ) |
En las diversas instalaciones de destrucción de agentes nerviosos (gas nervioso de guerra química) en los Estados Unidos, se usa hipoclorito de sodio al 50% para eliminar todos los rastros de agente nervioso o agente ampollador del equipo de protección personal después de que el personal ingresa a áreas tóxicas. También se usa hipoclorito de sodio al 50% para neutralizar cualquier liberación accidental de agente nervioso en las áreas tóxicas. En el Sistema de Reducción de la Contaminación se utilizan concentraciones menores de hipoclorito de sodio de manera similar para garantizar que no se libere ningún agente nervioso en el gas de combustión del horno.
Reducción del daño cutáneo.
Los baños de lejía diluida se han utilizado durante décadas para tratar el eccema de moderado a grave en humanos, [51] [52] pero no está claro por qué funcionan. Según un trabajo publicado por investigadores de la Facultad de Medicina de la Universidad de Stanford en noviembre de 2013, una solución muy diluida (0,005%) de hipoclorito de sodio en agua logró tratar el daño cutáneo con un componente inflamatorio causado por la radioterapia , la exposición excesiva al sol o el envejecimiento. en ratones de laboratorio . Ratones con dermatitis por radiaciónLos animales que recibieron baños diarios de 30 minutos en una solución de lejía experimentaron un daño cutáneo menos severo y mejor cicatrización y crecimiento del cabello que los animales bañados en agua. Se sabe que una molécula llamada factor nuclear kappa-potenciador de cadena ligera de células B activadas (NF-κB) desempeña un papel fundamental en la inflamación, el envejecimiento y la respuesta a la radiación. Los investigadores encontraron que si la actividad de NF-κB se bloqueaba en ratones ancianos bañándolos en una solución de lejía, la piel de los animales comenzaba a verse más joven, pasando de vieja y frágil a más gruesa, con una mayor proliferación celular . El efecto disminuyó después de que se interrumpieron los baños, lo que indica que era necesaria una exposición regular para mantener el grosor de la piel. [51] [53]
La seguridad
Se estima que hay alrededor de 3300 accidentes que requieren tratamiento hospitalario causados por soluciones de hipoclorito de sodio cada año en hogares británicos (RoSPA, 2002).
Oxidación y corrosión
El hipoclorito de sodio es un oxidante fuerte . Las reacciones de oxidación son corrosivas . Las soluciones queman la piel y causan daño a los ojos, especialmente cuando se usan en formas concentradas. Sin embargo, como reconoce la NFPA, solo las soluciones que contienen más del 40% de hipoclorito de sodio en peso se consideran oxidantes peligrosos. Las soluciones de menos del 40% se clasifican como un riesgo oxidante moderado (NFPA 430, 2000).
Las soluciones de blanqueador doméstico y clorador de piscinas suelen estabilizarse mediante una concentración significativa de lejía (sosa cáustica, NaOH) como parte de la reacción de fabricación. Este aditivo por sí mismo causará irritación cáustica o quemaduras debido al desengrasado y saponificación de los aceites de la piel y la destrucción del tejido. La sensación resbaladiza de la lejía en la piel se debe a este proceso.
Riesgos de almacenamiento
El contacto de las soluciones de hipoclorito de sodio con metales puede generar gas hidrógeno inflamable. Los contenedores pueden explotar cuando se calientan debido a la liberación de cloro gaseoso. [11]
Las soluciones de hipoclorito son corrosivas para los materiales comunes de los recipientes, como el acero inoxidable [5] y el aluminio . Los pocos metales compatibles incluyen el titanio (que sin embargo no es compatible con el cloro seco) y el tantalio . [6] Los envases de vidrio son seguros. [5] Algunos plásticos y cauchos también se ven afectados; las opciones seguras incluyen polietileno (PE), polietileno de alta densidad (HDPE, PE-HD), polipropileno (PP), [5] algunos polímeros clorados y fluorados como el cloruro de polivinilo (PVC),politetrafluoroetileno (PTFE) y fluoruro de polivinilideno (PVDF); así como caucho de etileno propileno y Viton . [6]
Los contenedores deben permitir la ventilación del oxígeno producido por la descomposición con el tiempo, de lo contrario pueden explotar. [2]
Reacciones con otros productos habituales
Mezclar lejía con algunos limpiadores domésticos puede ser peligroso.
Las soluciones de hipoclorito de sodio, como el blanqueador líquido, pueden liberar cloro gaseoso tóxico cuando se calientan por encima de 35 ° C [11] o se mezclan con un ácido , como ácido clorhídrico o vinagre .
Un estudio de 2008 indicó que el hipoclorito de sodio y los productos químicos orgánicos (por ejemplo, tensioactivos, fragancias) contenidos en varios productos de limpieza domésticos pueden reaccionar para generar compuestos orgánicos volátiles clorados (COV). [54]Estos compuestos clorados se emiten durante las aplicaciones de limpieza, algunos de los cuales son tóxicos y probablemente carcinógenos humanos. El estudio mostró que las concentraciones de aire interior aumentan significativamente (de 8 a 52 veces para el cloroformo y de 1 a 1170 veces para el tetracloruro de carbono, respectivamente, por encima de las cantidades de referencia en el hogar) durante el uso de productos que contienen lejía. El aumento en las concentraciones de compuestos orgánicos volátiles clorados fue el más bajo para el blanqueador simple y el más alto para los productos en forma de "líquido espeso y gel". Los aumentos significativos observados en las concentraciones de aire interior de varios COV clorados (especialmente tetracloruro de carbono y cloroformo) indican que el uso de lejía puede ser una fuente que podría ser importante en términos de exposición por inhalación a estos compuestos.Los autores sugirieron que el uso de estos productos de limpieza puede aumentar significativamente el riesgo de cáncer.[54]
En particular, mezclar blanqueadores de hipoclorito con aminas (por ejemplo, productos de limpieza que contienen o liberan amoníaco , sales de amonio , urea o compuestos relacionados y materiales biológicos como la orina ) produce cloraminas. [55] [11] Estos productos gaseosos pueden causar una lesión pulmonar aguda. La exposición crónica, por ejemplo, del aire en piscinas donde se usa cloro como desinfectante, puede conducir al desarrollo de asma atópica. [56]
El blanqueador puede reaccionar violentamente con el peróxido de hidrógeno y producir oxígeno gaseoso:
- H 2 O 2 (ac) + NaOCl (ac) → NaCl (ac) + H 2 O (ac) + O 2 (g)
También pueden ocurrir reacciones explosivas o subproductos en entornos industriales y de laboratorio cuando el hipoclorito de sodio se mezcla con diversos compuestos orgánicos. [11]
Limitaciones en el cuidado de la salud
El Instituto Nacional para la Excelencia en la Salud y la Atención del Reino Unido recomendó en octubre de 2008 que la solución de Dakin no se utilice en el cuidado de heridas de rutina. [57]
Impacto medioambiental
A pesar de su fuerte acción biocida, el hipoclorito de sodio per se tiene un impacto ambiental limitado, ya que el ion hipoclorito se degrada rápidamente antes de que pueda ser absorbido por los seres vivos. [58]
Sin embargo, una de las principales preocupaciones que surge del uso de hipoclorito de sodio es que tiende a formar compuestos orgánicos clorados persistentes , incluidos carcinógenos conocidos , que pueden ser absorbidos por organismos y entrar en la cadena alimentaria . Estos compuestos pueden formarse durante el almacenamiento doméstico y el uso también durante el uso industrial. [38] Por ejemplo, cuando se mezclaron lejía doméstica y aguas residuales, se observó que entre el 1 y el 2% del cloro disponible formaba compuestos orgánicos. [38] En 1994, no se habían identificado todos los subproductos, pero los compuestos identificados incluyen cloroformo y tetracloruro de carbono . [38]Se estima que la exposición estimada a estos productos químicos por el uso se encuentra dentro de los límites de exposición ocupacional. [38]
Ver también
- Hipoclorito de calcio Ca (OCl)
2 ("polvo de blanquear") - Hipoclorito de potasio KOCl (el "agua Javel" original)
- Hipoclorito de litio LiOCl
- Lavados con hipoclorito de sodio
- Oxidante mixto
Referencias
- ^ Budavari S, O'Neil M, Smith A, Heckelman P, Obenchain J (1996). "Hipoclorito de sodio". The Merck Index (12ª ed.). pag. 1478. ISBN 978-0-911910-12-4.
- ↑ a b c Urben P (2006). Manual de Bretherick sobre peligros químicos reactivos . 1 (7ª ed.). pag. 1433. ISBN 978-0-08-052340-8.
- ↑ a b c Hamano A (1997). "La formación y descomposición de la sal anhidra de hipoclorito de sodio y su pentahidrato". Ciencia y Tecnología de Materiales Energéticos . 58 (4): 152-155.
- ↑ a b Applebey MP (1919). "Hipoclorito de sodio" . Revista de la Sociedad Química, Transacciones . 115 (XCVI): 1106–1109. doi : 10.1039 / CT9191501106 .
- ^ a b c d e f g h i j k Kirihara M, Okada T, Sugiyama Y, Akiyoshi M, Matsunaga T, Kimura Y (diciembre de 2017). "Cristales pentahidratados de hipoclorito de sodio (NaOCl · 5H2O): un oxidante conveniente y ambientalmente benigno para la síntesis orgánica" . Investigación y desarrollo de procesos orgánicos . 21 (12): 1925–37. doi : 10.1021 / acs.oprd.7b00288 .
- ^ a b c d e "Manual de hipoclorito de sodio OxyChem" (PDF) . oxy.com . OxyChem.
- ^ "Folleto 96, El manual del hipoclorito de sodio" . www.chlorineinstitute.org . El Instituto del Cloro.
- ^ Faith, Thomas (2014). Detrás de la máscara de gas: el servicio de guerra química de Estados Unidos en la guerra y la paz . Champaign, IL: Prensa de la Universidad de Illinois. pag. 9. ISBN 978-0252080265. Consultado el 14 de abril de 2017 .
- ^ "22 de abril de 1915: los alemanes introducen gas venenoso" . Este día en la historia . Consultado el 14 de abril de 2017 .
- ^ Gross, Daniel A. (primavera de 2015). "Guerra química: del campo de batalla europeo al laboratorio americano" . Destilaciones . 1 (1): 16–23 . Consultado el 20 de marzo de 2018 .
- ^ a b c d e (2013): " Hipoclorito de sodio " Pauta de manipulación segura del laboratorio del acelerador lineal de Stanford, capítulo 53, producto 202. Consultado el 12 de junio de 2018.
- ^ Pian CL (2015). El Manual de Propiedades Físicas de Hidrocarburos y Productos Químicos del Pian (2ª ed.). Publicaciones profesionales del Golfo. pag. 734. ISBN 978-0-12-801146-1.
- ^ " " Pentahidrato de hipoclorito de sodio, NaOCl · 5 H2O ] " . Sitio web de MatWeb Material Property Data . Consultado el 12 de julio de 2018 .
- ^ a b "Hipoclorito de sodio" . StudFiles . Consultado el 14 de junio de 2018 .
- ^ Okada T, Asawa T, Sugiyama Y, Iwai T, Kirihara M, Kimura Y (junio de 2016). "Cristales de hipoclorito de sodio pentahidratado (NaOCl · 5H2O); un re-oxidante eficaz para la oxidación de TEMPO". Tetraedro . 72 (22): 2818-27. doi : 10.1016 / j.tet.2016.03.064 .
- ^ a b c US 3498924 , Walsh RH, Dietz A, "Proceso para preparar hipocloritos de sodio estables", publicado en 1966
- ^ "Hipoclorito de sodio" . PubChem . Biblioteca Nacional de Medicina de EE. UU.
- ^ Medio ambiente de Canadá (1985): "Información técnica para problemas de derrames: hipoclorito de sodio (proyecto)".
- ^ Wang L, Bassiri M, Najafi R, Najafi K, Yang J, Khosrovi B, et al. (Abril de 2007). "El ácido hipocloroso como un agente potencial para el cuidado de heridas: parte I. Ácido hipocloroso estabilizado: un componente del arsenal inorgánico de la inmunidad innata" . Revista de quemaduras y heridas . 6 : e5. PMC 1853323 . PMID 17492050 .
- ↑ a b c d e f Sandin S, Karlsson RK, Cornell A (abril de 2015). "Descomposición catalizada y no catalizada de hipoclorito en soluciones diluidas". Investigación en Química Industrial e Ingeniería . 54 (15): 3767–74. doi : 10.1021 / ie504890a .
- ↑ a b Hamano A, Ikeda A (1995). "El efecto del pH sobre la fotodescomposición de la solución de hipoclorito de sodio". Ciencia y Tecnología de Materiales Energéticos . 56 (2): 59–63.
- ↑ Ayres GH, Stand MH (1955). "Descomposición catalítica de la solución de hipoclorito por compuestos de iridio. I. La relación pH-tiempo". Revista de la Sociedad Química Estadounidense . 77 (4): 825–827. doi : 10.1021 / ja01609a001 .
- ^ ASC - PT Asahimas Chemical (2009): " Hipoclorito de sodio ". Descripción del producto en línea. Consultado el 14 de junio de 2018.
- ^ Mirafzal GA, Lozeva AM (1998). "Oxidación catalizada por transferencia de fase de alcoholes con hipoclorito de sodio". Letras de tetraedro . 39 (40): 7263–7266. doi : 10.1016 / S0040-4039 (98) 01584-6 .
- ^ "Métodos estándar para el examen de agua y aguas residuales" (PDF) . www.umass.edu . Asociación Estadounidense de Salud Pública, Asociación Estadounidense de Obras Hidráulicas, Federación Ambiental del Agua . Consultado el 26 de enero de 2017 .
- ^ Vogt H, Balej J, Bennett JE, Wintzer P, Sheikh SA, Gallone P (2007). "Óxidos de cloro y ácidos oxigenados de cloro". Enciclopedia de química industrial de Ullmann (7ª ed.). Wiley. pag. 2.
- ^ a b "Hipoclorito de sodio como desinfectante" . Lenntech.com . Consultado el 7 de agosto de 2011 .
- ^ "eusol" . Diccionario de inglés de Oxford . Consultado el 3 de julio de 2014 .
- ^ Mayo P. "Lejía (hipoclorito de sodio)" . Universidad de Bristol. Archivado desde el original el 13 de diciembre de 2016 . Consultado el 13 de diciembre de 2016 .
- ^ "Cómo se fabrican los productos volumen 2" . Mayo de 2011.
- ^ US 5194238 , Duncan BL, Ness RC, "Proceso para la producción de lechadas concentradas de hipoclorito de sodio de alta pureza", publicado en 1991
- ^ "FICHA DE DATOS DE SEGURIDAD Hipoclorito de sodio" (PDF) . Univar . 9 de agosto de 2007.
- ^ Ingeniería de aguas residuales: tratamiento, eliminación y reutilización (3ª ed.). Metcalf y Eddy, Inc. 1991. pág. 497.
- ^ Lantagne DS (2018). "Dosificación de hipoclorito de sodio para el tratamiento de agua doméstico y de emergencia" . Publicaciones de IWA . 16 (1).
- ^ "¿Qué es la cloración?" .
- ^ Vieira ER (1999). Ciencias de la alimentación elemental . Saltador. págs. 381–382. ISBN 978-0-8342-1657-0.
- ^ Wilhelm N, Kaufmann A, Blanton E, Lantagne D (febrero de 2018). "Dosis de hipoclorito de sodio para el tratamiento de agua doméstico y de emergencia: recomendaciones actualizadas" . Revista de Agua y Salud . 16 (1): 112–125. doi : 10.2166 / wh.2017.012 . PMID 29424725 .
- ^ a b c d e Smith WT. (1994). Seguridad humana y ambiental del hipoclorito. En: Actas de la 3ª Conferencia Mundial sobre Detergentes: Perspectivas Globales , págs. 183–5.
- ^ a b "Beneficios y aspectos de seguridad del hipoclorito formulado en productos domésticos" (PDF) . AISE - Asociación Internacional de Jabones, Detergentes y Productos de Mantenimiento. Marzo de 1997. Archivado desde el original (PDF) el 30 de marzo de 2014.
Este Dossier de apoyo trata de información sobre la evaluación de la seguridad humana y ambiental del hipoclorito, y sobre sus beneficios como agente desinfectante, desodorizante y quitamanchas.
- ^ Cárdenas Flores A, Flores Reyes H, Gordillo Moscoso A, Castanedo Cázares JP, Pozos Guillén A (2009). "Eficacia clínica del hipoclorito de sodio al 5% para la eliminación de las manchas provocadas por la fluorosis dental". La Revista de Odontología Pediátrica Clínica . 33 (3): 187–91. doi : 10.17796 / jcpd.33.3.c6282t1054584157 . PMID 19476089 .
- ^ a b c Rutala WA, Weber DJ (15 de febrero de 2017) [2008]. "Guía para la desinfección y esterilización en instalaciones sanitarias" (PDF) . www.cdc.gov . Consultado el 29 de agosto de 2017 .
- ^ a b "Para entornos sanitarios generales en África occidental: cómo preparar y utilizar soluciones de cloro" . Fiebre hemorrágica del Ébola. Centros para el Control y la Prevención de Enfermedades . Consultado el 27 de abril de 2016 .
- ^ "Cómo hacer una solución de cloro fuerte (0,5%) a partir de lejía líquida" (PDF) . Centros para el Control y la Prevención de Enfermedades .
- ^ Meyers J, Ryndock E, Conway MJ, Meyers C, Robison R (junio de 2014). "Susceptibilidad del virus del papiloma humano de alto riesgo tipo 16 a los desinfectantes clínicos" . La revista de quimioterapia antimicrobiana . 69 (6): 1546–50. doi : 10.1093 / jac / dku006 . PMC 4019329 . PMID 24500190 .
- ^ Heggers JP, Sazy JA, Stenberg BD, Strock LL, McCauley RL, Herndon DN, Robson MC (1991). "Propiedades bactericidas y cicatrizantes de las soluciones de hipoclorito de sodio: el premio Lindberg de 1991". The Journal of Burn Care & Rehabilitation . 12 (5): 420–4. doi : 10.1097 / 00004630-199109000-00005 . PMID 1752875 .
- ^ 21 CFR Parte 178
- ^ "Limpiadores de inodoros: aprenda sobre los productos químicos alrededor de su casa: pesticidas: EPA de EE . UU . " . Agencia de Protección Ambiental de Estados Unidos . 9 de mayo de 2012.
- ^ a b Irrigantes y desinfectantes del conducto radicular . Endodoncia: colegas por la excelencia. Publicado para la comunidad de profesionales de la odontología por la Asociación Estadounidense de Endodoncistas. Invierno de 2011.
- ^ Torabinejad M, Walton R (2008). Endodoncia . VitalBook (4ª ed.). Compañía WB Saunders. pag. 265.
- ^ Hülsmann M, Hahn W (mayo de 2000). "Complicaciones durante la irrigación del conducto radicular: revisión de la literatura e informes de casos" (PDF) . Revista Internacional de Endodoncia . 33 (3): 186–93. doi : 10.1046 / j.1365-2591.2000.00303.x . PMID 11307434 .
- ↑ a b Conger K (15 de noviembre de 2013). "Daño inflamatorio de la piel en ratones bloqueado por solución de lejía, encuentra un estudio" . Facultad de Medicina de Stanford. Archivado desde el original el 7 de diciembre de 2013.
- ^ Pett K, Batta K, Vlachou C, Nicholls G. "Baños de lejía con líquido esterilizante Milton para el eccema atópico infectado recurrente" . Archivado desde el original el 12 de diciembre de 2013. Cite journal requiere
|journal=( ayuda ) - ^ Leung TH, Zhang LF, Wang J, Ning S, Knox SJ, Kim SK (diciembre de 2013). "El hipoclorito tópico mejora las enfermedades de la piel mediadas por NF-κB en ratones" . La Revista de Investigación Clínica . 123 (12): 5361–70. doi : 10.1172 / JCI70895 . PMC 3859383 . PMID 24231355 .
- ↑ a b Odabasi M (marzo de 2008). "Compuestos orgánicos volátiles halogenados del uso de productos domésticos que contienen lejía clorada". Ciencia y tecnología ambientales . 42 (5): 1445–51. Código Bibliográfico : 2008EnST ... 42.1445O . doi : 10.1021 / es702355u . PMID 18441786 . Lay resumen .
- ^ Krieger GR, Sullivan Jr JB (2001). Salud ambiental clínica y exposiciones tóxicas (2 ed.). Filadelfia, Pensilvania [UA]: Lippincott Williams & Wilkins. pag. 968. ISBN 9780683080278. Consultado el 30 de agosto de 2016 .
- ^ Nickmilder M, Carbonnelle S, Bernard A (febrero de 2007). "La limpieza de la casa con lejía y los riesgos de enfermedades alérgicas y respiratorias en los niños". Alergia e inmunología pediátricas . 18 (1): 27–35. doi : 10.1111 / j.1399-3038.2006.00487.x . PMID 17295796 . S2CID 24606118 .
- ^ No use Eusol y gasa para tratar heridas quirúrgicas que están cicatrizando por segunda intención , octubre de 2008, NICE, Londres Archivado el 14 de julio de 2014 en Wayback Machine. Consultado el 3 de julio de 2014.
- ^ ASC - PT Asahimas Chemical (2009): " Hipoclorito de sodio al 10% ". Hoja de datos de seguridad de materiales en línea (MSDS). Consultado el 14 de junio de 2018.
Bibliografía
- Jones FL (diciembre de 1972). "Intoxicación con cloruro por mezclar limpiadores domésticos". JAMA . 222 (10): 1312. doi : 10.1001 / jama.222.10.1312 . PMID 4678160 .
- Bonnard M, Brondeau MT, Falcy M, Jargot D, Miraval S, Protois J, Schneider O. "Eaux et extraits de Javel Hypochlorite de sodium en solution". Fiche Toxicologique . 157 .
enlaces externos
- Tarjeta internacional de seguridad química 0482 (soluciones <10% Cl activo)
- Ficha internacional de seguridad química 1119 (soluciones> 10% de Cl activo)
- Institut national de recherche et de sécurité ( en francés )
- Estadísticas de accidentes domésticos y de ocio 2002 (RoSPA del Reino Unido)
- Desinfección de emergencia del agua potable ( Agencia de Protección Ambiental de los Estados Unidos )
- Agua potable clorada ( monografía IARC )
- Informe del estudio NTP TR-392: Agua clorada y clorada ( NIH de EE. UU. )
- Directrices para el uso de blanqueador con cloro como desinfectante en operaciones de procesamiento de alimentos (Universidad Estatal de Oklahoma)
- Antisépticos
- Blanqueadores
- Desinfectantes
- Hipocloritos
- Agentes oxidantes
- Compuestos de sodio