

Los neurotúbulos son microtúbulos que se encuentran en las neuronas de los tejidos nerviosos. [1] Junto con los neurofilamentos y microfilamentos , forman el citoesqueleto de las neuronas. Los neurotúbulos son cilindros huecos no divididos que están formados por polímeros de proteína tubulina [2] y matrices paralelas a la membrana plasmática de las neuronas. [3] Los neurotúbulos tienen un diámetro externo de aproximadamente 23 nm y un diámetro interno, también conocido como núcleo central, de aproximadamente 12 nm. La pared de los neurotúbulos tiene aproximadamente 5 nm de ancho. Hay una zona clara no opaca que rodea el neurotúbulo y tiene aproximadamente 40 nm de diámetro. [3]Al igual que los microtúbulos, los neurotúbulos son muy dinámicos y su longitud se puede ajustar mediante la polimerización y despolimerización de la tubulina. [4]
A pesar de tener propiedades mecánicas similares, los neurotúbulos son distintos de los microtúbulos que se encuentran en otros tipos de células en lo que respecta a su función y disposición intracelular. La mayoría de los neurotúbulos no están anclados en el centro organizador de microtúbulos (MTOC) como lo hacen los microtúbulos convencionales. En cambio, se liberan para su transporte a las dendritas y axones después de su nucleación en el centrosoma . Por lo tanto, ambos extremos de los neurotúbulos terminan en el citoplasma . [5]
Los neurotúbulos son cruciales en varios procesos celulares en las neuronas. Junto con los neurofilamentos , ayudan a mantener la forma de una neurona y brindan soporte mecánico. Los neurotúbulos también ayudan al transporte de orgánulos, vesículas que contienen neurotransmisores , ARN mensajero y otras moléculas intracelulares dentro de una neurona. [6]
Estructura y dinámica

Composición
Al igual que los microtúbulos, los neurotúbulos están formados por polímeros proteicos de α-tubulina y β-tubulina . La α-tubulina y la β-tubulina son proteínas globulares que están estrechamente relacionadas. Se unen para formar un dímero, llamado tubulina.. Los neurotúbulos generalmente se ensamblan mediante 13 protofilamentos que se polimerizan a partir de dímeros de tubulina. Como un dímero de tubulina consta de una α-tubulina y una β-tubulina, un extremo del neurotúbulo está expuesto con la α-tubulina y el otro extremo con la β-tubulina, estos dos extremos contribuyen a la polaridad del neurotúbulo, el más (+) final y el menos (-) final. La subunidad de β-tubulina está expuesta en el extremo positivo (+). Los dos extremos difieren en su tasa de crecimiento: el extremo más (+) es el extremo de crecimiento rápido, mientras que el extremo menos (-) es el extremo de crecimiento lento. Ambos extremos tienen su propia velocidad de polimerización y despolimerización de dímeros de tubulina, la polimerización neta provoca el ensamblaje de tubulina, de ahí la longitud de los neurotúbulos. [4]
Inestabilidad dinámica
El crecimiento de los neurotúbulos está regulado por la inestabilidad dinámica . [7] Se caracteriza por distintas fases de crecimiento y rápida contracción. La transición del crecimiento a la rápida contracción se denomina "catástrofe". Lo contrario se llama "rescate".
Arreglos de neurotúbulos polarizados
Las neuronas tienen una red de neurotúbulos polarizados. [8] Los axones de la mayoría de las neuronas contienen neurotúbulos con el extremo positivo (+) apuntando uniformemente hacia el terminal del axón y el extremo negativo (-) orientado hacia el cuerpo celular, similar a la orientación general de los microtúbulos en otros tipos de células. Por otro lado, las dendritas contienen neurotúbulos con polaridades mixtas. La mitad de ellos apunta su extremo positivo (+) hacia la parte superior dendrítica y la otra mitad apunta hacia el cuerpo celular, que recuerda a la matriz de microtúbulos antiparalelos del huso mitótico .
La red de neurotúbulos polarizados forma la base para el tráfico de carga selectiva hacia axones y dendritas. [9] Por ejemplo, cuando se producen mutaciones en la dineína , una proteína motora que es crucial para mantener la orientación uniforme de los neurotúbulos axonales, la polaridad de los neurotúbulos en el axón se mezcla. [10] Como resultado, las proteínas dendríticas se transfieren incorrectamente a los axones. [11]
Para las neuronas no polarizadas, las neuritas contienen un 80% de neurotúbulos con el extremo positivo (+) hacia la terminal. [ cita requerida ]
Transporte axonal
Los neurotúbulos son responsables del tráfico de materiales intracelulares. Las cargas son transportadas por proteínas motoras que utilizan neurotúbulos como "pista". El transporte axonal se puede clasificar según la velocidad - rápida o lenta, y según la dirección - anterógrada o retrógrada.
Transporte axonal rápido y lento
Las cargas se transportan a un ritmo rápido o lento. El transporte axonal rápido tiene una velocidad de 50 a 500 mm por día, mientras que se encontró que el transporte axonal lento es de 0,4 mm por día en los peces dorados y de 1 a 10 mm por día en el nervio de los mamíferos. El transporte de proteína insoluble contribuye al movimiento rápido, mientras que el transporte lento transporta hasta un 40% - 50% de proteína soluble. [12] La velocidad de transporte depende de los tipos de carga que se transporten. Las neurotrofinas , una familia de proteínas importantes para la supervivencia de las neuronas, así como los orgánulos , como las mitocondrias y los endosomas., se transportan a un ritmo rápido. Por el contrario, las proteínas estructurales como la tubulina y las subunidades de neurofilamentos se transportan a velocidades más bajas. Las proteínas que se transportan desde la médula espinal hasta el pie pueden tardar hasta un año en completar el viaje. [13]
Transporte anterógrado y transporte retrógrado

El transporte anterógrado se refiere al transporte de cargas desde el extremo menos (-) hasta el extremo positivo (+), mientras que el transporte retrógrado es el transporte de cargas en la dirección opuesta. El transporte anterógrado es a menudo el transporte desde el cuerpo celular a la periferia de la neurona, mientras que el transporte retrógrado aleja los orgánulos y vesículas del extremo del axón al cuerpo celular.
El transporte anterógrado está regulado por quinesinas , una clase de proteínas motoras. Las cinesinas tienen dos dominios de la cabeza que trabajan juntos como los pies: uno se une a los neurotúbulos y luego otro se une mientras que el primero se disocia. La unión de ATP aumenta la afinidad de las quinesinas por los neurotúbulos. Cuando el ATP se une a un dominio de la cabeza, se inducirá un cambio conformacional en el dominio de la cabeza, lo que hará que se una firmemente al neurotúbulo. Luego, otro ATP se une a otro dominio principal mientras que el ATP anterior se hidroliza y el dominio principal se disocia. El proceso se repite como ciclos de modo que las cinesinas se mueven a lo largo de los neurotúbulos junto con los orgánulos y las cargas vesiculares que transportan. [14]
El transporte retrógrado está regulado por dineínas , también una clase de proteínas motoras. Comparte estructuras similares con las quinesinas, así como el mecanismo de transporte. Transporta cargas desde la periferia al cuerpo celular en neuronas.
Proteínas asociadas con los neurotúbulos
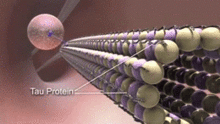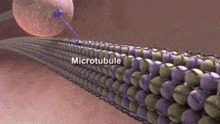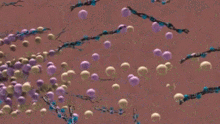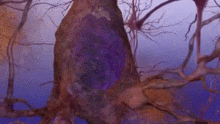
Las proteínas asociadas a microtúbulos (MAP) son proteínas que interactúan con los microtúbulos uniéndose a sus subunidades de tubulina y regulando su estabilidad. La composición de los MAP de los neurotúbulos es notablemente diferente de los microtúbulos de las células no neuronales. [15] Por ejemplo, los MAP de tipo II se encuentran exclusivamente en neuronas y no en otras células. Los más estudiados incluyen MAP2 y tau .
Los MAP se distribuyen de manera diferencial dentro del citoplasma neuronal. Su distribución también varía en las diferentes etapas del desarrollo de una neurona. Una isoforma juvenil de MAP2 está presente en los neurotúbulos de los axones y las dendritas de las neuronas en desarrollo, pero se regula negativamente a medida que las neuronas maduran. La isoforma adulta de MAP2 está enriquecida en los neurotúbulos de las dendritas y está prácticamente ausente de los neurotúbulos axonales. [16] Por el contrario, tau está ausente en los neurotúbulos de las dendritas y su presencia se limita a los neurotúbulos axonales. La fosforilaciónSe requiere de tau en ciertos sitios para que la tau se una a los neurotúbulos. En una neurona sana, este proceso no ocurre en un grado significativo en las dendritas, lo que provoca la ausencia de tau en los neurotúbulos dendríticos. La unión de tau de diferentes isoformas y de diferentes niveles de fosforilación regula la estabilidad de los neurotúbulos. Se encuentra que los neurotúbulos de las neuronas del sistema nervioso central embrionario contienen más tau altamente fosforilada que los de los adultos. [17] Además, tau es responsable de la agrupación de neurotúbulos. [18]
Los microtúbulos más proteínas de seguimiento de extremos (+ TIP) son MAP que se acumulan en el extremo positivo de los microtúbulos. En los neurotúbulos, los TIP + controlan la dinámica de los neurotúbulos, la dirección del crecimiento y la interacción con los componentes de la corteza celular . Son importantes en la extensión de neuritas y en el crecimiento de axones . [19]
Muchos otros MAP no específicos de neuronas, como MAP1B y MAP6 , se encuentran en los neurotúbulos. Además, la interacción entre la actina y algunos MAP proporciona un vínculo potencial entre los neurotúbulos y los filamentos de actina . [20]
La alteración de la integridad y la dinámica de los neurotúbulos puede interferir con las funciones celulares que realizan y causar diversos trastornos neurológicos .
Enfermedad de Alzheimer
En la enfermedad de Alzheimer , la hiperfosforilación de la proteína tau provoca la disociación de la tau de los neurotúbulos y el plegamiento incorrecto de la tau . La agregación de tau mal plegada forma ovillos neurofibrilares insolubles que es un hallazgo característico en la enfermedad de Alzheimer. [21] Este cambio patológico se llama tauopatía . Los neurotúbulos se vuelven propensos a la desintegración por las proteínas que cortan los microtúbulos cuando la tau se disocia. [22] Como resultado, los procesos esenciales en la neurona, como el transporte axonal y la comunicación neuronal, se verán interrumpidos, formando la base de la neurodegeneración . [23]Se cree que la desintegración de los neurotúbulos ocurre por diferentes mecanismos en los axones y en las dendritas.
El desprendimiento de tau desestabiliza los neurotúbulos al permitir el corte en exceso por katanina , provocando su desintegración. La desintegración de los neurotúbulos en el axón interrumpe el transporte de ARNm y moléculas de señalización al axón terminal. [22] Para las dendritas, nueva evidencia sugiere que una invasión anormal de tau en las dendritas causa un nivel elevado de TTLL6 dendrítico ( Tubulin -Tyrosine-Ligase-Like-6), que eleva el estado de poliglutamilación de los neurotúbulos en las dendritas. [22] Debido a que la espastina muestra una fuerte preferencia por los microtúbulos poliglutamilados, los neurotúbulos dendríticos se vuelven susceptibles a la desintegración inducida por la espastina. [22]La pérdida de redes de neurotúbulos en dendritas y axones, junto con la formación de ovillos neurofibrilares, da como resultado un deterioro en el tráfico de cargas importantes a través de la célula, lo que eventualmente puede conducir a la apoptosis . [24]
Lisencefalia
La lisencefalia es una afección congénita poco común en la que el cerebro pierde sus pliegues ( circunvoluciones ) y surcos ( surcos ), lo que hace que la superficie del cerebro parezca suave. Es causada por una migración defectuosa de neuronas . [25] El hecho de que las neuronas posmitóticas no alcancen sus posiciones adecuadas conduce a la formación de un neocórtex de cuatro capas desorganizado y engrosado en lugar del neocórtex de seis capas normal . La gravedad de la lisencefalia varía desde una pérdida completa de los pliegues cerebrales ( agiria ) hasta una reducción general de los pliegues corticales ( paquigiria ).
El neurotúbulo es fundamental para el mecanismo de migración de las neuronas. La migración neural defectuosa en individuos afectados por lisencefalia es causada por mutaciones asociadas con genes relacionados con neurotúbulos, como LIS1 y DCX . [26] LIS1 codifica una proteína adaptadora Lis1 que es responsable de la estabilización de los neurotúbulos durante la migración neuronal al minimizar la catástrofe de los neurotúbulos. También regula la proteína motora dineína que es crucial en la translocación del núcleo a lo largo del neurotúbulo. Esta acción impulsa el soma de la neurona hacia adelante, que es un paso esencial en la migración neuronal. [27] Además, mutaciones en LIS1se encuentra que interrumpe la polaridad uniforme más-terminal-distal en los axones en modelos animales, lo que provoca el tráfico incorrecto de proteínas dendríticas en axones. [11] Por otro lado, DCX codifica la proteína doblecortina que interactúa con Lis1 además de soportar la estructura de 13 protofilamentos del neurotúbulo.
Neuropatía periférica inducida por quimioterapia
La neuropatía periférica inducida por quimioterapia es un cambio patológico en las neuronas causado por la alteración de la dinámica de los neurotúbulos por los medicamentos de quimioterapia, que se manifiesta en dolor, entumecimiento, sensación de hormigueo y debilidad muscular en las extremidades. Es una afección irreversible que afecta aproximadamente a un tercio de los pacientes de quimioterapia. [28] Los inhibidores de la tubulina inhiben la mitosis en las células cancerosas al afectar la estabilidad y la dinámica de los microtúbulos que forman el huso mitótico responsable de la segregación cromosómica durante la mitosis, suprimiendo el crecimiento tumoral .
Sin embargo, los mismos fármacos también afectan a los neurotúbulos de las neuronas. La vinblastina se une a la tubulina libre y disminuye su capacidad de polimerización, promoviendo la despolimerización de los neurotúbulos. Por otro lado, el paclitaxel se une al casquete de los neurotúbulos, lo que evita la conversión de GTP unido a tubulina en GDP, un proceso que promueve la despolimerización de los neurotúbulos. Para las neuronas in vitro tratadas con paclitaxel, se altera el patrón de polaridad del neurotúbulo, lo que puede provocar daño neuronal a largo plazo. Además, la sobreestabilización de los neurotúbulos interfiere con su capacidad para realizar funciones celulares esenciales en las neuronas. [29]
Ver también
- Microtúbulos
- Neurofilamento
- Tubulina
- Proteína asociada a microtúbulos
- Migración neuronal
Referencias
- ^ "Definición médica de NEUROTUBULO" . www.merriam-webster.com . Consultado el 25 de marzo de 2019 .
- ^ El sistema nervioso humano: estructura y función . Noback, Charles R. (Charles Robert), 1916-2009. (6ª ed.). Totowa, Nueva Jersey: Humana Press. 2005. ISBN 1588290395. OCLC 222291397 .CS1 maint: otros ( enlace )
- ↑ a b Lane NJ, Treherne JE (julio de 1970). "Tinción con lantano de neurotúbulos en axones de ganglios de cucarachas". Revista de ciencia celular . 7 (1): 217–31. PMID 4097712 .
- ^ a b Especificidad, plasticidad y patrones neuronales . Moscona, AA (Aron Arthur), 1922-2009 ,, Monroy, Alberto ,, Hunt, R. Kevin. Nueva York: Academic Press. 1982. ISBN 9780080584409. OCLC 276661314 .CS1 maint: otros ( enlace )
- ^ Cooper, Geoffrey M. (2000). "Microtúbulos" . La célula: un enfoque molecular. 2ª Edición .
- ^ Bear MF, Connors BW, Paradso MA. Neurociencia: exploración del cerebro (3ª ed.). Lippincott Williams y Wilkins. pag. 41.
- ^ Marc Kirschner; Mitchison, Tim (noviembre de 1984). "Inestabilidad dinámica del crecimiento de microtúbulos". Naturaleza . 312 (5991): 237–242. Código Bibliográfico : 1984Natur.312..237M . doi : 10.1038 / 312237a0 . ISSN 1476-4687 . PMID 6504138 .
- ^ Kwan AC, Dombeck DA, Webb WW (agosto de 2008). "Matrices de microtúbulos polarizados en axones y dendritas apicales" . Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 105 (32): 11370–5. Código Bibliográfico : 2008PNAS..10511370K . doi : 10.1073 / pnas.0805199105 . PMC 2496886 . PMID 18682556 .
- ^ van Beuningen SF, Hoogenraad CC (agosto de 2016). "Polaridad neuronal: remodelación de la organización de los microtúbulos". Opinión actual en neurobiología . 39 : 1-7. doi : 10.1016 / j.conb.2016.02.003 . PMID 26945466 .
- ^ Conde C, Cáceres A (mayo de 2009). "Montaje, organización y dinámica de microtúbulos en axones y dendritas". Reseñas de la naturaleza. Neurociencia . 10 (5): 319–32. doi : 10.1038 / nrn2631 . PMID 19377501 .
- ↑ a b Dubey J, Ratnakaran N, Koushika SP (2015). "Neurodegeneración y dinámica de microtúbulos: muerte por mil cortes" . Fronteras en neurociencia celular . 9 : 343. doi : 10.3389 / fncel.2015.00343 . PMC 4563776 . PMID 26441521 .
- ^ Grafstein B, McEwen BS, Shelanski ML (julio de 1970). "Transporte axonal de proteína de neurotúbulos". Naturaleza . 227 (5255): 289–90. Código Bibliográfico : 1970Natur.227..289G . doi : 10.1038 / 227289a0 . PMID 4193613 .
- ^ "Son los microtúbulos el cerebro de la neurona" . Jon Lieff, MD . 2015-11-29 . Consultado el 10 de abril de 2019 .
- ^ 1958-, Berg, Jeremy M. (Jeremy Mark) (2002). Bioquímica . Tymoczko, John L., 1948-, Stryer, Lubert., Stryer, Lubert. (5ª ed.). Nueva York: WH Freeman. ISBN 0716730510. OCLC 48055706 .CS1 maint: nombres numéricos: lista de autores ( enlace )
- ^ Al-Bassam J, Ozer RS, Safer D, Halpain S, Milligan RA (junio de 2002). "MAP2 y tau se unen longitudinalmente a lo largo de las crestas exteriores de los protofilamentos de microtúbulos". J. Cell Biol . 157 (7): 1187–96. doi : 10.1083 / jcb.200201048. PMC 2173547. PMID 12082079.
- ^ Dehmelt L, Halpain S (2005). "La familia MAP2 / Tau de proteínas asociadas a microtúbulos" . Biología del genoma . 6 (1): 204. doi : 10.1186 / gb-2004-6-1-204 . PMC 549057 . PMID 15642108 .
- ^ Kanemaru K, Takio K, Miura R, Titani K, Ihara Y (mayo de 1992). "Fosforilación de tipo fetal de la tau en filamentos helicoidales apareados". Revista de neuroquímica. 58 (5): 1667–75. doi: 10.1111 / j.1471-4159.1992.tb10039.x. PMID 1560225.
- ^ Mandelkow E, Mandelkow EM (febrero de 1995). "Microtúbulos y proteínas asociadas a los microtúbulos". Curr. Opin. Cell Biol . 7 (1): 72–81. doi : 10.1016 / 0955-0674 (95) 80047-6. PMID 7755992.
- ^ Akhmanova A, Hoogenraad CC (febrero de 2005). "Microtúbulos más proteínas de seguimiento de extremos: mecanismos y funciones". Opinión actual en biología celular . 17 (1): 47–54. doi : 10.1016 / j.ceb.2004.11.001 . PMID 15661518 .
- ^ Myers, Kenneth A .; Baas, Peter W. (2011), Gallo, Gianluca; Lanier, Lorene M. (eds.), "Interacciones entre microtúbulos y actina durante el desarrollo neuronal", Neurobiology of Actin: From Neurulation to Synaptic Function , Advances in Neurobiology, Springer New York, págs. 73–96, doi : 10.1007 / 978- 1-4419-7368-9_5 , ISBN 9781441973689
- ^ Iqbal K, Liu F, Gong CX, Grundke-Iqbal I (diciembre de 2010). "Tau en la enfermedad de Alzheimer y tauopatías relacionadas" . Investigación actual sobre el Alzheimer . 7 (8): 656–64. doi : 10.2174 / 156720510793611592 . PMC 3090074 . PMID 20678074 .
- ↑ a b c d Jean DC, Baas PW (noviembre de 2013). "Corta de dos maneras: pérdida de microtúbulos durante la enfermedad de Alzheimer" . El diario EMBO . 32 (22): 2900–2. doi : 10.1038 / emboj.2013.219 . PMC 3831311 . PMID 24076651 .
- ^ Wang Y, Mandelkow E (enero de 2016). "Tau en fisiología y patología". Reseñas de la naturaleza. Neurociencia . 17 (1): 5-21. doi : 10.1038 / nrn.2015.1 . PMID 26631930 .
- ^ Mudher A, Lovestone S (enero de 2002). "Enfermedad de Alzheimer, ¿tauistas y bautistas finalmente se dan la mano?". Tendencias en neurociencias . 25 (1): 22–6. doi : 10.1016 / S0166-2236 (00) 02031-2 . PMID 11801334 .
- ^ Dobyns WB (1987). "Aspectos de desarrollo de la lisencefalia y los síndromes de lisencefalia". Defectos de nacimiento Serie de artículos originales . 23 (1): 225–41. PMID 3472611 .
- ^ Mochida GH (septiembre de 2009). "Genética y biología de la microcefalia y lisencefalia" . Seminarios de Neurología Pediátrica . 16 (3): 120–6. doi : 10.1016 / j.spen.2009.07.001 . PMC 3565221 . PMID 19778709 .
- ^ Tanaka T, Serneo FF, Higgins C, Gambello MJ, Wynshaw-Boris A, Gleeson JG (junio de 2004). "Lis1 y función de doblecortina con dineína para mediar el acoplamiento del núcleo al centrosoma en la migración neuronal" . The Journal of Cell Biology . 165 (5): 709–21. doi : 10.1083 / jcb.200309025 . PMC 2172383 . PMID 15173193 .
- ^ Brown TJ, Sedhom R, Gupta A (febrero de 2019). "Neuropatía periférica inducida por quimioterapia" . Oncología JAMA . 5 (5): 750. doi : 10.1001 / jamaoncol.2018.6771 . PMID 30816956 .
- ^ Baas PW, Ahmad FJ (octubre de 2013). "Más allá del taxol: tratamiento basado en microtúbulos de enfermedades y lesiones del sistema nervioso" . Cerebro . 136 (Pt 10): 2937–51. doi : 10.1093 / cerebro / awt153 . PMC 3784279 . PMID 23811322 .
