| Osteoblasto | |
|---|---|
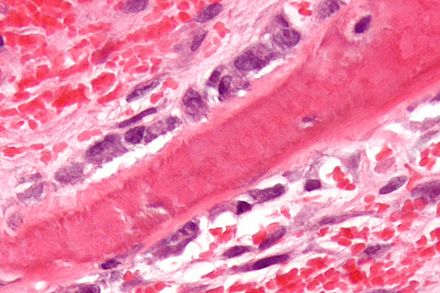 | |
 Ilustración que muestra un solo osteoblasto | |
| Detalles | |
| Localización | Hueso |
| Función | Formación de tejido óseo |
| Identificadores | |
| griego | osteoblasto |
| Malla | D010006 |
| TH | H2.00.03.7.00002 |
| FMA | 66780 |
| Términos anatómicos de microanatomía | |
Los osteoblastos (del griego que combina formas para " hueso ", ὀστέο-, osteo- y βλαστάνω, blastanō "germinan") son células con un solo núcleo que sintetizan hueso . Sin embargo, en el proceso de formación de hueso , los osteoblastos funcionan en grupos de células conectadas. Las células individuales no pueden producir hueso. Un grupo de osteoblastos organizados junto con el hueso formado por una unidad de células generalmente se denomina osteón .
Los osteoblastos son productos especializados y diferenciados terminalmente de las células madre mesenquimales . [1] Sintetizan colágeno denso y reticulado y proteínas especializadas en cantidades mucho más pequeñas, incluidas la osteocalcina y la osteopontina , que componen la matriz orgánica del hueso.
En grupos organizados de células conectadas, los osteoblastos producen hidroxiapatita , el mineral óseo , que se deposita de manera altamente regulada, en la matriz orgánica formando un tejido mineralizado fuerte y denso : la matriz mineralizada. El esqueleto mineralizado es el soporte principal para los cuerpos de los vertebrados que respiran aire . Es un importante depósito de minerales para la homeostasis fisiológica, incluido el equilibrio ácido-base y el mantenimiento del calcio o fosfato . [2] [3]
Estructura ósea [ editar ]
El esqueleto es un órgano grande que se forma y se degrada a lo largo de la vida en los vertebrados que respiran aire. El esqueleto, a menudo denominado sistema esquelético, es importante tanto como estructura de soporte como para el mantenimiento del calcio, fosfato y estado ácido-base en todo el organismo. [4] La parte funcional del hueso, la matriz ósea , es completamente extracelular. La matriz ósea se compone de proteínas y minerales . La proteína forma la matriz orgánica. Se sintetiza y luego se agrega el mineral. La gran mayoría de la matriz orgánica es colágeno , que proporciona resistencia a la tracción.. La matriz se mineraliza por deposición de hidroxiapatita (nombre alternativo, hidroxiapatita). Este mineral es duro y proporciona resistencia a la compresión . Por lo tanto, el colágeno y el mineral juntos son un material compuesto con una excelente resistencia a la tracción y a la compresión, que puede doblarse bajo una tensión y recuperar su forma sin daños. A esto se le llama deformación elástica . Las fuerzas que exceden la capacidad del hueso para comportarse elásticamente pueden causar fallas, generalmente fracturas óseas .
Remodelación ósea [ editar ]
El hueso es un tejido dinámico que está siendo remodelado constantemente por los osteoblastos , que producen y secretan proteínas de la matriz y transportan minerales a la matriz, y osteoclastos , que descomponen los tejidos.
Osteoblastos [ editar ]
Los osteoblastos son el principal componente celular del hueso. Los osteoblastos surgen de las células madre mesenquimales (MSC). Las MSC dan lugar a osteoblastos, adipocitos y miocitos entre otros tipos de células. Se entiende que la cantidad de osteoblastos es inversamente proporcional a la de los adipocitos medulares que comprenden tejido adiposo medular (MAT) . Los osteoblastos se encuentran en grandes cantidades en el periostio , la capa delgada de tejido conectivo en la superficie exterior de los huesos y en el endostio .
Normalmente, casi toda la matriz ósea, en los vertebrados que respiran aire , está mineralizada por los osteoblastos. Antes de que la matriz orgánica se mineralice, se llama osteoide . Los osteoblastos enterrados en la matriz se denominan osteocitos . Durante la formación de hueso, la capa superficial de los osteoblastos consta de células cuboideas, llamadas osteoblastos activos . Cuando la unidad formadora de hueso no sintetiza hueso de forma activa, los osteoblastos superficiales se aplanan y se denominan osteoblastos inactivos . Los osteocitos permanecen vivos y están conectados por procesos celulares a una capa superficial de osteoblastos. Los osteocitos tienen funciones importantes en el mantenimiento del esqueleto.
Osteoclastos [ editar ]
Los osteoclastos son células multinucleadas que se derivan de progenitores hematopoyéticos en la médula ósea que también dan lugar a monocitos en sangre periférica. [5] Los osteoclastos descomponen el tejido óseo y, junto con los osteoblastos y los osteocitos, forman los componentes estructurales del hueso. En el hueco dentro de los huesos hay muchos otros tipos de células de la médula ósea . Los componentes que son esenciales para la formación de hueso de los osteoblastos incluyen células madre mesenquimales (precursoras de osteoblastos) y vasos sanguíneos que suministran oxígeno y nutrientes para la formación de hueso. El hueso es un tejido muy vascularizado, y la formación activa de células de los vasos sanguíneos, también a partir de células madre mesenquimales, es esencial para apoyar la actividad metabólica del hueso. El equilibrio de la formación ósea y la resorción ósea.tiende a ser negativo con la edad, particularmente en mujeres posmenopáusicas, [6] a menudo conduce a una pérdida de hueso lo suficientemente grave como para causar fracturas, lo que se denomina osteoporosis .
Osteogénesis [ editar ]
El hueso está formado por uno de dos procesos: osificación endocondral u osificación intramembranosa . La osificación endocondral es el proceso de formación de hueso a partir del cartílago y este es el método habitual. Esta forma de desarrollo óseo es la forma más compleja: sigue la formación de un primer esqueleto de cartílago hecho por condrocitos , que luego se extrae y reemplaza por hueso, hecho por osteoblastos. La osificación intramembranosa es la osificación directa del mesénquima como ocurre durante la formación de los huesos de la membrana del cráneo y otros. [7]
Durante la diferenciación de osteoblastos , las células progenitoras en desarrollo expresan el factor de transcripción regulador Cbfa1 / Runx2 . Un segundo factor de transcripción requerido es el factor de transcripción Sp7 . [8] Las células osteocondroprogenitoras se diferencian bajo la influencia de factores de crecimiento , aunque las células madre mesenquimales aisladas en cultivo de tejidos también pueden formar osteoblastos en condiciones permisivas que incluyen vitamina C y sustratos para la fosfatasa alcalina , una enzima clave que proporciona altas concentraciones de fosfato en el mineral. sitio de deposición. [1]
Proteínas morfogenéticas óseas [ editar ]
Los factores de crecimiento clave en la diferenciación esquelética endocondral incluyen proteínas morfogenéticas óseas (BMP) que determinan en gran medida dónde se produce la diferenciación de condrocitos y dónde quedan espacios entre los huesos. El sistema de reemplazo de cartílago por hueso tiene un sistema regulador complejo. BMP2 también regula el patrón esquelético temprano. factor de crecimiento transformante beta (TGF-β), es parte de una superfamilia de proteínas que incluyen BMP, que poseen elementos de señalización comunes en la vía de señalización de TGF beta . El TGF-β es particularmente importante en la diferenciación del cartílago , que generalmente precede a la formación de hueso para la osificación endocondral. Una familia adicional de factores reguladores esenciales es lafactores de crecimiento de fibroblastos (FGF) que determinan dónde se encuentran los elementos esqueléticos en relación con la piel
Hormonas esteroides y proteicas [ editar ]
Muchos otros sistemas reguladores están involucrados en la transición del cartílago al hueso y en el mantenimiento de los huesos. Un regulador hormonal especialmente importante dirigido a los huesos es la hormona paratiroidea (PTH). La hormona paratiroidea es una proteína producida por la glándula paratiroidea bajo el control de la actividad del calcio sérico. [3]La PTH también tiene importantes funciones sistémicas, como mantener las concentraciones séricas de calcio casi constantes independientemente de la ingesta de calcio. El aumento de calcio en la dieta da como resultado aumentos menores en el calcio en sangre. Sin embargo, este no es un mecanismo significativo que respalde la formación de hueso de osteoblastos, excepto en la condición de calcio dietético bajo; Además, el calcio dietético anormalmente alto aumenta el riesgo de consecuencias graves para la salud que no están directamente relacionadas con la masa ósea, incluidos ataques cardíacos y accidentes cerebrovasculares . [9] La estimulación intermitente de PTH aumenta la actividad de los osteoblastos, aunque la PTH es bifuncional y media en la degradación de la matriz ósea a concentraciones más altas.
El esqueleto también se modifica para la reproducción y en respuesta al estrés nutricional y hormonal ; responde a los esteroides , incluidos los estrógenos y los glucocorticoides , que son importantes en la reproducción y la regulación del metabolismo energético. El recambio óseo implica un gasto importante de energía para la síntesis y degradación, lo que implica muchas señales adicionales, incluidas las hormonas hipofisarias . Dos de ellos son la hormona adrenocorticotrópica (ACTH) [10] y la hormona estimulante del folículo . [11] El papel fisiológico de las respuestas a estas y varias otras glicoproteínashormonas, no se comprende completamente, aunque es probable que la ACTH sea bifuncional, como la PTH, apoyando la formación de hueso con picos periódicos de ACTH, pero causando destrucción ósea en grandes concentraciones. En ratones, las mutaciones que reducen la eficacia de la producción de glucocorticoides inducida por ACTH en las glándulas suprarrenales hacen que el esqueleto se vuelva denso ( hueso osteosclerótico ). [12] [13]
Organización y ultraestructura [ editar ]
En hueso bien conservado estudiado con gran aumento mediante microscopía electrónica , se muestra que los osteoblastos individuales están conectados por uniones estrechas , que impiden el paso del líquido extracelular y, por lo tanto, crean un compartimento óseo separado del líquido extracelular general. [14] Los osteoblastos también están conectados por uniones gap , pequeños poros que conectan los osteoblastos, lo que permite que las células de una cohorte funcionen como una unidad. [15] Las uniones gap también conectan capas más profundas de células con la capa superficial ( osteocitos cuando están rodeados de hueso). Esto se demostró directamente mediante la inyección de tintes fluorescentes de bajo peso molecular. en osteoblastos y mostrando que el tinte se difundió a las células circundantes y más profundas en la unidad formadora de hueso. [16] El hueso se compone de muchas de estas unidades, que están separadas por zonas impermeables sin conexiones celulares, llamadas líneas de cemento.
Colágeno y proteínas accesorias [ editar ]
Casi todo el componente orgánico (no mineral) del hueso es colágeno denso tipo I, [17] que forma cuerdas densas reticuladas que le dan al hueso su resistencia a la tracción. Por mecanismos aún poco claros, los osteoblastos secretan capas de colágeno orientado, con las capas paralelas al eje largo del hueso alternando con capas en ángulo recto con el eje largo del hueso cada pocos micrómetros . Los defectos en el colágeno tipo I causan el trastorno hereditario óseo más común, llamado osteogénesis imperfecta . [18]
Cantidades menores, pero importantes, de proteínas pequeñas, incluidas osteocalcina y osteopontina , se secretan en la matriz orgánica del hueso. [19] La osteocalcina no se expresa en concentraciones significativas excepto en el hueso, por lo que la osteocalcina es un marcador específico para la síntesis de la matriz ósea. [20] Estas proteínas enlazan componentes orgánicos y minerales de la matriz ósea. [21] Las proteínas son necesarias para la máxima fuerza de la matriz debido a su localización intermedia entre el mineral y el colágeno.
Sin embargo, en ratones en los que la expresión de osteocalcina u osteopontina se eliminó mediante la alteración dirigida de los genes respectivos ( ratones knockout ), la acumulación de mineral no se vio notablemente afectada, lo que indica que la organización de la matriz no está significativamente relacionada con el transporte de minerales. [22] [23]
Hueso versus cartílago [ editar ]
El esqueleto primitivo es el cartílago , un tejido sólido avascular (sin vasos sanguíneos) en el que se encuentran las células secretoras de cartílago-matriz individuales, o condrocitos . Los condrocitos no tienen conexiones intercelulares y no están coordinados en unidades. El cartílago está compuesto por una red de colágeno tipo II mantenido en tensión por proteínas absorbentes de agua, proteoglicanos hidrofílicos . [24] Este es el esqueleto adulto en peces cartilaginosos como los tiburones . Se desarrolla como el esqueleto inicial en clases de animales más avanzadas .
En los vertebrados que respiran aire, el cartílago es reemplazado por hueso celular. Un tejido de transición es cartílago mineralizado . El cartílago se mineraliza por la expresión masiva de enzimas productoras de fosfato, que provocan altas concentraciones locales de calcio y fosfato que precipitan. [24] Este cartílago mineralizado no es denso ni fuerte. En los vertebrados que respiran aire se utiliza como andamio para la formación de hueso celular producido por osteoblastos, y luego es eliminado por osteoclastos , que se especializan en degradar tejido mineralizado.
Los osteoblastos producen un tipo avanzado de matriz ósea que consta de cristales densos e irregulares de hidroxiapatita , empaquetados alrededor de las cuerdas de colágeno. [25] Este es un material compuesto fuerte que permite que el esqueleto se forme principalmente como tubos huecos. Reducir los huesos largos a tubos reduce el peso mientras se mantiene la fuerza.
Mineralización del hueso [ editar ]
Los mecanismos de mineralización no se comprenden completamente. Los compuestos fluorescentes de bajo peso molecular como la tetraciclina o la calceína se unen fuertemente al mineral óseo cuando se administran por períodos cortos. Luego se acumulan en bandas estrechas en el hueso nuevo. [26] Estas bandas atraviesan el grupo contiguo de osteoblastos formadores de hueso. Ocurren en un frente de mineralización estrecho ( submicrométrico ). La mayoría de las superficies óseas no expresan formación de hueso nuevo, ni captación de tetraciclina ni formación de minerales. Esto sugiere fuertemente que el transporte facilitado o activo, coordinado a través del grupo formador de hueso, está involucrado en la formación de hueso, y que solo ocurre la formación de minerales mediada por células. Es decir, el calcio de la dieta no crea minerales por acción masiva.
El mecanismo de formación de minerales en el hueso es claramente distinto del proceso filogenéticamente más antiguo mediante el cual se mineraliza el cartílago: la tetraciclina no marca el cartílago mineralizado en bandas estrechas o en sitios específicos, sino de manera difusa, de acuerdo con un mecanismo de mineralización pasivo. [25]
Los osteoblastos separan el hueso del líquido extracelular mediante uniones estrechas [14] mediante transporte regulado. A diferencia del cartílago, el fosfato y el calcio no pueden entrar ni salir por difusión pasiva, porque las uniones estrechas de los osteoblastos aíslan el espacio de formación ósea. El calcio se transporta a través de los osteoblastos mediante transporte facilitado (es decir, mediante transportadores pasivos, que no bombean calcio contra un gradiente). [25] Por el contrario, el fosfato se produce activamente mediante una combinación de secreción de compuestos que contienen fosfato, incluido el ATP , y fosfatasas.que escinden el fosfato para crear una alta concentración de fosfato en el frente de mineralización. La fosfatasa alcalina es una proteína anclada a la membrana que es un marcador característico expresado en grandes cantidades en la cara apical (secretora) de los osteoblastos activos.
Se trata de al menos un proceso de transporte regulado más. La estequiometría del mineral óseo es básicamente la de la hidroxiapatita que se precipita a partir de fosfato, calcio y agua a un pH ligeramente alcalino : [27]
6 HPO 4 2− + 2 H 2 O + 10 Ca 2+ ⇌ Ca 10 (PO 4 ) 6 (OH) 2 + 8 H +En un sistema cerrado a medida que el mineral se precipita, el ácido se acumula, bajando rápidamente el pH y deteniendo la precipitación adicional. El cartílago no presenta ninguna barrera a la difusión y, por lo tanto, el ácido se difunde, lo que permite que continúe la precipitación. En el osteón, donde la matriz está separada del líquido extracelular por uniones estrechas, esto no puede ocurrir. En el compartimento sellado y controlado, la eliminación de H + impulsa la precipitación en una amplia variedad de condiciones extracelulares, siempre que haya calcio y fosfato disponibles en el compartimento de la matriz. [28] El mecanismo por el cual el ácido transita por la capa de barrera sigue siendo incierto. Los osteoblastos tienen capacidad para el intercambio de Na + / H + a través de los intercambiadores redundantes de Na / H, NHE1 y NHE6.[29] Esteintercambio deH + es un elemento importante en la eliminación de ácido, aunquese desconoceel mecanismo por el cual el H + se transporta desde el espacio de la matriz al osteoblasto de barrera.
En la remoción de hueso, un mecanismo de transporte inverso utiliza ácido suministrado a la matriz mineralizada para conducir la hidroxiapatita a la solución. [30]
Retroalimentación de osteocitos [ editar ]
La retroalimentación de la actividad física mantiene la masa ósea, mientras que la retroalimentación de los osteocitos limita el tamaño de la unidad formadora de hueso. [31] Un mecanismo adicional importante es la secreción por los osteocitos, enterrados en la matriz, de esclerostina , una proteína que inhibe una vía que mantiene la actividad de los osteoblastos. Así, cuando el osteón alcanza un tamaño límite, desactiva la síntesis ósea. [32]
Morfología y tinción histológica [ editar ]
La tinción con hematoxilina y eosina (H&E) muestra que el citoplasma de los osteoblastos activos es levemente basófilo debido a la presencia sustancial de retículo endoplásmico rugoso . El osteoblasto activo produce una cantidad sustancial de colágeno tipo I. Aproximadamente el 10% de la matriz ósea es colágeno con el resto mineral. [27] El núcleo del osteoblasto es esférico y grande. Un osteoblasto activo se caracteriza morfológicamente por un aparato de Golgi prominente que aparece histológicamente como una zona clara adyacente al núcleo. Los productos de la célula se transportan principalmente al osteoide, la matriz no mineralizada. Los osteoblastos activos se pueden marcar con anticuerpos contra el colágeno de tipo I, o usando naftol fosfato y el colorante de diazonio azul rápido para demostrar directamente la actividad de la enzima fosfatasa alcalina .
Osteoblasto (tinción de Wright Giemsa, 100x)
Micrografía de luz de hueso esponjoso descalcificado que muestra osteoblastos que sintetizan activamente osteoide, que contiene dos osteocitos.
Micrografía de luz de tejido no calcificado que muestra osteoblastos que sintetizan activamente osteoide (centro).
Micrografía de luz de tejido no calcificado que muestra osteoblastos que sintetizan activamente tejido óseo rudimentario (centro).
Osteoblastos que recubren el hueso (tinción H&E).
Aislamiento de osteoblastos [ editar ]
- La primera técnica de aislamiento por método de microdisección fue descrita originalmente por Fell et al. [33] utilizando huesos de extremidades de pollo que se separaron en periostio y partes restantes. Obtuvo células que poseían características osteogénicas a partir de tejido cultivado utilizando huesos de extremidades de pollo que se separaron en periostio y partes restantes. Obtuvo células que poseían características osteogénicas de tejido cultivado.
- La digestión enzimática es una de las técnicas más avanzadas para aislar poblaciones de células óseas y obtener osteoblastos. Peck y col. (1964) [34] describieron el método original que ahora utilizan a menudo muchos investigadores.
- En 1974 Jones et al. [35] encontraron que los osteoblastos se movían lateralmente in vivo e in vitro en diferentes condiciones experimentales y describieron el método de migración en detalle. Sin embargo, los osteoblastos estaban contaminados por células que migraban desde las aberturas vasculares, que podrían incluir células endoteliales y fibroblastos.
Ver también [ editar ]
- Lista de tipos de células humanas derivadas de las capas germinales
Referencias [ editar ]
- ^ a b Pittenger MF, Mackay AM, Beck SC, Jaiswal RK, Douglas R, Mosca JD, Moorman MA, Simonetti DW, Craig S, Marshak DR (abril de 1999). "Potencial multilinaje de las células madre mesenquimales humanas adultas". Ciencia . 284 (5411): 143–7. Código Bibliográfico : 1999Sci ... 284..143P . doi : 10.1126 / science.284.5411.143 . PMID 10102814 .
- ^ Arnett T (2003). "Regulación de la función de las células óseas por equilibrio ácido-base" . Proc Nutr Soc . 62 (2): 511–20. doi : 10.1079 / pns2003268 . PMID 14506899 .
- ↑ a b Blair HC, Zaidi M, Huang CL, Sun L (noviembre de 2008). "La base del desarrollo de la diferenciación de células esqueléticas y la base molecular de los principales defectos esqueléticos". Biol Rev Camb Philos Soc . 83 (4): 401–15. doi : 10.1111 / j.1469-185X.2008.00048.x . PMID 18710437 . S2CID 20459725 .
- ^ Blair HC, Sun L, Kohanski RA (noviembre de 2007). "Regulación equilibrada de proliferación, crecimiento, diferenciación y degradación en células esqueléticas". Ana. NY Acad. Sci . 1116 (1): 165–73. Código Bibliográfico : 2007NYASA1116..165B . doi : 10.1196 / annals.1402.029 . PMID 17646258 . S2CID 22605157 .
- ^ Loutit, JF; Nisbet, NW (enero de 1982). "El origen de los osteoclastos". Inmunobiología . 161 (3–4): 193–203. doi : 10.1016 / S0171-2985 (82) 80074-0 . PMID 7047369 .
- ^ Nicks KM, Fowler TW, Gaddy D (junio de 2010). "Hormonas reproductivas y hueso". Curr Osteoporos Rep . 8 (2): 60–7. doi : 10.1007 / s11914-010-0014-3 . PMID 20425612 . S2CID 43825140 .
- ^ Larsen, William J. (2001). Embriología humana (3. ed.). Filadelfia, Pensilvania: Churchill Livingstone. págs. 355 –357. ISBN 0-443-06583-7.
- ^ Karsenty G (2008). "Control transcripcional de la esqueletogénesis". Annu Rev Genom Hum Genet . 9 : 183–96. doi : 10.1146 / annurev.genom.9.081307.164437 . PMID 18767962 .
- ^ Reid IR, Bristow SM, Bolland MJ (abril de 2015). "Complicaciones cardiovasculares de los suplementos de calcio". J. Cell. Biochem . 116 (4): 494–501. doi : 10.1002 / jcb.25028 . PMID 25491763 . S2CID 40654125 .
- ^ Zaidi M, Sun L, Robinson LJ, Tourkova IL, Liu L, Wang Y, Zhu LL, Liu X, Li J, Peng Y, Yang G, Shi X, Levine A, Iqbal J, Yaroslavskiy BB, Isales C, Blair HC (mayo de 2010). "ACTH protege contra la osteonecrosis ósea inducida por glucocorticoides" . Proc. Natl. Acad. Sci. USA . 107 (19): 8782–7. Código Bibliográfico : 2010PNAS..107.8782Z . doi : 10.1073 / pnas.0912176107 . PMC 2889316 . PMID 20421485 .
- ^ Sun L, Peng Y, Sharrow AC, Iqbal J, Zhang Z, Papachristou DJ, Zaidi S, Zhu LL, Yaroslavskiy BB, Zhou H, Zallone A, Sairam MR, Kumar TR, Bo W, Braun J, Cardoso-Landa L , Schaffler MB, Moonga BS, Blair HC, Zaidi M (abril de 2006). "La FSH regula directamente la masa ósea". Celular . 125 (2): 247–60. doi : 10.1016 / j.cell.2006.01.051 . PMID 16630814 . S2CID 7544706 .
- ^ Hoekstra M, Meurs I, Koenders M, Out R, Hildebrand RB, Kruijt JK, Van Eck M, Van Berkel TJ (abril de 2008). "La ausencia de captación de éster de colesterol de HDL en ratones a través de SR-BI altera una respuesta de estrés mediada por glucocorticoides suprarrenales adecuada al ayuno" . J. Lipid Res . 49 (4): 738–45. doi : 10.1194 / jlr.M700475-JLR200 . PMID 18204096 .
- ^ Martineau C, Martin-Falstrault L, Brissette L, Moreau R (enero de 2014). "El modelo de ratón nulo de Scarb1 aterogénico muestra un fenotipo de masa ósea alta" . Soy. J. Physiol. Endocrinol. Metab . 306 (1): E48–57. doi : 10.1152 / ajpendo.00421.2013 . PMC 3920004 . PMID 24253048 .
- ↑ a b Arana-Chavez VE, Soares AM, Katchburian E (agosto de 1995). "Uniones entre los osteoblastos en desarrollo temprano de la calvaria de rata según lo revelado por microscopía electrónica de congelación-fractura y sección ultrafina" . Arco. Histol. Cytol . 58 (3): 285–92. doi : 10.1679 / aohc.58.285 . PMID 8527235 .
- ^ Doty SB (1981). "Evidencia morfológica de uniones gap entre células óseas". Calcif. Tissue Int . 33 (5): 509-12. doi : 10.1007 / BF02409482 . PMID 6797704 . S2CID 29501339 .
- ^ Yellowley CE, Li Z, Zhou Z, Jacobs CR, Donahue HJ (febrero de 2000). "Uniones de brecha funcional entre células osteocíticas y osteoblásticas". J. Bone Miner. Res . 15 (2): 209-17. doi : 10.1359 / jbmr.2000.15.2.209 . PMID 10703922 . S2CID 7632980 .
- ^ Reddi AH, Gay R, Gay S, Miller EJ (diciembre de 1977). "Transiciones en los tipos de colágeno durante la formación de cartílago, hueso y médula ósea inducida por la matriz" . Proc. Natl. Acad. Sci. USA . 74 (12): 5589–92. Código bibliográfico : 1977PNAS ... 74.5589R . doi : 10.1073 / pnas.74.12.5589 . PMC 431820 . PMID 271986 .
- ^ Kuivaniemi H, Tromp G, Prockop DJ (abril de 1991). "Mutaciones en los genes del colágeno: causas de enfermedades raras y algunas comunes en los seres humanos". FASEB J . 5 (7): 2052–60. doi : 10.1096 / fasebj.5.7.2010058 . PMID 2010058 . S2CID 24461341 .
- ^ Aubin JE, Liu F, Malaval L, Gupta AK (agosto de 1995). "Diferenciación de osteoblastos y condroblasto". Hueso . 17 (2 Supl.): 77S – 83S. doi : 10.1016 / 8756-3282 (95) 00183-E . PMID 8579903 .
- ^ Delmas PD, Demiaux B, Malaval L, Chapuy MC, Meunier PJ (abril de 1986). "[Osteocalcina (o gla-proteína ósea), un nuevo marcador biológico para el estudio de la patología ósea]". Presse Med (en francés). 15 (14): 643–6. PMID 2939433 .
- ^ Roach HI (junio de 1994). "¿Por qué la matriz ósea contiene proteínas no colágenas? Los posibles roles de la osteocalcina, osteonectina, osteopontina y sialoproteína ósea en la mineralización y reabsorción ósea". Cell Biol. Int . 18 (6): 617–28. doi : 10.1006 / cbir.1994.1088 . PMID 8075622 . S2CID 20913443 .
- ^ Boskey AL, Gadaleta S, Gundberg C, Doty SB, Ducy P, Karsenty G (septiembre de 1998). "El análisis microspectroscópico infrarrojo por transformada de Fourier de huesos de ratones deficientes en osteocalcina proporciona información sobre la función de la osteocalcina". Hueso . 23 (3): 187–96. doi : 10.1016 / s8756-3282 (98) 00092-1 . PMID 9737340 .
- ^ Thurner PJ, Chen CG, Ionova-Martin S, Sun L, Harman A, Porter A, Ager JW, Ritchie RO, Alliston T (junio de 2010). "La deficiencia de osteopontina aumenta la fragilidad ósea pero conserva la masa ósea" . Hueso . 46 (6): 1564–73. doi : 10.1016 / j.bone.2010.02.014 . PMC 2875278 . PMID 20171304 .
- ↑ a b Blair HC, Zaidi M, Schlesinger PH (junio de 2002). "Mecanismos que equilibran la síntesis y la degradación de la matriz esquelética" . Biochem. J . 364 (Parte 2): 329–41. doi : 10.1042 / BJ20020165 . PMC 1222578 . PMID 12023876 .
- ↑ a b c Blair HC, Robinson LJ, Huang CL, Sun L, Friedman PA, Schlesinger PH, Zaidi M (2011). "Enfermedad del calcio y los huesos" . BioFactors . 37 (3): 159–67. doi : 10.1002 / biof.143 . PMC 3608212 . PMID 21674636 .
- ^ Frost HM (1969). "Análisis histológico basado en tetraciclina de remodelación ósea". Calcif Tissue Res . 3 (1): 211–37. doi : 10.1007 / BF02058664 . PMID 4894738 . S2CID 9373656 .
- ↑ a b Neuman WF, Neuman MW (1 de enero de 1958). La dinámica química del mineral óseo . Prensa de la Universidad de Chicago. ISBN 0-226-57512-8.[ página necesaria ]
- ^ Schartum S, Nichols G (mayo de 1962). "Sobre los gradientes de pH entre el compartimento extracelular y los fluidos que bañan la superficie mineral ósea y su relación con la distribución del ión calcio" . J. Clin. Invertir . 41 (5): 1163–8. doi : 10.1172 / JCI104569 . PMC 291024 . PMID 14498063 .
- ^ Liu L, Schlesinger PH, Slack NM, Friedman PA, Blair HC (junio de 2011). "Actividad de intercambio Na + / H + de alta capacidad en la mineralización de osteoblastos" . J. Cell. Physiol . 226 (6): 1702–12. doi : 10.1002 / jcp.22501 . PMC 4458346 . PMID 21413028 .
- ^ Blair HC, Teitelbaum SL, Ghiselli R, Gluck S (agosto de 1989). "Reabsorción ósea osteoclástica por una bomba de protones vacuolar polarizada". Ciencia . 245 (4920): 855–7. Código Bibliográfico : 1989Sci ... 245..855B . doi : 10.1126 / science.2528207 . PMID 2528207 .
- ^ Klein-Nulend J, Nijweide PJ, Burger EH (junio de 2003). "Estructura ósea y osteocitos". Curr Osteoporos Rep . 1 (1): 5–10. doi : 10.1007 / s11914-003-0002-y . PMID 16036059 . S2CID 9456704 .
- ^ Barón, Roland; Rawadi, Georges; Román-Román, Sergio (2006). "Señalización WNT: un regulador clave de la masa ósea". Temas actuales en biología del desarrollo . 76 . págs. 103-127. doi : 10.1016 / S0070-2153 (06) 76004-5 . ISBN 978-0-12-153176-8. PMID 17118265 .
- ^ Fell, HB (enero de 1932). "La capacidad osteogénica in vitro de periostio y endostio aislado del esqueleto de extremidades de embriones de aves y polluelos" . Revista de anatomía . 66 (Parte 2): 157–180.11. PMC 1248877 . PMID 17104365 .
- ^ Peck, WA; Birge, SJ; Fedak, SA (11 de diciembre de 1964). "Células óseas: estudios bioquímicos y biológicos después del aislamiento enzimático". Ciencia . 146 (3650): 1476–1477. Código Bibliográfico : 1964Sci ... 146.1476P . doi : 10.1126 / science.146.3650.1476 . PMID 14208576 . S2CID 26903706 .
- ^ Jones, SJ; Boyde, A. (diciembre de 1977). "Algunas observaciones morfológicas sobre osteoclastos". Investigación de células y tejidos . 185 (3): 387–97. doi : 10.1007 / bf00220298 . PMID 597853 . S2CID 26078285 .
Lectura adicional [ editar ]
- William F. Neuman y Margaret W. Neuman. (1958). La dinámica química del mineral óseo. Chicago: Prensa de la Universidad de Chicago. ISBN 0-226-57512-8 .
- Netter, Frank H. (1987). Sistema musculoesquelético: anatomía, fisiología y trastornos metabólicos . Summit, Nueva Jersey: Ciba-Geigy Corporation ISBN 0-914168-88-6 .