| |||
| Nombres | |||
|---|---|---|---|
| Nombre IUPAC sistemático Fosfato [1] | |||
| Identificadores | |||
Modelo 3D ( JSmol ) | |||
| 3903772 | |||
| CHEBI | |||
| ChemSpider | |||
| 1997 | |||
| Malla | Fosfatos | ||
PubChem CID | |||
| UNII | |||
| |||
| |||
| Propiedades | |||
| correos3− 4 | |||
| Masa molar | 94,9714 g mol -1 | ||
| Ácido conjugado | Fosfato monohidrógeno | ||
Salvo que se indique lo contrario, los datos se proporcionan para materiales en su estado estándar (a 25 ° C [77 ° F], 100 kPa). | |||
| Referencias de Infobox | |||
En química , un fosfato es un anión , sal , grupo funcional o éster derivado de un ácido fosfórico . Más comúnmente significa ortofosfato , un derivado del ácido ortofosfórico H
3correos
4.
El ion fosfato u ortofosfato [PO
4]3−
se deriva del ácido fosfórico mediante la eliminación de tres protones H+
. La eliminación de uno o dos protones da lugar al ion fosfato dihidrógeno [H
2correos
4]-
y el ion fosfato de hidrógeno [HPO
4]2−
ion, respectivamente. Estos nombres también se utilizan para las sales de esos aniones, como dihidrogenofosfato de amonio y fosfato trisódico .
H
3correos
4
Ácido fosfórico[H
2correos
4]-
Fosfato de dihidrógeno[HPO
4]2−
Fosfato de hidrógeno[CORREOS
4]3−
Fosfato
En química orgánica , el fosfato u ortofosfato es un organofosfato , un éster de ácido ortofosfórico de la forma PO
4RR'R ” donde uno o más átomos de hidrógeno están reemplazados por grupos orgánicos . Un ejemplo es el fosfato de trimetilo , (CH
3)
3correos
4. El término también se refiere al grupo funcional trivalente OP (O-)
3 en tales ésteres.
Los ortofosfatos son especialmente importantes entre los distintos fosfatos debido a su papel clave en bioquímica , biogeoquímica y ecología , y su importancia económica para la agricultura y la industria. [2] La adición y eliminación de grupos fosfato ( fosforilación y desfosforilación ) son pasos clave en el metabolismo celular .
Los ortofosfatos pueden condensarse para formar pirofosfatos .
Propiedades químicas [ editar ]
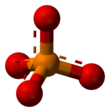
El ion fosfato tiene una masa molar de 94,97 g / mol y consta de un átomo de fósforo central rodeado por cuatro átomos de oxígeno en una disposición tetraédrica . Es la base conjugada del ion fosfato de hidrógeno H (PO
4)2−
, que a su vez es la base conjugada del ion fosfato dihidrógeno H
2(CORREOS
4)-
, que a su vez es la base conjugada del ácido ortofosfórico , H
3correos
4.
Muchos fosfatos no son solubles en agua a temperatura y presión estándar . Los fosfatos de sodio, potasio, rubidio , cesio y amonio son todos solubles en agua. La mayoría de los otros fosfatos son solo ligeramente solubles o insolubles en agua. Por regla general, los fosfatos de hidrógeno y dihidrógeno son ligeramente más solubles que los fosfatos correspondientes.
Equilibrios en solución [ editar ]
En solución acuosa, el ácido ortofosfórico y sus tres aniones derivados coexisten de acuerdo con los equilibrios de disociación y recombinación a continuación [3]
| Equilibrio | Constante de disociación K a [4] | p K a |
|---|---|---|
| H 3 PO 4 ⇌ H 2correos- 4+ H+ | K a 1 = [ H+ ] [ H 2correos- 4] / [ H 3correos 4] ≈ 7.5 × 10 −3 | p K a1 = 2,14 |
| H 2correos- 4⇌ HPO2− 4+ H+ | K a 2 = [ H+ ] [ HPO2− 4] / [ H 2correos- 4] ≈ 6.2 × 10 −8 | p K a2 = 7,20 |
| HPO2− 4⇌ PO3− 4+ H+ | K a 3 = [ H+ ] [ PO3− 4] / [ HPO2− 4] ≈ 2,14 × 10 −13 | p K a3 = 12,37 |
Los valores están a 25 ° C y 0 fuerza iónica.
Los valores de p K a son los valores de pH donde la concentración de cada especie es igual a la de sus bases conjugadas . A pH 1 o inferior, el ácido fosfórico prácticamente no se disocia. Alrededor de un pH de 4,7 (a medio camino entre los dos primeros valores de p K a ) el ion fosfato dihidrógeno, [H
2correos
4]-
, es prácticamente la única especie presente. Alrededor de pH 9,8 (a medio camino entre el segundo y tercer valor de p K a ) el ion fosfato monohidrógeno, [HPO
4]2−
, es la única especie presente. A un pH de 13 o superior, el ácido se disocia completamente como ion fosfato, (PO
4)3−
.
Esto significa que las sales de los iones mono y difosfato se pueden cristalizar selectivamente a partir de una solución acuosa estableciendo el valor de pH en 4,7 o 9,8.
En efecto, H
3correos
4, H
2(CORREOS
4)-
y H (PO
4)2−
se comportan como ácidos débiles separados porque los sucesivos p K a difieren en más de 4.
El fosfato puede formar muchos iones poliméricos como el pirofosfato ), (P
2O
7)4−
, y trifosfato , (P
3O
10)5−
. Los diversos iones metafosfato (que suelen ser polímeros lineales largos) tienen una fórmula empírica de (PO
3)-
y se encuentran en muchos compuestos.
Bioquímica de los fosfatos [ editar ]
En los sistemas biológicos , el fósforo se puede encontrar como aniones fosfato libres en solución ( fosfato inorgánico ) o unido a moléculas orgánicas como varios organofosforados .
El fosfato inorgánico generalmente se denota P i y a pH fisiológico (homeostático) consiste principalmente en una mezcla de [HPO
4]2−
y [H
2correos
4]-
iones. A pH neutro, como en el citosol (pH = 7,0), las concentraciones del ácido ortofosfórico y sus tres aniones tienen las proporciones
- [ H
2correos-
4] / [ H
3correos
4] ≈ 7.5 × 10 4 - [ HPO2−
4] / [ H
2correos-
4 ] ≈ 0,62 - [ PO3−
4] / [ HPO2−
4] ≈ 2,14 × 10 −6
Por lo tanto, solo [H
2correos
4]-
y [HPO
4]2−
Los iones están presentes en cantidades significativas en el citosol (62% [H
2correos
4]-
, 38% [HPO
4]2−
). En el líquido extracelular (pH = 7,4), esta proporción se invierte (61% [HPO
4]2−
, 39% [H
2correos
4]-
).
El fosfato inorgánico puede estar presente también como aniones pirofosfato [P
2O
7]4−
, que puede dar ortofosfato por hidrólisis :
- [PAG
2O
7]4−
+ H 2 O ⇌ 2 [HPO
4]2−
Los fosfatos orgánicos se encuentran comúnmente en forma de ésteres como nucleótidos (por ejemplo , AMP , ADP y ATP ) y en el ADN y el ARN . Los aniones de ortofosfato libres se pueden liberar mediante la hidrólisis de los enlaces fosfoanhídrido en ATP o ADP. Estas reacciones de fosforilación y desfosforilación son el almacenamiento inmediato y la fuente de energía para muchos procesos metabólicos . El ATP y el ADP a menudo se denominan fosfatos de alta energía , al igual que los fosfágenos en el tejido muscular. Existen reacciones similares para los otros nucleósidos difosfatos.y trifosfatos .
Huesos y dientes [ editar ]
Una aparición importante de fosfatos en sistemas biológicos es como material estructural de huesos y dientes. Estas estructuras están hechas de fosfato de calcio cristalino en forma de hidroxiapatita . El esmalte denso y duro de los dientes de los mamíferos consiste en fluoroapatita , un fosfato hidroxicálcico donde algunos de los grupos hidroxilo han sido reemplazados por iones de fluoruro .
Usos de investigación médica y biológica [ editar ]
El tipo medicinal (sal) del fósforo es el fosfato. Algunos fosfatos, que ayudan a curar muchas infecciones del tracto urinario, se utilizan para hacer que la orina sea más ácida. Para evitar el desarrollo de cálculos de calcio en el tracto urinario, se utilizan algunos fosfatos. [5] Para los pacientes que no pueden obtener suficiente fósforo en su dieta diaria, los fosfatos se usan como suplementos dietéticos, generalmente debido a ciertos trastornos o enfermedades. [5] Los fosfatos inyectables solo pueden ser manipulados por el proveedor de atención médica o bajo su supervisión. [5]
Con una aguja pequeña, un proveedor de atención médica tomará una muestra de sangre de una vena del brazo. Se extraerá una pequeña cantidad de sangre en un tubo de ensayo o en un frasco después de insertar la aguja. Cuando la aguja entra o sale, uno puede sentir un poco de dolor. Por lo general, lleva menos de cinco minutos hacer esto. Este proceso se conoce como análisis de sangre de fosfato. [6]
Metabolismo vegetal [ editar ]
Las plantas absorben fósforo a través de varias vías: la vía micorrízica arbuscular y la vía de absorción directa.
Producción [ editar ]
Ocurrencia geológica [ editar ]
Los fosfatos son la forma natural del elemento fósforo , que se encuentra en muchos minerales de fosfato . En mineralogía y geología, el fosfato se refiere a una roca o mineral que contiene iones fosfato. Los fosfatos inorgánicos se extraen para obtener fósforo para su uso en la agricultura y la industria. [2]
El mayor productor y exportador mundial de fosfatos es Marruecos . Dentro de América del Norte, los depósitos más grandes se encuentran en la región de Bone Valley en el centro de Florida , la región de Soda Springs en el sureste de Idaho y la costa de Carolina del Norte . Los depósitos más pequeños se encuentran en Montana , Tennessee , Georgia y Carolina del Sur . La pequeña nación insular de Nauru y su vecina isla Banaba, que solían tener depósitos masivos de fosfato de la mejor calidad, han sido extraídos en exceso. El fosfato de roca también se puede encontrar en Egipto, Palestina, el Sahara Occidental, la isla de Navassa , Túnez, Togo y Jordania, países que tienen grandes industrias mineras de fosfato.
Las minas de fosforita se encuentran principalmente en:
- América del Norte :Estados Unidos, especialmente Florida, con depósitos menores en Carolina del Norte , Idaho y Tennessee
- África : Marruecos , Argelia , Egipto , Níger , Senegal , Togo , Túnez .
- Medio Oriente : Palestina , Arabia Saudita , Jordania , Siria , Irán e Irak , en la ciudad de Akashat , cerca de la frontera con Jordania.
- Asia central : Kazajstán
- Oceanía : Australia , Makatea , Nauru e isla Banaba
En 2007, al ritmo actual de consumo, se estimaba que el suministro de fósforo se agotaría en 345 años. [7] Sin embargo, algunos científicos pensaron que se producirá un " pico de fósforo " en 30 años y Dana Cordell del Institute for Sustainable Futures dijo que "al ritmo actual, las reservas se agotarán en los próximos 50 a 100 años". [8] Las reservas se refieren a la cantidad supuestamente recuperable a los precios actuales del mercado y, en 2012, el USGS estimó 71 mil millones de toneladas de reservas mundiales, mientras que en 2011 se extrajeron 0,19 mil millones de toneladas a nivel mundial. [9] El fósforo comprende el 0,1% en masa de la roca promedio [10] (mientras que, en perspectiva, su concentración típica en la vegetación es de 0.03% a 0.2%), [11]y, en consecuencia, hay billones de toneladas de fósforo en la corteza terrestre de 3 * 10 19 toneladas, [12] aunque en una concentración predominantemente más baja que los depósitos contados como reservas por inventariar y más baratos de extraer; Si se supone que los minerales de fosfato en la roca de fosfato son hidroxiapatita y fluoroapatita, los minerales de fosfato contienen aproximadamente un 18,5% de fósforo en peso y si la roca de fosfato contiene alrededor del 20% de estos minerales, la roca de fosfato promedio tiene aproximadamente un 3,7% de fósforo en peso.
Algunos depósitos de rocas de fosfato, como Mulberry en Florida, [13] se destacan por su inclusión de cantidades significativas de isótopos de uranio radiactivo. Este síndrome es digno de mención porque la radiactividad puede liberarse en las aguas superficiales [14] en el proceso de aplicación del fertilizante fosfatado resultante (por ejemplo, en muchas operaciones de cultivo de tabaco en el sureste de los Estados Unidos).
En diciembre de 2012, Cominco Resources anunció un recurso actualizado compatible con JORC de su proyecto Hinda en Congo-Brazzaville de 531 Mt, lo que lo convierte en el depósito de fosfato medido e indicado más grande del mundo. [15]
Minería [ editar ]
Los tres principales países productores de fosfato ( China , Marruecos y Estados Unidos) representan alrededor del 70% de la producción mundial.
| País | Producción (millones de kg) | Participación de la producción mundial (%) | Reservas (millones de kg) |
|---|---|---|---|
| Argelia | 1200 | 0,54 | 2,200,000 |
| Australia | 2600 | 1,17 | 1.030.000 |
| Brasil | 6.700 | 3,00 | 315.000 |
| porcelana | 100.000 | 44,83 | 3.700.000 |
| Egipto | 5.500 | 2,47 | 1.250.000 |
| India | 1.100 | 0,49 | 65.000 |
| Irak | 200 | 0,09 | 430.000 |
| Israel | 3.300 | 1,48 | 130.000 |
| Jordán | 7.500 | 3.36 | 1.300.000 |
| Kazajstán | 1.600 | 0,72 | 260.000 |
| México | 1.700 | 0,76 | 30.000 |
| Marruecos | 30.000 | 13.45 | 50.000.000 |
| Perú | 4000 | 1,79 | 820 000 |
| Rusia | 12,500 | 5.60 | 1.300.000 |
| Arabia Saudita | 3.300 | 1,48 | 956.000 |
| Senegal | 1.000 | 0.45 | 50.000 |
| Sudáfrica | 2.200 | 0,99 | 1,500,000 |
| Siria | 750 | 0,34 | 1.800.000 |
| Para llevar | 1.000 | 0.45 | 30.000 |
| Túnez | 4000 | 1,79 | 100.000 |
| Estados Unidos | 27.600 | 12.37 | 1,100,000 |
| Vietnam | 2700 | 1,21 | 30.000 |
| Otros paises | 2600 | 1,17 | 380.000 |
| Total | 223.000 | 100 | 69.000.000 |
Ecología [ editar ]
En términos ecológicos, debido a su importante papel en los sistemas biológicos, el fosfato es un recurso muy buscado. Una vez utilizado, a menudo es un nutriente limitante en el medio ambiente y su disponibilidad puede gobernar la tasa de crecimiento de los organismos. Esto es generalmente cierto en los ambientes de agua dulce , mientras que el nitrógeno es con mayor frecuencia el nutriente limitante en los ambientes marinos (agua de mar). La adición de altos niveles de fosfato a entornos y microambientes en los que normalmente es raro puede tener consecuencias ecológicas importantes. Por ejemplo, florece en las poblaciones de algunos organismos a expensas de otros, y el colapso de poblaciones privadas de recursos como el oxígeno (ver eutrofización) puede ocurrir. En el contexto de la contaminación, los fosfatos son un componente del total de sólidos disueltos , un indicador importante de la calidad del agua, pero no todo el fósforo está en una forma molecular que las algas puedan descomponer y consumir. [17]
Los precipitados de hidroxiapatita de calcio y calcita se pueden encontrar alrededor de las bacterias en la capa superior del suelo aluvial . [18] Como los minerales arcillosos promueven la biomineralización, la presencia de bacterias y minerales arcillosos dio lugar a precipitados de hidroxiapatita cálcica y calcita. [18]
Los depósitos de fosfato pueden contener cantidades significativas de metales pesados naturales. Las operaciones mineras que procesan roca fosfórica pueden dejar montones de relaves que contienen niveles elevados de cadmio , plomo , níquel , cobre , cromo y uranio . A menos que se manejen con cuidado, estos productos de desecho pueden filtrar metales pesados en aguas subterráneas o estuarios cercanos. La absorción de estas sustancias por las plantas y la vida marina puede conducir a la concentración de metales pesados tóxicos en los productos alimenticios. [19]
Ver también [ editar ]
- Pirofosfato - (P
2O
7)4− - Polifosfato - (HPO
3)
norte - Metafosfato - (POn
3) - Fertilizante
- Hipofosfito - H
2(CORREOS
2)- - Compuestos organofosforados
- Fosfato - OP (OR) 3 , como trifenilfosfato
- Recubrimiento de conversión de fosfato
- Soda de fosfato , una bebida de fuente de soda
- Fosfinato - OP (OR) R 2
- Fosfina - PR 3
- Óxido de fosfina - OPR 3
- Fosfinita - P (OR) R 2
- Fosfito - P (OR) 3
- Yeso fosforado
- Fosfonato - OP (OR) 2 R
- Fosfonito - P (OR) 2 R
- Fosforilación
- Fosfato de diamonio - (NH 4 ) 2 HPO 4
- Fosfato de disodio - Na 2 HPO 4
- Fosfato monosódico - NaH 2 PO 4
- Tripolifosfato de sodio - Na 5 P 3 O 10
- Cuenca de Ouled Abdoun
Referencias [ editar ]
- ^ "Fosfatos - base de datos química pública de PubChem" . El Proyecto PubChem . EE.UU .: Centro Nacional de Información Biotecnológica.
- ^ a b "Imprimación de fosfato" . Instituto de Investigación Industrial y de Fosfatos de Florida . Universidad Politécnica de Florida. Archivado desde el original el 29 de agosto de 2017 . Consultado el 30 de marzo de 2018 .
- ^ Campbell, Neil A .; Reece, Jane B. (2005). Biología (Séptima ed.). San Francisco, California: Benjamin Cummings . pag. 65. ISBN 0-8053-7171-0.
- ^ Kipton J. Powell, Paul L. Brown, Robert H. Byrne, Tamás Gajda, Glenn Hefter, Staffan Sjöberg, Hans Wanner (2005): "Especiación química de metales pesados ambientalmente significativos con ligandos inorgánicos. Parte 1: El Hg2+
, Cl - , OH - , CO2−
3, Entonces2−
4y PO3−
4sistemas acuosos ". Pure and Applied Chemistry , volumen 77, número 4, páginas 739–800. doi : 10.1351 / pac200577040739 - ^ a b c "Descripción del suplemento de fosfato (vía oral, vía parenteral) y marcas - Clínica Mayo" . www.mayoclinic.org . Consultado el 20 de noviembre de 2020 .
- ^ "Fosfato en sangre: prueba médica de MedlinePlus" . medlineplus.gov . Consultado el 20 de noviembre de 2020 .
- ^ Reilly, Michael (26 de mayo de 2007). "¿Cuánto tiempo va a durar?". Nuevo científico . 194 (2605): 38–9. Código Bibliográfico : 2007NewSc.194 ... 38R . doi : 10.1016 / S0262-4079 (07) 61508-5 .
- ↑ Leo Lewis (23 de junio de 2008). "Los científicos advierten de la falta de fósforo vital ya que los biocombustibles aumentan la demanda" . The Times .
- ^ Roca fosfórica del Servicio Geológico de Estados Unidos
- ^ Muestras de suelo de fósforo del Servicio Geológico de EE. UU.
- ^ Piso Anthoni. "Abundancia de elementos" . Seafriends.org.nz . Consultado el 10 de enero de 2013 .
- ^ Unión geofísica estadounidense , reunión de otoño de 2007, resumen # V33A-1161. Masa y composición de la corteza continental
- ^ Industria de fosfato de Florida central: Declaración de impacto ambiental . 2 . Estados Unidos. Agencia de Protección Ambiental. 1979.
- ^ C. Michael Hogan (2010). "Contaminación del agua" . En Mark McGinley y C. Cleveland (Washington, DC: Consejo Nacional para la Ciencia y el Medio Ambiente ) (ed.). Enciclopedia de la Tierra . Archivado desde el original el 16 de septiembre de 2010.
- ^ "Anuncio actualizado de recursos de Hinda: depósito de fosfato más grande del mundo ahora (12/04/2012)" . Recursos de Cominco . Archivado desde el original el 5 de octubre de 2016 . Consultado el 3 de mayo de 2013 .
- ^ Anuario de minerales de USGS - Roca fosfatada
- ^ Hochanadel, Dave (10 de diciembre de 2010). "Una cantidad limitada de fósforo total en realidad alimenta a las algas, según un estudio" . Científico del lago . Consultado el 10 de junio de 2012 .
El fósforo [B] iodisponible, fósforo que pueden utilizar las plantas y las bacterias, es solo una fracción del total, según Michael Brett, profesor de ingeniería de la Universidad de Washington ...
- ↑ a b Schmittner KE, Giresse P (1999). "Controles microambientales sobre biomineralización: procesos superficiales de precipitación de apatita y calcita en suelos cuaternarios, Rosellón, Francia". Sedimentología . 46 (3): 463–76. Código Bibliográfico : 1999Sedim..46..463S . doi : 10.1046 / j.1365-3091.1999.00224.x .
- ^ Gnandi, K .; Tchangbedjil, G .; Killil, K .; Babal, G .; Abbel, E. (marzo de 2006). "El impacto de los relaves de las minas de fosfato en la bioacumulación de metales pesados en peces marinos y crustáceos de la zona costera de Togo". Agua de Minas y Medio Ambiente . 25 (1): 56–62. doi : 10.1007 / s10230-006-0108-4 . S2CID 129497587 .
Enlaces externos [ editar ]
| Wikimedia Commons tiene medios relacionados con los fosfatos . |
- US Minerals Databrowser proporciona gráficos de datos que cubren el consumo, la producción, las importaciones, las exportaciones y el precio del fosfato y otros 86 minerales
- Fosfato: monografía de analitos - Asociación de Bioquímica Clínica y Medicina de Laboratorio