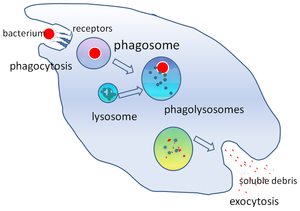
Fagosoma
En biología celular , un fagosoma es una vesícula formada alrededor de una partícula engullida por un fagocito a través de la fagocitosis . Los fagocitos profesionales incluyen macrófagos , neutrófilos y células dendríticas (CD) [ cita requerida ] . Un fagosoma se forma por la fusión de la membrana celular alrededor de un microorganismo , una célula senescente o una célula apoptótica . Los fagosomas tienen proteínas unidas a la membrana para reclutar y fusionarse con lisosomas para formar células maduras.fagolisosomas . Los lisosomas contienen enzimas hidrolíticas y especies reactivas de oxígeno (ROS) que matan y digieren los patógenos . Los fagosomas también pueden formarse en fagocitos no profesionales, pero solo pueden engullir un rango más pequeño de partículas y no contienen ROS. Los materiales útiles (por ejemplo, aminoácidos ) de las partículas digeridas se mueven al citosol y los desechos se eliminan por exocitosis . La formación de fagosomas es crucial para la homeostasis de los tejidos y la defensa tanto innata como adaptativa del huésped contra los patógenos.
Sin embargo, algunas bacterias pueden aprovechar la fagocitosis como estrategia de invasión. Se reproducen dentro del fagolisosoma (por ejemplo, Coxiella spp.) [1] o escapan al citoplasma antes de que el fagosoma se fusione con el lisosoma (por ejemplo, Rickettsia spp.). [2] Muchas micobacterias, incluidas Mycobacterium tuberculosis [3] [4] y Mycobacterium avium paratuberculosis , [5] pueden manipular el macrófago huéspedpara evitar que los lisosomas se fusionen con los fagosomas y creen fagolisosomas maduros. Tal maduración incompleta del fagosoma mantiene un ambiente favorable a los patógenos en su interior. [6]
Formación
Los fagosomas son lo suficientemente grandes como para degradar bacterias completas o células apoptóticas y senescentes, que suelen tener> 0,5 μm de diámetro. [7] Esto significa que un fagosoma es varios órdenes de magnitud más grande que un endosoma , que se mide en nanómetros .
Los fagosomas se forman cuando los patógenos u opsoninas se unen a un receptor transmembrana, que se distribuyen al azar en la superficie de la célula del fagocito. Tras la unión, la señalización "de afuera hacia adentro" desencadena la polimerización de actina y la formación de pseudópodos , que rodean y se fusionan detrás del microorganismo. La proteína quinasa C , la fosfoinositido 3-quinasa y la fosfolipasa C (PLC) son todas necesarias para señalizar y controlar la internalización de partículas. [8] Más receptores de la superficie celular pueden unirse a la partícula en un mecanismo similar a una cremallera a medida que el patógeno está rodeado, lo que aumenta la avidez de unión . [9] Receptor de Fc(FcR), los receptores del complemento (CR), el receptor de manosa y la Dectin-1 son receptores fagocíticos, lo que significa que pueden inducir la fagocitosis si se expresan en células no fagocíticas como los fibroblastos . [10] Otras proteínas, como los receptores tipo Toll, están involucradas en el reconocimiento de patrones de patógenos y, a menudo, se incorporan a los fagosomas, pero no desencadenan específicamente la fagocitosis en células no fagocíticas, por lo que no se consideran receptores fagocíticos.
Opsonización
Las opsoninas son etiquetas moleculares como anticuerpos y complementos que se adhieren a patógenos y regulan positivamente la fagocitosis. La inmunoglobulina G (IgG) es el principal tipo de anticuerpo presente en el suero . Es parte del sistema inmunológico adaptativo , pero se vincula con la respuesta innata mediante el reclutamiento de macrófagos para fagocitar patógenos. El anticuerpo se une a los microbios con el dominio Fab variable y el dominio Fc se une a los receptores Fc (FcR) para inducir la fagocitosis.
La internalización mediada por el complemento tiene protuberancias de membrana mucho menos significativas, pero la señalización aguas abajo de ambas vías convergen para activar Rho GTPasas . [11] Controlan la polimerización de actina que se requiere para que el fagosoma se fusione con endosomas y lisosomas.
Células no fagocíticas
Otros fagocitos no profesionales tienen cierto grado de actividad fagocítica, como las células epiteliales de la tiroides y la vejiga que pueden engullir los eritrocitos y las células epiteliales de la retina que internalizan los bastones retinianos. [7] Sin embargo, los fagocitos no profesionales no expresan receptores fagocíticos específicos como FcR y tienen una tasa de internalización mucho más baja.
Algunas bacterias invasoras también pueden inducir la fagocitosis en células no fagocíticas para mediar en la captación del huésped. Por ejemplo, Shigella puede secretar toxinas que alteran el citoesqueleto del hospedador y entran en el lado basolateral de los enterocitos . [12]
Estructura
Como la membrana del fagosoma está formada por la fusión de la membrana plasmática, la composición básica de la bicapa de fosfolípidos es la misma. Los endosomas y lisosomas luego se fusionan con el fagosoma para contribuir a la membrana, especialmente cuando la partícula engullida es muy grande, como un parásito . [13] También entregan varias proteínas de membrana al fagosoma y modifican la estructura del orgánulo.
Los fagosomas pueden engullir perlas artificiales de látex de baja densidad y luego purificarse a lo largo de un gradiente de concentración de sacarosa , lo que permite estudiar la estructura y la composición. [14] Al purificar los fagosomas en diferentes momentos, también se puede caracterizar el proceso de maduración. Los fagosomas tempranos se caracterizan por Rab5, que pasa a Rab7 a medida que la vesícula madura en fagosomas tardíos.
Proceso de maduración
El fagosoma naciente no es inherentemente bactericida. A medida que madura, se vuelve más ácido de pH 6,5 a pH 4, y gana marcadores de proteínas y enzimas hidrolíticas característicos. Las diferentes enzimas funcionan a varios pH óptimos, formando un rango de modo que cada una trabaja en etapas estrechas del proceso de maduración. La actividad enzimática se puede ajustar modificando el nivel de pH, lo que permite una mayor flexibilidad. El fagosoma se mueve a lo largo de los microtúbulos del citoesqueleto , fusionándose con endosomas y lisosomas secuencialmente de una manera dinámica de "besar y correr" . [15]Este transporte intracelular depende del tamaño de los fagosomas. Los orgánulos más grandes (con un diámetro de aproximadamente 3 μm) se transportan de manera muy persistente desde la periferia celular hacia la región perinuclear, mientras que los orgánulos más pequeños (con un diámetro de aproximadamente 1 μm) se transportan de forma más bidireccional hacia adelante y hacia atrás entre el centro celular y la periferia celular. [16] Bombas de protones vacuolares(v-ATPasa) se entregan al fagosoma para acidificar el compartimento del orgánulo, creando un entorno más hostil para los patógenos y facilitando la degradación de proteínas. Las proteínas bacterianas se desnaturalizan a pH bajo y se vuelven más accesibles a las proteasas, que no se ven afectadas por el ambiente ácido. Las enzimas se reciclan posteriormente del fagolisosoma antes de la egestión para que no se desperdicien. La composición de la membrana de fosfolípidos también cambia a medida que madura el fagosoma. [14]
La fusión puede tardar de minutos a horas dependiendo del contenido del fagosoma; La fusión mediada por el receptor de manosa o FcR dura menos de 30 minutos, pero los fagosomas que contienen perlas de látex pueden tardar varias horas en fusionarse con los lisosomas. [7] Se sugiere que la composición de la membrana del fagosoma afecta la tasa de maduración. Mycobacterium tuberculosis tiene una pared celular muy hidrófoba , que se supone que previene el reciclaje de la membrana y el reclutamiento de factores de fusión, por lo que el fagosoma no se fusiona con los lisosomas y la bacteria evita la degradación. [17]
Las moléculas lumenales más pequeñas se transfieren por fusión más rápido que las moléculas más grandes, lo que sugiere que se forma un pequeño canal acuoso entre el fagosoma y otras vesículas durante el "besar y correr", a través del cual sólo se permite un intercambio limitado. [7]
Regulación de fusión
Poco después de la internalización, la F-actina se despolimeriza del fagosoma recién formado, por lo que se vuelve accesible a los endosomas para la fusión y el suministro de proteínas. [7] El proceso de maduración se divide en etapas tempranas y tardías según los marcadores proteicos característicos, regulados por pequeñas Rab GTPasas. Rab5 está presente en fagosomas tempranos y controla la transición a fagosomas tardíos marcados por Rab7. [18]
Rab5 recluta PI-3 quinasa y otras proteínas de unión como Vps34 a la membrana del fagosoma, por lo que los endosomas pueden entregar proteínas al fagosoma. Rab5 participa parcialmente en la transición a Rab7, a través del complejo CORVET y el complejo HOPS en la levadura. [18] La vía de maduración exacta en mamíferos no se comprende bien, pero se sugiere que HOPS puede unirse a Rab7 y desplazar al inhibidor de la disociación de nucleótidos de guanosina (GDI). [19] Rab11 participa en el reciclaje de membranas. [20]
Fagolisosoma
El fagosoma se fusiona con los lisosomas para formar un fagolisosoma, que tiene varias propiedades bactericidas. El fagolisosoma contiene especies reactivas de oxígeno y nitrógeno (ROS y RNS) y enzimas hidrolíticas. El compartimento también es ácido debido a las bombas de protones (v-ATPasas) que transportan H + a través de la membrana, que se utiliza para desnaturalizar las proteínas bacterianas.
Las propiedades exactas de los fagolisosomas varían según el tipo de fagocito. Los de las células dendríticas tienen propiedades bactericidas más débiles que los de los macrófagos y neutrófilos. Además, los macrófagos se dividen en proinflamatorio "asesino" M1 y "reparador" M2. Los fagolisosomas de M1 pueden metabolizar la arginina en óxido nítrico altamente reactivo , mientras que M2 usa arginina para producir ornitina para promover la proliferación celular y la reparación de tejidos. [21]
Función
Degradación de patógenos
Los macrófagos y neutrófilos son fagocitos profesionales a cargo de la mayor parte de la degradación de patógenos, pero tienen diferentes métodos bactericidas. Los neutrófilos tienen gránulos que se fusionan con el fagosoma. Los gránulos contienen NADPH oxidasa y mieloperoxidasa , que producen derivados tóxicos de oxígeno y cloro para matar patógenos en una explosión oxidativa . También se liberan proteasas y péptidos antimicrobianos en el fagolisosoma. Los macrófagos carecen de gránulos y dependen más de la acidificación de los fagolisosomas, las glicosidasas y las proteasas para digerir los microbios. [20] Los fagosomas en las células dendríticas son menos ácidos y tienen una actividad hidrolítica mucho más débil, debido a una menor concentración de proteasas lisosomales e incluso a la presencia de inhibidores de proteasas.
Inflamación
La formación de fagosomas está ligada a la inflamación a través de moléculas de señalización comunes. La PI-3 quinasa y PLC están involucradas tanto en el mecanismo de internalización como en el desencadenamiento de la inflamación. [8] Las dos proteínas, junto con las Rho GTPasas, son componentes importantes de la respuesta inmune innata, que inducen la producción de citocinas y activan la cascada de señalización de la MAP quinasa . Se producen citocinas proinflamatorias que incluyen IL-1β , IL-6 , TNFα e IL-12 . [7]
El proceso está estrictamente regulado y la respuesta inflamatoria varía según el tipo de partícula dentro del fagosoma. Las células apoptóticas infectadas con patógenos desencadenarán la inflamación, pero las células dañadas que se degradan como parte del recambio tisular normal no lo hacen. La respuesta también difiere según la fagocitosis mediada por opsonina. Las reacciones mediadas por el receptor de manosa y FcR producen especies de oxígeno reactivas proinflamatorias y moléculas de ácido araquidónico , pero las reacciones mediadas por CR no dan como resultado esos productos. [7]
Presentación de antígeno
Las células dendríticas (CD) inmaduras pueden fagocitar, pero las CD maduras no pueden debido a cambios en Rho GTPasas involucradas en la remodelación del citoesqueleto. [20] Los fagosomas de las CD son menos hidrolíticos y ácidos que los de los macrófagos y neutrófilos, ya que las CD están involucradas principalmente en la presentación de antígenos más que en la degradación de patógenos. Necesitan retener fragmentos de proteínas de un tamaño adecuado para el reconocimiento bacteriano específico, por lo que los péptidos solo se degradan parcialmente. [20] Los péptidos de la bacteria se transportan al Complejo Mayor de Histocompatibilidad (MHC). Los antígenos peptídicos se presentan a los linfocitos , donde se unen a los receptores de las células T y activan las células T., reduciendo la brecha entre la inmunidad innata y adaptativa. [8] Esto es específico para mamíferos , aves y peces con mandíbulas, ya que los insectos no tienen inmunidad adaptativa. [22]
Nutritivo
Los organismos unicelulares antiguos, como las amebas, utilizan la fagocitosis como una forma de adquirir nutrientes, en lugar de una estrategia inmunitaria. Engullen a otros microbios más pequeños y los digieren dentro del fagosoma de alrededor de una bacteria por minuto, que es mucho más rápido que los fagocitos profesionales. [23] Para la ameba del suelo Dictyostelium discoideum , su principal fuente de alimento es la bacteria Legionella pneumophila , que causa la enfermedad del legionario en humanos. [24] La maduración de los fagosomas en las amebas es muy similar a la de los macrófagos, por lo que se utilizan como organismo modelo para estudiar el proceso. [15]
Aclaramiento de tejidos
Los fagosomas degradan las células senescentes y las células apoptóticas para mantener la homeostasis del tejido. Los eritrocitos tienen una de las tasas de recambio más altas del cuerpo y son fagocitados por macrófagos en el hígado y el bazo . En el embrión , el proceso de eliminación de células muertas no está bien caracterizado, pero no lo realizan macrófagos u otras células derivadas de células madre hematopoyéticas . [25] Sólo en el adulto las células apoptóticas son fagocitadas por fagocitos profesionales. La inflamación solo se desencadena por ciertos patrones moleculares asociados a patógenos o daños(PAMP o DAMP), la eliminación de células senescentes no es inflamatoria. [13]
Autofagosoma
Los autofagosomas se diferencian de los fagosomas en que se utilizan principalmente para degradar selectivamente los orgánulos citosólicos dañados, como las mitocondrias ( mitofagia ). Sin embargo, cuando la célula está muerta de hambre o estresada, los autofagosomas también pueden degradar orgánulos de forma no selectiva para proporcionar a la célula aminoácidos y otros nutrientes. [26] La autofagia no se limita a los fagocitos profesionales, fue descubierta por primera vez en hepatocitos de rata por el biólogo celular Christian de Duve . [27] Los autofagosomas tienen una doble membrana, la interna del orgánulo envuelto, y se especula que la membrana externa se forma a partir del retículo endoplásmico o delCompartimento intermedio ER-Golgi (ERGIC). [28] El autofagosoma también se fusiona con los lisosomas para degradar su contenido. Cuando M. tuberculosis inhibe la acidificación del fagosoma, el interferón gamma puede inducir la autofagia y rescatar el proceso de maduración. [29]
Evasión y manipulación bacteriana
Muchas bacterias han evolucionado para evadir las propiedades bactericidas de los fagosomas o incluso explotar la fagocitosis como estrategia de invasión.
- Mycobacterium tuberculosis se dirige a los macrófagos M2 en las partes inferiores de la vía respiratoria, que no producen ROS. [30] M. tuberculosis también puede manipular las vías de señalización secretando fosfatasas como PtpA y SapM, que interrumpen el reclutamiento de proteínas y bloquean la acidificación de los fagosomas. [7] [31]
- Legionella pneumophila puede remodelar la membrana del fagosoma para imitar vesículas en otras partes de la vía secretora, por lo que los lisosomas no reconocen el fagosoma y no se fusionan con él. La bacteria secreta toxinas que interfieren con el tráfico del huésped, por lo que la vacuola que contiene Legionella recluta proteínas de membrana que generalmente se encuentran en el retículo endoplásmico o ERGIC. [32] Esto redirige las vesículas secretoras al fagosoma modificado y entrega nutrientes a la bacteria.
- Listeria monocytogenes secreta una proteína formadora de poros, listeriolisina O, por lo que la bacteria puede escapar del fagosoma hacia el citosol. La listeriolisina es activada por el ambiente ácido del fagosoma. [33] Además, Listeria secreta dos enzimas fosfolipasa C que facilitan el escape del fagosoma.
Ver también
- Autofagosoma
- Fagocito
Referencias
- ^ Hackstadt T, Williams JC (mayo de 1981). "Estratagema bioquímica para el parasitismo obligado de células eucariotas por Coxiella burnetii" . Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 78 (5): 3240–4. doi : 10.1073 / pnas.78.5.3240 . PMC 319537 . PMID 6942430 .
- ^ Winkler HH (1990). "Especies de Rickettsia (como organismos)". Revisión anual de microbiología . 44 : 131-153. doi : 10.1146 / annurev.micro.44.1.131 . PMID 2252380 .
- ^ MacMicking JD, Taylor GA, McKinney JD (octubre de 2003). "Control inmunológico de la tuberculosis por LRG-47 inducible por IFN-gamma". Ciencia . 302 (5645): 654–9. Código Bibliográfico : 2003Sci ... 302..654M . doi : 10.1126 / science.1088063 . PMID 14576437 . S2CID 83944695 .
- ^ Vandal OH, Pierini LM, Schnappinger D, Nathan CF, Ehrt S (agosto de 2008). "Una proteína de membrana conserva el pH intrabacteriano en Mycobacterium tuberculosis intrafagosomal" . Medicina de la naturaleza . 14 (8): 849–54. doi : 10.1038 / nm.1795 . PMC 2538620 . PMID 18641659 .
- ^ Kuehnel MP, Goethe R, Habermann A, Mueller E, Rohde M, Griffiths G, Valentin-Weigand P (agosto de 2001). "Caracterización de la supervivencia intracelular de Mycobacterium avium ssp. Paratuberculosis: pH fagosómico y fusogenicidad en macrófagos J774 en comparación con otras micobacterias". Microbiología celular . 3 (8): 551–66. doi : 10.1046 / j.1462-5822.2001.00139.x . PMID 11488816 . S2CID 8962102 .
- ^ Tessema MZ, Koets AP, Rutten VP, Gruys E (noviembre de 2001). "¿Cómo resiste Mycobacterium avium subsp. Paratuberculosis la degradación intracelular?" . The Veterinary Quarterly . 23 (4): 153–62. doi : 10.1080 / 01652176.2001.9695105 . PMID 11765232 .
- ↑ a b c d e f g h Aderem A, Underhill DM (abril de 1999). "Mecanismos de fagocitosis en macrófagos". Revisión anual de inmunología . 17 (1): 593–623. doi : 10.1146 / annurev.immunol.17.1.593 . PMID 10358769 .
- ↑ a b c Aderem A (junio de 2003). "Fagocitosis y respuesta inflamatoria" . La Revista de Enfermedades Infecciosas . 187 Suppl 2 (s2): S340-5. doi : 10.1086 / 374747 . PMID 12792849 .
- ^ Dupuy AG, Caron E (junio de 2008). "Fagocitosis dependiente de integrina: pasando de la microadhesión a nuevos conceptos" . Revista de ciencia celular . 121 (11): 1773–83. doi : 10.1242 / jcs.018036 . PMID 18492791 .
- ^ Underhill DM, Ozinsky A (abril de 2002). "Fagocitosis de microbios: complejidad en acción". Revisión anual de inmunología . 20 (1): 825–52. doi : 10.1146 / annurev.immunol.20.103001.114744 . PMID 11861619 .
- ^ Kaplan G (agosto de 1977). "Diferencias en el modo de fagocitosis con receptores Fc y C3 en macrófagos". Revista escandinava de inmunología . 6 (8): 797–807. doi : 10.1111 / j.1365-3083.1977.tb02153.x . PMID 561436 . S2CID 25373560 .
- ^ Köhler H, Rodrigues SP, McCormick BA (marzo de 2002). "Interacciones de Shigella flexneri con el dominio de la membrana basolateral del epitelio intestinal modelo polarizado: papel del lipopolisacárido en la invasión celular y en la activación de la proteína quinasa ERK activada por mitógenos" . Infección e inmunidad . 70 (3): 1150–8. doi : 10.1128 / IAI.70.3.1150-1158.2002 . PMC 127798 . PMID 11854195 .
- ↑ a b Desjardins M, Houde M, Gagnon E (octubre de 2005). "Fagocitosis: el camino complicado de la nutrición a la inmunidad adaptativa". Revisiones inmunológicas . 207 (1): 158–65. doi : 10.1111 / j.0105-2896.2005.00319.x . PMID 16181334 . S2CID 30191200 .
- ↑ a b Desjardins M, Celis JE, van Meer G, Dieplinger H, Jahraus A, Griffiths G, Huber LA (diciembre de 1994). "Caracterización molecular de fagosomas" . La revista de química biológica . 269 (51): 32194–200. doi : 10.1016 / S0021-9258 (18) 31620-X . PMID 7798218 .
- ↑ a b Gotthardt D, Warnatz HJ, Henschel O, Brückert F, Schleicher M, Soldati T (octubre de 2002). "La disección de alta resolución de la maduración del fagosoma revela distintas fases de tráfico de membrana" . Biología molecular de la célula . 13 (10): 3508–20. doi : 10.1091 / mbc.E02-04-0206 . PMC 129962 . PMID 12388753 .
- ^ Keller S, Berghoff K, Kress H (diciembre de 2017). "El transporte fagosómico depende en gran medida del tamaño del fagosoma" . Informes científicos . 7 (1): 17068. Bibcode : 2017NatSR ... 717068K . doi : 10.1038 / s41598-017-17183-7 . PMC 5719076 . PMID 29213131 .
- ↑ de Chastellier C, Thilo L (septiembre de 1997). "Maduración del fagosoma y fusión con lisosomas en relación con la propiedad de la superficie y el tamaño de la partícula fagocítica". Revista europea de biología celular . 74 (1): 49–62. PMID 9309390 .
- ↑ a b Fairn GD, Grinstein S (agosto de 2012). "Cómo maduran los fagosomas nacientes para convertirse en fagolisosomas". Tendencias en inmunología . 33 (8): 397–405. doi : 10.1016 / j.it.2012.03.003 . PMID 22560866 .
- ^ Kinchen JM, Ravichandran KS (abril de 2010). "Identificación de dos genes conservados evolutivamente que regulan el procesamiento de células apoptóticas engullidas" . Naturaleza . 464 (7289): 778–82. Código bibliográfico : 2010Natur.464..778K . doi : 10.1038 / nature08853 . PMC 2901565 . PMID 20305638 .
- ↑ a b c d Savina A, Amigorena S (octubre de 2007). "Presentación de fagocitosis y antígeno en células dendríticas". Revisiones inmunológicas . 219 (1): 143–56. doi : 10.1111 / j.1600-065X.2007.00552.x . PMID 17850487 . S2CID 1267478 .
- ^ Mills CD (5 de mayo de 2015). "Anatomía de un descubrimiento: macrófagos m1 y m2" . Fronteras en inmunología . 6 : 212. doi : 10.3389 / fimmu.2015.00212 . PMC 4419847 . PMID 25999950 .
- ^ Warr GW (1997). "El sistema inmunológico adaptativo de los peces". Avances en estandarización biológica . 90 : 15-21. PMID 9270830 .
- ^ Cosson P, Soldati T (junio de 2008). "Come, mata o muere: cuando la ameba se encuentra con las bacterias". Opinión actual en microbiología . 11 (3): 271–6. doi : 10.1016 / j.mib.2008.05.005 . PMID 18550419 .
- ^ Solomon JM, Rupper A, Cardelli JA, Isberg RR (mayo de 2000). "Crecimiento intracelular de Legionella pneumophila en Dictyostelium discoideum, un sistema de análisis genético de interacciones huésped-patógeno" . Infección e inmunidad . 68 (5): 2939–47. doi : 10.1128 / iai.68.5.2939-2947.2000 . PMC 97507 . PMID 10768992 .
- ^ Lichanska AM, Hume DA (junio de 2000). "Orígenes y funciones de los fagocitos en el embrión" (PDF) . Hematología experimental . 28 (6): 601-11. doi : 10.1016 / s0301-472x (00) 00157-0 . hdl : 20.500.11820 / b865effa-680c-4f60-905e-ba9137f57613 . PMID 10880746 .
- ^ Ding WX, Yin XM (julio de 2012). "Mitofagia: mecanismos, roles fisiopatológicos y análisis" . Química biológica . 393 (7): 547–64. doi : 10.1515 / hsz-2012-0119 . PMC 3630798 . PMID 22944659 .
- ^ Castro-Obregón S (2010). "El descubrimiento de lisosomas y autofagia" . Educación en la naturaleza . 3 (9): 49.
- ^ Ge L, Schekman R (enero de 2014). "El compartimento intermedio ER-Golgi alimenta la membrana del fagophore" . Autofagia . 10 (1): 170–2. doi : 10.4161 / auto.26787 . PMC 4389871 . PMID 24220263 .
- ^ Gutierrez MG, Master SS, Singh SB, Taylor GA, Colombo MI, Deretic V (diciembre de 2004). "La autofagia es un mecanismo de defensa que inhibe la supervivencia de BCG y Mycobacterium tuberculosis en macrófagos infectados" . Celular . 119 (6): 753–66. doi : 10.1016 / j.cell.2004.11.038 . PMID 15607973 .
- ^ Cambier CJ, Takaki KK, Larson RP, Hernandez RE, Tobin DM, Urdahl KB, Cosma CL, Ramakrishnan L (enero de 2014). "Las micobacterias manipulan el reclutamiento de macrófagos mediante el uso coordinado de lípidos de membrana" . Naturaleza . 505 (7482): 218–22. doi : 10.1038 / nature12799 . PMC 3961847 . PMID 24336213 .
- ^ Wong D, Chao JD, Av-Gay Y (febrero de 2013). "Fosfatasas secretadas por Mycobacterium tuberculosis: de la patogénesis a los objetivos para el desarrollo de fármacos antituberculosos". Tendencias en microbiología . 21 (2): 100–9. doi : 10.1016 / j.tim.2012.09.002 . PMID 23084287 .
- ^ Roy CR, Kagan JC (1 de enero de 2013). Evasión de la fusión del lisosoma del fagosoma y establecimiento de un orgánulo replicativo por el patógeno intracelular Legionella pneumophila . Landes Bioscience.
- ^ Portnoy DA, Auerbuch V, Glomski IJ (agosto de 2002). "La biología celular de la infección por Listeria monocytogenes: la intersección de la patogénesis bacteriana y la inmunidad mediada por células" . The Journal of Cell Biology . 158 (3): 409-14. doi : 10.1083 / jcb.200205009 . PMC 2173830 . PMID 12163465 .
- Biología Celular
- Vesículas