Siglec
Las siglecs (lectinas de tipo inmunoglobulina que se unen al ácido siálico ) son proteínas de la superficie celular que se unen al ácido siálico . Se encuentran principalmente en la superficie de las células inmunitarias y son un subconjunto de las lectinas de tipo I. Hay 14 Siglecs de mamíferos diferentes, que proporcionan una serie de funciones diferentes basadas en las interacciones receptor-ligando de la superficie celular. [1]
El primer candidato Siglec descrito fue Sialoadhesin (Siglec-1 / CD169), una proteína de adhesión similar a lectina en macrófagos . [2] Estudios paralelos de Ajit Varki y sus colegas sobre el CD22 previamente clonado (una proteína de la superficie de la célula B involucrada en la adhesión y activación) mostraron evidencia directa del reconocimiento del ácido siálico. La clonación posterior de Sialoadhesin por Crocker reveló homología con CD22 (Siglec-2), CD33 (Siglec-3) y glicoproteína asociada a mielina.(MAG / Siglec-4), dando lugar a la propuesta de una familia de "Sialoadhesins". Varki luego sugirió el término Siglec como una mejor alternativa y como un subconjunto de lectinas de tipo I (tipo Ig) . Esta nomenclatura fue acordada y adoptada por casi todos los investigadores que trabajan con estas moléculas (por convención, los Siglecs siempre se escriben con mayúscula). Se han identificado varios Siglecs adicionales (Siglecs 5-12) en humanos que son muy similares en estructura a CD33 y por lo que se denominan colectivamente "Siglecs relacionados con CD33". [3] Se han identificado más Siglecs, incluidos Siglec-14 y Siglec-15. Los Siglecs se han caracterizado en dos grupos distintos: el primer grupo de mamíferos altamente conservado compuesto por Sialoadhesins, CD22, MAG y Siglec-15, y un segundo grupo que comprende Siglecs estrechamente relacionados con CD33. [4] Otros como Siglec-8 y Siglec-9 tienen homólogos en ratones y ratas (Siglec-F y Siglec-E respectivamente en ambos). Los seres humanos tienen una mayor cantidad de Siglecs que los ratones, por lo que el sistema de numeración se basó en las proteínas humanas. [5]
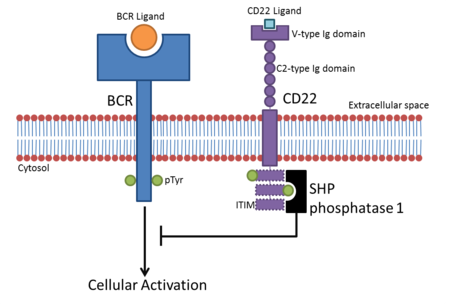
Los siglecs son proteínas transmembrana de tipo I en las que el terminal NH 3 + está en el espacio extracelular y el terminal COO - es citosólico . [6] Cada Siglec contiene un dominio de inmunoglobulina de tipo V N-terminal (dominio Ig) que actúa como receptor de unión para el ácido siálico. Estas lectinas se colocan en el grupo de lectinas de tipo I porque el dominio de lectina es un pliegue de inmunoglobulina. Todos los Siglecs se extienden desde la superficie celular mediante dominios Ig de tipo C2 que no tienen actividad de unión. Los Siglecs difieren en el número de estos dominios de tipo C2. [5]Como estas proteínas contienen dominios de Ig, son miembros de la superfamilia de inmunoglobulinas (IgSF).
La mayoría de Siglecs, como CD22 y la familia relacionada con CD33, contienen ITIM ( motivos inhibidores inmunorreceptores basados en tirosina ) en su región citosólica. [6] Estos actúan para regular a la baja las vías de señalización que involucran la fosforilación , como las inducidas por ITAM ( motivos de activación inmunorreceptores basados en tirosina ). [7] Sin embargo, algunos, como Siglec-14, contienen residuos de aminoácidos positivos que ayudan a acoplar proteínas adaptadoras que contienen ITAM, como DAP12. [1]