Silibinin
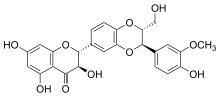 | |
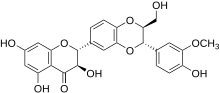 Estructuras de silibinina A y silibinina B | |
| Datos clinicos | |
|---|---|
| AHFS / Drugs.com | Nombres internacionales de medicamentos |
| Vías de administración | Oral e intravenoso |
| Código ATC | |
| Identificadores | |
| |
| Número CAS | |
| PubChem CID | |
| ChemSpider | |
| UNII | |
| KEGG | |
| CHEBI | |
| CHEMBL | |
| Tablero CompTox ( EPA ) | |
| Tarjeta de información ECHA | 100.041.168 |
| Datos químicos y físicos | |
| Fórmula | C 25 H 22 O 10 |
| Masa molar | 482,441 g · mol −1 |
| Modelo 3D ( JSmol ) | |
| |
| |
| | |
La silibinina ( DCI ), también conocida como silibina (ambos de Silybum , el nombre genérico de la planta de la que se extrae), es el principal componente activo de la silimarina , un extracto estandarizado de las semillas de cardo mariano , que contiene una mezcla de flavonolignanos que consiste en de silibinina, isosilibinin , silicristina , silidianin , y otros. La propia silibinina es una mezcla de dos diastereómeros , silibina A y silibina B, en una proporción aproximadamente equimolar. [1] La mezcla presenta una serie de efectos farmacológicos, particularmente en el hígado graso , hígado graso no alcohólico , la esteatohepatitis no alcohólica , y existe una gran evidencia clínica para el uso de silibinina como un elemento de apoyo en alcohólico y grado de Child-Pugh 'A ' cirrosis hepática . [2] Sin embargo, a pesar de sus varios efectos beneficiosos sobre el hígado, la silibinina y todos los demás compuestos que se encuentran en la silimarina, especialmente la silicristina, parecen actuar como potentes disruptores del sistema tiroideo al bloquear el transportador MCT8 . [3]La ingesta prolongada de silimarina puede provocar alguna forma de enfermedad de la tiroides y, si se toma durante el embarazo, la silimarina puede provocar el desarrollo del síndrome de Allan-Herndon-Dudley . [3] Aunque desafortunadamente esta información aún no está siendo tomada en consideración por todos los organismos reguladores, varios estudios ahora consideran que la silimarina y especialmente la silicristina son importantes inhibidores del transportador MCT8 y un potencial disruptor de las funciones de la hormona tiroidea. [3]
Farmacología
La escasa solubilidad en agua y la biodisponibilidad de la silimarina llevaron al desarrollo de formulaciones mejoradas. Silipide (nombre comercial Siliphos , que no debe confundirse con el compuesto de tratamiento de agua del mismo nombre, un polifosfato vítreo que contiene sodio, calcio, magnesio y silicato, formulado para el tratamiento de problemas de agua), un complejo de silimarina y fosfatidilcolina (lecitina ), es aproximadamente 10 veces más biodisponible que la silimarina. [4] Un estudio anterior había concluido que Siliphos tenía una biodisponibilidad 4,6 veces mayor. [5] [se necesita fuente no primaria ] También se ha informado que el complejo de inclusión de silimarina con β- ciclodextrinaes mucho más soluble que la propia silimarina. [6] También se han preparado glucósidos de silibina, que muestran una mejor solubilidad en agua y un efecto hepatoprotector aún más fuerte. [7]
Se ha demostrado que la silimarina, al igual que otros flavonoides , inhibe la salida celular mediada por la glicoproteína P. [8] La modulación de la actividad de la glicoproteína P puede resultar en una absorción y biodisponibilidad alterada de los fármacos que son sustratos de la glicoproteína P. Se ha informado que la silimarina inhibe las enzimas del citocromo P450 y no se puede excluir una interacción con fármacos eliminados principalmente por los P450. [9]
Toxicidad
Varios estudios han documentado los efectos potencialmente peligrosos de la mezcla de silimarina en el sistema tiroideo . Todos los compuestos de flavonolignanos que se encuentran en la mezcla de silimarina parecen bloquear la captación de hormonas tiroideas en las células bloqueando selectivamente el transportador transmembrana MCT8 . [3] Los autores de este estudio notaron que especialmente la silicristina , uno de los compuestos de la mezcla de silimarina, parece ser quizás el inhibidor más poderoso y selectivo del transportador MCT8 . [3]Debido al papel esencial que desempeña la hormona tiroidea en el metabolismo humano en general, se cree que la ingesta de silimarina puede provocar alteraciones del sistema tiroideo . [3] Debido a que se sabe que las hormonas tiroideas y el MCT8 también desempeñan un papel fundamental durante el desarrollo temprano y fetal, se cree que la administración de silimarina durante el embarazo es especialmente peligrosa, lo que puede conducir al síndrome de Allan-Herndon-Dudley , un trastorno del desarrollo cerebral que causa discapacidad intelectual de moderada a grave y problemas con el habla y el movimiento. [10]
Un ensayo clínico de fase I en humanos con cáncer de próstata diseñado para estudiar los efectos de la silibinina en dosis altas encontró que 13 gramos diarios son bien tolerados en pacientes con cáncer de próstata avanzado con toxicidad hepática asintomática ( hiperbilirrubinemia y elevación de la alanina aminotransferasa ) que es la más común. acontecimiento adverso. [11]
La silimarina también carece de potencial embriotóxico en modelos animales. [12] [13]
Usos médicos
La silibinina está disponible como fármaco (Legalon SIL (Madaus) (D, CH, A) y Silimarit (Bionorica), un producto de silimarina) en muchos países de la UE y se utiliza en el tratamiento del daño hepático tóxico (p. Ej., Tratamiento intravenoso en caso de muerte envenenamiento); como terapia adyuvante en hepatitis crónica y cirrosis. [ cita requerida ]
Para las preparaciones farmacológicas aprobadas y las aplicaciones parenterales en el tratamiento de la intoxicación por hongos Amanita , se utiliza la sal disódica de silibinina-C-2 ', 3-dihidrogenosuccinato soluble en agua. En 2011, el mismo compuesto también recibió la designación de producto medicinal huérfano para la prevención de la hepatitis C recurrente en receptores de trasplante de hígado por parte de la Comisión Europea. [14]
Usos médicos potenciales
La silibinina está bajo investigación para ver si puede tener un papel en el tratamiento del cáncer (por ejemplo, debido a su inhibición de la señalización STAT3 ). [15]
La silibinina también tiene varios mecanismos potenciales que podrían beneficiar a la piel. Estos incluyen efectos quimioprotectores de las toxinas ambientales, efectos antiinflamatorios, protección contra la fotocarcinogénesis inducida por los rayos UV, protección contra las quemaduras solares, protección contra la hiperplasia epidérmica inducida por los rayos UVB y reparación del ADN para el daño del ADN inducido por los rayos UV (roturas de doble hebra). [16] Los estudios en ratones demuestran una protección significativa en el comportamiento depresivo inducido por estrés leve e impredecible crónico (CUMS) en ratones [17] y una mayor cognición en ratas envejecidas como resultado del consumo de silimarina. [18]
Debido a sus propiedades inmunomoduladoras, [19] quelantes de hierro y antioxidantes, esta hierba tiene el potencial de ser utilizada en pacientes con beta-talasemia que reciben transfusiones de sangre con regularidad y sufren de sobrecarga de hierro. [20]
Biotecnología
La silimarina puede ser producido en callos y células suspensiones de Silybum marianum y sustituidos pyrazinecarboxamides se puede utilizar como abióticos elicitores de producción flavolignan. [21]
Biosíntesis
La biosíntesis de silibinina A y silibinina B se compone de dos partes principales, taxifolina y alcohol de coniferilo . [22] [23] El alcohol de coniferilo se sintetiza en la cubierta de la semilla del cardo mariano. Comenzando con la transformación de fenilalanina en ácido cinámico mediada por fenilalanina amoniaco liasa (PAL). [24] El ácido cinámico luego pasará por dos rondas de oxidación por trans-cinamato 4-monooxigenasa (C4H) y 4-cumarato 3-hidroxilasa (C3H) para dar ácido cafeico. El alcohol en posición meta está metilado por ácido cafeico 3- O-metiltransferasa para producir ácido ferúlico. A partir del ácido ferúlico, la producción de alcohol de coniferilo se lleva a cabo mediante 4-hidroxicinamato CoA ligasa (4CL), cinamoil CoA reductasa (CCR) y cinamil alcohol deshidrogenasa (CAD). Para la taxifolina, sus genes para la biosíntesis pueden sobreexpresarse en flor ya que la transcripción depende de la luz. La producción de taxifolina utiliza una ruta similar para sintetizar ácido p- cumarico seguido de tres veces el alargamiento de la cadena de carbono con malonil-CoA y la ciclación por la sintasa de calcona y la isomerasa de calcona para producir naringenina. A través de flavanona 3-hidroxilasa (F3H) y flavonoide 3'-monooxigenasa (F3'H), se proporciona taxifolina. Para fusionar taxifolina y alcohol de coniferilo, la taxifolina se puede trasladar de la flor a la cubierta de la semilla a través de symplastruta. Tanto la taxifolina como el alcohol de coniferilo serán oxidados por la ascorbato peroxidasa 1 (APX1) para permitir que la reacción de un solo electrón acople dos fragmentos que generan silibina (silibinina A + silibinina B).
Referencias
- ^ Davis-Searles P, Nakanishi Y, Nam-Cheol K, et al. (2005). "Cardo mariano y cáncer de próstata: efectos diferenciales de flavonolignanos puros de Silybum marianum en puntos finales antiproliferativos en células de carcinoma de próstata humano" (PDF) . Investigación del cáncer . 65 (10): 4448–57. doi : 10.1158 / 0008-5472.CAN-04-4662 . PMID 15899838 .
- ^ Saller R, Brignoli R, Melzer J, Meier R (2008). "Una revisión sistemática actualizada con metanálisis de la evidencia clínica de silimarina" . Forschende Komplementärmedizin . 15 (1): 9-20. doi : 10.1159 / 000113648 . PMID 18334810 . Consultado el 14 de diciembre de 2010 .
- ↑ a b c d e f Johannes J, Jayarama-Naidu R, Meyer F, Wirth EK, Schweizer U, Schomburg L, Köhrle J, Renko K (2016). "La silicristina, un flavonolignano derivado del cardo mariano, es un potente inhibidor del transportador de hormonas tiroideas MCT8" . Endocrinología . 157 (4): 1694–2301. doi : 10.1210 / en.2015-1933 . PMID 26910310 .
- ^ Kidd P, Jefe K (2005). "Una revisión de la biodisponibilidad y la eficacia clínica del fitosoma del cardo mariano: un complejo de silibina-fosfatidilcolina (Siliphos)" (PDF) . Revisión de medicina alternativa . 10 (3): 193-203. PMID 16164374 . Archivado desde el original (PDF) el 28 de julio de 2011 . Consultado el 14 de diciembre de 2010 .
- ^ Barzaghi N, Crema F, Gatti G, Pifferi G, Perucca E (1990). "Estudios farmacocinéticos sobre IdB 1016, un complejo de silibina-fosfatidilcolina, en sujetos humanos sanos". Eur J Drug Metab Pharmacokinet . 15 (4): 333–8. doi : 10.1007 / bf03190223 . PMID 2088770 .
- ^ Voinovich D, Perissutti B, Grassi M, Passerini N, Bigotto A (2009). "Activación mecanoquímica en estado sólido del extracto seco de Silybum marianum con betaciclodextrinas: Caracterización y biodisponibilidad de los sistemas coground". Revista de Ciencias Farmacéuticas . 98 (11): 4119–29. doi : 10.1002 / jps.21704 . PMID 19226635 .
- ^ Kosina P, Kren V, Gebhardt R, Grambal F, Ulrichová J, Walterová D (2002). "Propiedades antioxidantes de los glucósidos de silibina". Investigación en Fitoterapia . 16 Supl. 1: S33–9. doi : 10.1002 / ptr.796 . PMID 11933137 .
- ^ Zhou S, Lim LY, Chowbay B (2004). "Modulación a base de hierbas de la glicoproteína P". Reseñas de metabolismo de fármacos . 36 (1): 57-104. doi : 10.1081 / DMR-120028427 . PMID 15072439 .
- ^ Wu JW, Lin LC, Tsai TH (2009). "Interacciones fármaco-fármaco de silimarina en la perspectiva de la farmacocinética". Revista de Etnofarmacología . 121 (2): 185–93. doi : 10.1016 / j.jep.2008.10.036 . PMID 19041708 .
- ^ "Síndrome de Allan-Herndon-Dudley | Centro de información de enfermedades genéticas y raras (GARD) - un programa NCATS" . rarediseases.info.nih.gov . Consultado el 6 de mayo de 2021 .
- ^ Thomas W. Flaig; Daniel L. Gustafson; Lih-Jen Su; Joseph A. Zirrolli; Frances Crighton; Gail S. Harrison; A. Scott Pierson; Rajesh Agarwal; L. Michael Glodé (2007). "Un estudio de fase I y farmacocinética de silibina-fitosoma en pacientes con cáncer de próstata". Nuevos medicamentos en investigación . 25 (2): 139-146. doi : 10.1007 / s10637-006-9019-2 . PMID 17077998 .
- ^ Fraschini F, Demartini G, Esposti D (2002). "Farmacología de la silimarina" . Investigación clínica de fármacos . 22 (1): 51–65. doi : 10.2165 / 00044011-200222010-00007 . Archivado desde el original el 27 de octubre de 2012.
- ^ Hahn G, Lehmann HD, Kürten M, Uebel H, Vogel G (1968). "Sobre la farmacología y toxicología de la silimarina, un principio activo antihepatotóxico de Silybum marianum (L.) gaertn". Arzneimittelforschung . 18 (6): 698–704. PMID 5755807 .
- ^ Rottapharm | Madaus. Medios de comunicación Legalon® . Consultado el 6 de marzo de 2017.
- ^ Bosch-Barrera, Joaquim; Sais, Elia; Cañete, Noemí; Marruecos, Jordi; Cuyàs, Elisabet; Izquierdo, Ángel; Porta, Rut; Haro, Manel; Brunet, Joan; Pedraza, Salvador; Menéndez, Javier A. (2016). "Respuesta de la metástasis cerebral de pacientes con cáncer de pulmón a un producto nutracéutico oral que contiene silibinina" . Oncotarget . 7 (22): 32006–32014. doi : 10.18632 / oncotarget.7900 . PMC 5077992 . PMID 26959886 .
- ^ Singh, Rana P .; Agarwal, Rajesh (septiembre de 2009). "Cosmecéuticos y silibinina" . Clínicas en Dermatología . 27 (5): 479–484. doi : 10.1016 / j.clindermatol.2009.05.012 . PMC 2767273 . PMID 19695480 .
- ↑ Thakare, Vishnu N; Patil, Rajesh R; Oswal, Rajesh J; Dhakane, Valmik D; Aswar, Manoj K; Patel, Bhoomika M (febrero de 2018). "El potencial terapéutico de la silimarina en el comportamiento depresivo inducido por estrés leve e impredecible crónico en ratones". Revista de psicofarmacología . 32 (2): 223–235. doi : 10.1177 / 0269881117742666 . ISSN 0269-8811 . PMID 29215318 .
- ↑ Sarubbo, F .; Ramis, MR; Kienzer, C .; Aparicio, S .; Esteban, S .; Miralles, A .; Moranta, D. (marzo de 2018). "Los tratamientos crónicos de silimarina, quercetina y naringenina aumentan la síntesis de monoaminas y los niveles de hipocampo Sirt1 mejorando la cognición en ratas envejecidas". Revista de farmacología neuroinmune . 13 (1): 24–38. doi : 10.1007 / s11481-017-9759-0 . ISSN 1557-1890 . PMID 28808887 .
- ^ Balouchi, Sima; Gharagozloo, Marjan; Esmaeil, Nafiseh; Mirmoghtadaei, Milad; Moayedi, Behjat (1 de agosto de 2014). "Niveles séricos de citocinas TGFβ, IL-10, IL-17 e IL-23 en pacientes mayores de β-talasemia: el impacto de la terapia con silimarina". Inmunofarmacología e inmunotoxicología . 36 (4): 271-274. doi : 10.3109 / 08923973.2014.926916 . ISSN 0892-3973 . PMID 24945737 .
- ^ Esfahani, Behjat Al-Sadat Moayedi; Reisi, Nahid; Mirmoghtadaei, Milad (4 de marzo de 2015). "Evaluación de la seguridad y eficacia de la silimarina en pacientes con β-talasemia: una revisión". La hemoglobina . 39 (2): 75–80. doi : 10.3109 / 03630269.2014.1003224 . ISSN 0363-0269 . PMID 25643967 .
- ↑ Tůmová L, Tůma J, Megušar K, Doleža M (2010). "Pirazinecarboxamidas sustituidas como inductores abióticos de la producción de flavolignanos en cultivos de Silybum marianum (L.) Gaertn in Vitro" . Moléculas . 15 (1): 331–340. doi : 10,3390 / moléculas15010331 . PMC 6256978 . PMID 20110894 .
- ^ Lv, Yongkun; Gao, Song; Xu, Sha; Du, Guocheng; Zhou, Jingwen; Chen, Jian (11 de noviembre de 2017). "Organización espacial de la biosíntesis de silibina en el cardo mariano [Silybum marianum (L.) Gaertn]" . The Plant Journal . 92 (6): 995–1004. doi : 10.1111 / tpj.13736 . ISSN 0960-7412 . PMID 28990236 .
- ^ Prasad, Ram Raj; Paudel, Sandeep; Raina, Komal; Agarwal, Rajesh (mayo de 2020). "Cánceres de piel de silibinina y no melanoma" . Revista de Medicina Tradicional y Complementaria . 10 (3): 236–244. doi : 10.1016 / j.jtcme.2020.02.003 . ISSN 2225-4110 . PMC 7340873 . PMID 32670818 .
- ^ Barros, Jaime; Escamilla-Treviño, Luis; Song, Luhua; Rao, Xiaolan; Serrani-Yarce, Juan Carlos; Palacios, Maite Docampo; Engle, Nancy; Choudhury, Feroza K .; Tschaplinski, Timothy J .; Venables, Barney J .; Mittler, Ron (30 de abril de 2019). "La 4-cumarato 3-hidroxilasa en la vía de biosíntesis de la lignina es una peroxidasa de ascorbato citosólica" . Comunicaciones de la naturaleza . 10 (1): 1994. Bibcode : 2019NatCo..10.1994B . doi : 10.1038 / s41467-019-10082-7 . ISSN 2041-1723 . PMC 6491607 . PMID 31040279 .
enlaces externos
- Revisión de la calidad de la evidencia para el uso del cardo mariano de MayoClinic.com
- Morazzoni P, Bombardelli E (1994). " Silybum marianum (cardus marianus)". Fitoterapia . 66 : 3-42.
- Saller R, Meier R, Brignoli R (2001). "El uso de silimarina en el tratamiento de enfermedades hepáticas". Drogas . 61 (14): 2035–63. doi : 10.2165 / 00003495-200161140-00003 . PMID 11735632 .
- Silimarina en los encabezamientos de materias médicas (MeSH) de la Biblioteca Nacional de Medicina de EE. UU .
- Antídotos
- Flavonolignanos
- Resorcinoles
- 3-hidroxipropenales
- Benzodioxanos