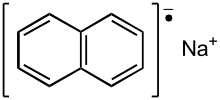
Naftaleno de sodio
 | |
| Nombres | |
|---|---|
| Nombre IUPAC preferido Naftalenuro de sodio | |
| Nombre IUPAC sistemático Naftalen-1-ide de sodio | |
| Otros nombres naftalenuro de sodio, naftaluro de sodio | |
| Identificadores | |
| |
Modelo 3D ( JSmol ) | |
| ChemSpider | |
| Tarjeta de información ECHA | 100.020.420 |
| Número CE |
|
PubChem CID | |
Tablero CompTox ( EPA ) | |
| |
| |
| Propiedades | |
| C 10 H 8 Na | |
| Masa molar | 151,164 g · mol −1 |
| Compuestos relacionados | |
Otros aniones | Naftaleno de litio |
Salvo que se indique lo contrario, los datos se proporcionan para materiales en su estado estándar (a 25 ° C [77 ° F], 100 kPa). | |
| Referencias de Infobox | |
El naftaleno de sodio es una sal orgánica con la fórmula química Na + C 10 H 8 - . En el laboratorio de investigación, se utiliza como reductor en la síntesis de química orgánica, organometálica e inorgánica. Suele generarse in situ. Cuando se aísla, invariablemente cristaliza como un solvato con ligandos unidos a Na + . [1]
Preparación y propiedades
Las sales de naftaleno de metal alcalino se preparan agitando el metal con naftaleno en un disolvente etéreo , normalmente como tetrahidrofurano o dimetoxietano . La sal resultante es de color verde oscuro. [2] [3] [4] El anión es un radical, dando una señal EPR fuerte cerca de g = 2.0. Su color verde intenso surge de absorciones centradas en 463, 735 nm.
Varios solvatos de naftalenuro sódico se han caracterizado por cristalografía de rayos X . Los efectos son sutiles, el par exterior de enlaces CH-CH se contrae a las 3 pm y los otros nueve enlaces CC se alargan a las 2-3 pm. Neto: la reducción debilita la vinculación. [5] [6]
Reacciones
- Redox
Con un potencial de reducción cercano a -2,5 V frente a NHE , el anión del radical naftaleno es un agente reductor fuerte. [1]
- Protonación
El anión es fuertemente básico y una vía de degradación típica implica la reacción con agua y fuentes próticas relacionadas, como los alcoholes. Estas reacciones producen dihidronaftaleno :
- 2 NaC 10 H 8 + 2 H 2 O → C 10 H 10 + C 10 H 8 + 2 NaOH
- Como ligando
Las sales de metales alcalinos del anión radical naftaleno se utilizan para preparar complejos de naftaleno. [7]
Reactivos relacionados
Referencias
- ^ a b Connelly, Neil G .; Geiger, William E. (1996). "Agentes químicos redox para la química organometálica". Revisiones químicas . 96 (2): 877–910. doi : 10.1021 / cr940053x . PMID 11848774 .
- ^ Corey, EJ y Gross, Andrew W. (1987). " terc- butil- terc- octilamina". Org. Síntesis . 65 : 166. doi : 10.15227 / orgsyn.065.0166 .
- ^ Algodón, F. Albert ; Wilkinson, Geoffrey (1988), Advanced Inorgic Chemistry (5ª ed.), Nueva York: Wiley-Interscience, p. 139, ISBN 0-471-84997-9
- ^ Greenwood, Norman N .; Earnshaw, Alan (1984). Química de los elementos . Oxford: Pergamon Press . pag. 111. ISBN 978-0-08-022057-4.
- ^ Bock, Hans; Arad, Claudia; Näther, cristiano; Havlas, Zdenek (1995). "Las estructuras de aniones radicales de naftaleno y antraceno separados por disolvente". J. Chem. Soc., Chem. Comun. (23): 2393–2394. doi : 10.1039 / C39950002393 .
- ↑ Castillo, Maximiliano; Metta-Magaña, Alejandro J .; Fortier, Skye (2016). "Aislamiento de arenuros de metales alcalinos cuantificables gravimétricamente utilizando 18-Crown-6". Nueva Revista de Química . 40 (3): 1923-1926. doi : 10.1039 / C5NJ02841H .
- ^ Ellis, John E. (2019). "La reacción de Chatt: rutas convencionales a arenemetalatos homolépticos de elementos d-Block". Transacciones de Dalton . 48 (26): 9538–9563. doi : 10.1039 / C8DT05029E . PMID 30724934 .
- Compuestos de sodio
- Agentes reductores de un electrón
- Compuestos organosódicos
- Radicales libres
