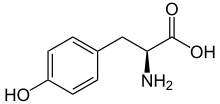
 Fórmula esquelética de L- tirosina | |||
 L- tirosina a pH fisiológico | |||
| Nombres | |||
|---|---|---|---|
| Nombre IUPAC ( S ) -Tirosina | |||
| Otros nombres Ácido L -2-amino-3- (4-hidroxifenil) propanoico | |||
| Identificadores | |||
| |||
Modelo 3D ( JSmol ) | |||
| CHEBI | |||
| CHEMBL | |||
| ChemSpider | |||
| DrugBank | |||
| Tarjeta de información ECHA | 100.000.419 | ||
PubChem CID | |||
| UNII | |||
Tablero CompTox ( EPA ) | |||
| |||
| Propiedades | |||
| C 9 H 11 N O 3 | |||
| Masa molar | 181,191 g · mol −1 | ||
| .0453 g / 100 mL | |||
| -105,3 · 10 −6 cm 3 / mol | |||
| Peligros | |||
| Ficha de datos de seguridad | Ver: página de datos | ||
| NFPA 704 (diamante de fuego) | |||
| Página de datos complementarios | |||
Estructura y propiedades | Índice de refracción ( n ), constante dieléctrica (ε r ), etc. | ||
Datos termodinámicos | Comportamiento de fase sólido-líquido-gas | ||
Datos espectrales | UV , IR , RMN , MS | ||
Salvo que se indique lo contrario, los datos se proporcionan para materiales en su estado estándar (a 25 ° C [77 ° F], 100 kPa). | |||
| Referencias de Infobox | |||
La L - tirosina o tirosina (símbolo Tyr o Y ) [2] o 4-hidroxifenilalanina es uno de los 20 aminoácidos estándarque utilizan las células para sintetizar proteínas . Es un aminoácido no esencial con un grupo lateral polar . La palabra "tirosina" proviene del griego tyrós , que significa queso , ya que fue descubierto por primera vez en 1846 por el químico alemán Justus von Liebig en la proteína caseína del queso. [3] [4] Se llamatirosilo cuando se denomina grupo funcional o cadena lateral. Si bien la tirosina generalmente se clasifica como un aminoácido hidrófobo , es más hidrófila que la fenilalanina . [5] Está codificado por los codones UAC y UAU en el ARN mensajero .
Funciones [ editar ]
Además de ser un aminoácido proteinogénico , la tirosina tiene un papel especial en virtud de la funcionalidad fenólica . Ocurre en proteínas que forman parte de los procesos de transducción de señales y funciona como receptor de grupos fosfato que se transfieren a través de las proteínas quinasas . La fosforilación del grupo hidroxilo puede cambiar la actividad de la proteína diana o puede formar parte de una cascada de señalización a través de la unión del dominio SH2.
Un residuo de tirosina también juega un papel importante en la fotosíntesis . En los cloroplastos ( fotosistema II ), actúa como donante de electrones en la reducción de la clorofila oxidada . En este proceso, pierde el átomo de hidrógeno de su grupo OH fenólico. Este radical es posteriormente reducido en el fotosistema II por los cuatro núcleos de manganeso.
Fuentes y requisitos dietéticos [ editar ]
La ingesta dietética de referencia (cantidad diaria recomendada, RDA) de fenilalanina y tirosina es de 42 mg por kilogramo de peso corporal. [6] Para una persona de 70 kg, esto es 2,31 g (fenilalanina + tirosina).
La tirosina, que también se puede sintetizar en el cuerpo a partir de la fenilalanina , se encuentra en muchos productos alimenticios ricos en proteínas como pollo , pavo , pescado , leche , yogur , requesón , queso , maní , almendras , semillas de calabaza , semillas de sésamo , soja. productos y habas , pero también en aguacates y plátanos . [7] Por ejemplo, la clara de un huevo tiene alrededor de 250 mg por huevo, [8]mientras que la carne de res magra / cordero / cerdo / salmón / pollo / pavo contiene aproximadamente 1 g por porción de 3 onzas (85 g). [8]
Biosíntesis [ editar ]
En las plantas y la mayoría de los microorganismos, tyr se produce a través del prefenato , un intermedio de la vía del shikimato . El prefenato se descarboxila oxidativamente con retención del grupo hidroxilo para dar p -hidroxifenilpiruvato, que se transamina usando glutamato como fuente de nitrógeno para dar tirosina y α-cetoglutarato .
Los mamíferos sintetizan tirosina a partir del aminoácido esencial fenilalanina ( phe ), que se deriva de los alimentos. La conversión de phe en tyr es catalizada por la enzima fenilalanina hidroxilasa , una monooxigenasa. Esta enzima cataliza la reacción provocando la adición de un grupo hidroxilo al final del anillo aromático de 6 carbonos de la fenilalanina , de modo que se convierte en tirosina.
Metabolismo [ editar ]
Fosforilación y sulfatación [ editar ]
Algunos de los residuos de tirosina se pueden marcar (en el grupo hidroxilo) con un grupo fosfato ( fosforilado ) por las proteínas quinasas . En su forma fosforilada, la tirosina se llama fosfotirosina . Se considera que la fosforilación de tirosina es uno de los pasos clave en la transducción de señales y la regulación de la actividad enzimática. La fosfotirosina se puede detectar mediante anticuerpos específicos . Los residuos de tirosina también pueden modificarse mediante la adición de un grupo sulfato, un proceso conocido como sulfatación de tirosina . [9] Sulfatación de tirosinaes catalizada por la tirosilproteína sulfotransferasa (TPST). Al igual que los anticuerpos de fosfotirosina mencionados anteriormente, se han descrito recientemente anticuerpos que detectan específicamente la sulfotirosina. [10]
Precursor de neurotransmisores y hormonas [ editar ]
En las células dopaminérgicas del cerebro , la tirosina se convierte en L-DOPA por la enzima tirosina hidroxilasa (TH). TH es la enzima limitante de la velocidad involucrada en la síntesis del neurotransmisor dopamina . Luego, la dopamina se puede convertir en otras catecolaminas , como norepinefrina (noradrenalina) y epinefrina (adrenalina).
Las hormonas tiroideas triyodotironina (T 3 ) y tiroxina (T 4 ) en el coloide de la tiroides también se derivan de la tirosina.
Vías biosintéticas de catecolaminas y aminas traza en el cerebro humano [11] [12] [13] |
Precursor de alcaloides [ editar ]
Se ha demostrado que el látex de Papaver somniferum , la adormidera, convierte la tirosina en el alcaloide morfina y se ha establecido la vía biosintética de la tirosina a la morfina mediante el uso de tirosina radiomarcada con carbono 14 para rastrear la ruta sintética in vivo. . [ cita requerida ]
Precursor de los fenoles naturales [ editar ]
La tirosina amoniacal liasa (TAL) es una enzima en la vía de biosíntesis natural de fenoles. Transforma la L-tirosina en ácido p-cumárico .
Precursor de los pigmentos [ editar ]
La tirosina también es el precursor del pigmento melanina .
Papel en la síntesis de coenzima Q10 [ editar ]
La tirosina (o su precursora fenilalanina) es necesaria para sintetizar la estructura de benzoquinona que forma parte de la coenzima Q10 .
Degradación [ editar ]
La descomposición de L-tirosina (sin. Para- hidroxifenilalanina) comienza con una transaminación dependiente de α-cetoglutarato a través de la tirosina transaminasa a para- hidroxifenilpiruvato . La descripción posicional para , abreviada p , significa que el grupo hidroxilo y la cadena lateral del anillo de fenilo están uno frente al otro (consulte la ilustración a continuación).
El siguiente paso de oxidación cataliza por p dioxigenasa -hidroxifenilpiruvato y disociación de CO 2 homogentisato (2,5-dihidroxifenil-1-etilo). [14] Para dividir el anillo aromático del homogentisato, se requiere otra dioxigenasa, el homogentisato 1,2-dioxigenasa . De ese modo, mediante la incorporación de una molécula de O 2 adicional , se crea acetoacetato de maleo .
El acetoacetato de fumarilo es creado por malilacetoacetato cis - trans - isomerasa a través de la rotación del grupo carboxilo creado a partir del grupo hidroxilo por oxidación. Esta cis-trans -isomerasa contiene glutatión como coenzima . El fumarylacetoacetate es finalmente dividido por la enzima fumarylacetoacetate hidrolasa mediante la adición de una molécula de agua.
De este modo se liberan fumarato (también un metabolito del ciclo del ácido cítrico) y acetoacetato (3-cetobutiroato). El acetoacetato es un cuerpo cetónico que se activa con succinil-CoA y, posteriormente, se puede convertir en acetil-CoA , que a su vez puede oxidarse mediante el ciclo del ácido cítrico o utilizarse para la síntesis de ácidos grasos .
El ácido floreético también es un metabolito urinario de la tirosina en ratas. [15]
Orto- y meta-tirosina [ editar ]
Se conocen tres isómeros estructurales de L-tirosina. Además del aminoácido común L-tirosina, que es el isómero para ( para -tyr, p -tyr o 4-hidroxifenilalanina), existen dos regioisómeros adicionales, a saber, meta- tirosina (también conocida como 3-hidroxifenilalanina , L- m tirosina , y m Tyr) y orto tirosina ( o Tyr o 2-hidroxifenilalanina), que se producen en la naturaleza. Los isómeros m -tyr y o -tyr, que son raros, surgen a través de radicales libres no enzimáticos.hidroxilación de fenilalanina en condiciones de estrés oxidativo . [16] [17]
La m-tirosina y sus análogos (raros en la naturaleza pero disponibles sintéticamente) han mostrado aplicación en la enfermedad de Parkinson , la enfermedad de Alzheimer y la artritis . [18]
Uso médico [ editar ]
La tirosina es un precursor de los neurotransmisores y aumenta los niveles plasmáticos de neurotransmisores (en particular, dopamina y norepinefrina), [19] pero tiene poco o ningún efecto sobre el estado de ánimo en sujetos normales. [20] [21] [22] Sin embargo, varios estudios han encontrado que la tirosina es útil en condiciones de estrés, frío, fatiga (en ratones), [23] trabajo prolongado y falta de sueño, [24] [25] con reducciones en los niveles de la hormona del estrés, [26] reducciones en la pérdida de peso inducida por el estrés observada en ensayos con animales, [23] y mejoras en el rendimiento cognitivo y físico [21] [27] [28] visto en ensayos humanos.
La tirosina no parece tener ningún efecto significativo sobre el rendimiento cognitivo o físico en circunstancias normales, [29] [30] pero ayuda a mantener mejor la memoria de trabajo durante la multitarea. [31]
Síntesis industrial [ editar ]
La L-tirosina y sus derivados ( L-DOPA , melanina , fenilpropanoides y otros) se utilizan en productos farmacéuticos , suplementos dietéticos y aditivos alimentarios . Anteriormente se usaban dos métodos para fabricar L-tirosina. El primero implica la extracción del aminoácido deseado de los hidrolizados de proteínas utilizando un enfoque químico. El segundo utiliza la síntesis enzimática de fenólicos, piruvato y amoníaco mediante el uso de tirosina fenol liasa . [32] Avances en ingeniería genética y el advenimiento de la fermentación industrial.han cambiado la síntesis de L-tirosina al uso de cepas modificadas de E. coli . [33] [34]
Ver también [ editar ]
- Albinismo
- Alcaptonuria
- Betalaína
- Derivados de tirosina yodada
- Reacción de Pauly
- Tiramina
- Sulfatación de tirosina
- Tirosinemia
Referencias [ editar ]
- ↑ a b Frey MN, Koetzle TF, Lehmann MS, Hamilton WC (1973). "Determinación de la estructura de difracción de neutrones de precisión de componentes de proteínas y ácidos nucleicos. X. Una comparación entre las estructuras cristalinas y moleculares de la L-tirosina y el clorhidrato de L-tirosina". J. Chem. Phys. 58 (6): 2547-2556. Código Bibliográfico : 1973JChPh..58.2547F . doi : 10.1063 / 1.1679537 .
- ^ "Nomenclatura y simbolismo de aminoácidos y péptidos" . Comisión Conjunta IUPAC-IUB sobre Nomenclatura Bioquímica. 1983. Archivado desde el original el 9 de octubre de 2008 . Consultado el 5 de marzo de 2018 .
- ^ "Tirosina" . The Columbia Electronic Encyclopedia, 6ª ed . Infoplease.com - Prensa de la Universidad de Columbia. 2007 . Consultado el 20 de abril de 2008 .
- ^ Harper D (2001). "Tirosina" . Diccionario de etimología en línea . Consultado el 20 de abril de 2008 .
- ^ "Aminoácidos - tirosina" . www.biology.arizona.edu . Consultado el 31 de enero de 2018 .
- ^ Pencharz PB, Hsu JW, Ball RO (junio de 2007). "Requerimientos de aminoácidos aromáticos en sujetos humanos sanos" . La Revista de Nutrición . 137 (6 Suppl 1): 1576S – 1578S, discusión 1597S-1598S. doi : 10.1093 / jn / 137.6.1576S . PMID 17513429 .
- ^ "Tirosina" . Centro Médico de la Universidad de Maryland . Consultado el 17 de marzo de 2011 .
- ^ a b Los 10 alimentos más ricos en tirosina
- ^ Hoffhines AJ, Damoc E, Bridges KG, Leary JA, Moore KL (diciembre de 2006). "Detección y purificación de proteínas sulfatadas con tirosina utilizando un nuevo anticuerpo monoclonal anti-sulfotirosina" . La Revista de Química Biológica . 281 (49): 37877–87. doi : 10.1074 / jbc.M609398200 . PMC 1764208 . PMID 17046811 .
- ^ Kanan Y, Hamilton RA, Sherry DM, Al-Ubaidi MR (diciembre de 2012). "Centrarse en moléculas: sulfotirosina" . Investigación ocular experimental . 105 : 85–6. doi : 10.1016 / j.exer.2012.02.014 . PMC 3629733 . PMID 22406006 .
- ^ Broadley KJ (marzo de 2010). "Los efectos vasculares de las trazas de aminas y anfetaminas". Farmacología y terapéutica . 125 (3): 363–375. doi : 10.1016 / j.pharmthera.2009.11.005 . PMID 19948186 .
- ^ Lindemann L, Hoener MC (mayo de 2005). "Un renacimiento en trazas de aminas inspirado en una nueva familia GPCR". Tendencias en Ciencias Farmacológicas . 26 (5): 274–281. doi : 10.1016 / j.tips.2005.03.007 . PMID 15860375 .
- ^ Wang X, Li J, Dong G, Yue J (febrero de 2014). "Los sustratos endógenos del cerebro CYP2D". Revista europea de farmacología . 724 : 211–218. doi : 10.1016 / j.ejphar.2013.12.025 . PMID 24374199 .
- ^ Zea-Rey AV, Cruz-Camino H, Vazquez-Cantu DL, Gutiérrez-García VM, Santos-Guzmán J, Cantú-Reyna C (27 de noviembre de 2017). "La incidencia de tirosinemia neonatal transitoria en una población mexicana" . Revista de errores innatos del metabolismo y detección . 5 : 232640981774423. doi : 10.1177 / 2326409817744230 .
- ^ Stand AN, Masri MS, Robbins DJ, Emerson OH, Jones FT, DeEds F (1960). "Metabolismos urinarios del ácido fenólico de la tirosina" . Revista de Química Biológica . 235 (9): 2649–2652. doi : 10.1016 / S0021-9258 (19) 76930-0 .
- ^ Molnár GA, Wagner Z, Markó L, Kó Szegi T, Mohás M, Kocsis B, et al. (Noviembre de 2005). "Excreción urinaria de orto-tirosina en diabetes mellitus e insuficiencia renal: evidencia de producción de radicales hidroxilo". Kidney International . 68 (5): 2281–7. doi : 10.1111 / j.1523-1755.2005.00687.x . PMID 16221230 .
- ^ Molnár GA, Nemes V, Biró Z, Ludány A, Wagner Z, Wittmann I (diciembre de 2005). "La acumulación de los marcadores de radicales libres hidroxilo meta-, orto-tirosina y DOPA en lentes con cataratas se acompaña de un menor contenido de proteínas y fenilalanina de la fase soluble en agua". Investigación de radicales libres . 39 (12): 1359–66. doi : 10.1080 / 10715760500307107 . PMID 16298866 . S2CID 31154432 .
- ^ Humphrey CE, Furegati M, Laumen K, La Vecchia L, Leutert T, Müller-Hartwieg JC, Vögtle M (2007). "Síntesis optimizada de Lm-tirosina adecuada para escalado químico". Investigación y desarrollo de procesos orgánicos . 11 (6): 1069–1075. doi : 10.1021 / op700093y .
- ^ Rasmussen DD, Ishizuka B, Quigley ME, Yen SS (octubre de 1983). "Efectos de la ingestión de tirosina y triptófano sobre las concentraciones plasmáticas de catecolaminas y ácido 3,4-dihidroxifenilacético". La Revista de Endocrinología Clínica y Metabolismo . 57 (4): 760–3. doi : 10.1210 / jcem-57-4-760 . PMID 6885965 .
- ^ Policía de Leathwood, Pollet P (1982). "Cambios de humor inducidos por la dieta en poblaciones normales". Revista de Investigación Psiquiátrica . 17 (2): 147–54. doi : 10.1016 / 0022-3956 (82) 90016-4 . PMID 6764931 .
- ↑ a b Deijen JB, Orlebeke JF (1994). "Efecto de la tirosina sobre la función cognitiva y la presión arterial bajo estrés". Boletín de investigación del cerebro . 33 (3): 319-23. doi : 10.1016 / 0361-9230 (94) 90200-3 . PMID 8293316 . S2CID 33823121 .
- ^ Lieberman HR, Corkin S, Spring BJ, Wurtman RJ, Growdon JH (agosto de 1985). "Los efectos de los precursores de neurotransmisores dietéticos en el comportamiento humano". La Revista Estadounidense de Nutrición Clínica . 42 (2): 366–70. doi : 10.1093 / ajcn / 42.2.366 . PMID 4025206 .
- ^ a b Hao S, Avraham Y, Bonne O, Berry EM (febrero de 2001). "Pérdida de peso corporal inducida por separación, deterioro en el comportamiento de alternancia y tono autónomo: efectos de la tirosina". Farmacología, bioquímica y comportamiento . 68 (2): 273–81. doi : 10.1016 / S0091-3057 (00) 00448-2 . PMID 11267632 . S2CID 46405659 .
- ^ Magill RA, Waters WF, Bray GA, Volaufova J, Smith SR, Lieberman HR, et al. (Agosto de 2003). "Efectos de la tirosina, fentermina, cafeína D-anfetamina y placebo sobre los déficits de rendimiento cognitivo y motor durante la privación del sueño". Neurociencia nutricional . 6 (4): 237–46. doi : 10.1080 / 1028415031000120552 . PMID 12887140 . S2CID 21300076 .
- ^ Neri DF, Wiegmann D, Stanny RR, Shappell SA, McCardie A, McKay DL (abril de 1995). "Los efectos de la tirosina sobre el rendimiento cognitivo durante la vigilia prolongada". Medicina de la aviación, el espacio y el medio ambiente . 66 (4): 313–9. PMID 7794222 .
- ^ Reinstein DK, Lehnert H, Wurtman RJ (diciembre de 1985). "La tirosina dietética suprime el aumento de la corticosterona plasmática tras el estrés agudo en ratas". Ciencias de la vida . 37 (23): 2157–63. doi : 10.1016 / 0024-3205 (85) 90566-1 . PMID 4068899 .
- ^ Deijen JB, Wientjes CJ, Vullinghs HF, Cloin PA, Langefeld JJ (enero de 1999). "La tirosina mejora el rendimiento cognitivo y reduce la presión arterial en los cadetes después de una semana de un curso de entrenamiento de combate". Boletín de investigación del cerebro . 48 (2): 203–9. doi : 10.1016 / S0361-9230 (98) 00163-4 . PMID 10230711 . S2CID 27927524 .
- ^ Mahoney CR, Castellani J, Kramer FM, Young A, Lieberman HR (noviembre de 2007). "La suplementación con tirosina mitiga las disminuciones de la memoria de trabajo durante la exposición al frío" . Fisiología y comportamiento . 92 (4): 575–82. doi : 10.1016 / j.physbeh.2007.05.003 . PMID 17585971 . S2CID 207372821 .
- ^ Chinevere TD, Sawyer RD, Creer AR, Conlee RK, Parcell AC (noviembre de 2002). "Efectos de la ingestión de carbohidratos y L-tirosina sobre el rendimiento del ejercicio de resistencia". Revista de fisiología aplicada . 93 (5): 1590–7. doi : 10.1152 / japplphysiol.00625.2001 . PMID 12381742 .
- ^ Strüder HK, Hollmann W, Platen P, Donike M, Gotzmann A, Weber K (abril de 1998). "Influencia de la paroxetina, los aminoácidos de cadena ramificada y la tirosina en las respuestas del sistema neuroendocrino y la fatiga en los seres humanos". Investigación hormonal y metabólica . 30 (4): 188–94. doi : 10.1055 / s-2007-978864 . PMID 9623632 .
- ^ Thomas JR, Lockwood PA, Singh A, Deuster PA (noviembre de 1999). "La tirosina mejora la memoria de trabajo en un entorno multitarea". Farmacología, bioquímica y comportamiento . 64 (3): 495–500. doi : 10.1016 / S0091-3057 (99) 00094-5 . PMID 10548261 . S2CID 24717770 .
- ^ Lütke-Eversloh T, Santos CN, Stephanopoulos G (diciembre de 2007). "Perspectivas de la producción biotecnológica de L-tirosina y sus aplicaciones". Microbiología y Biotecnología Aplicadas . 77 (4): 751–62. doi : 10.1007 / s00253-007-1243-y . PMID 17968539 . S2CID 23088822 .
- ^ Chavez-Bejar M, Baez-Viveros J, Martinez A, Bolivar F, Gosset G (2012). "Producción biotecnológica de L-tirosina y compuestos derivados". Bioquímica de procesos . 47 (7): 1017–1026. doi : 10.1016 / j.procbio.2012.04.005 .
- ^ Lütke-Eversloh T, Santos CN, Stephanopoulos G (diciembre de 2007). "Perspectivas de la producción biotecnológica de L-tirosina y sus aplicaciones". Microbiología y Biotecnología Aplicadas . 77 (4): 751–62. doi : 10.1007 / s00253-007-1243-y . PMID 17968539 . S2CID 23088822 .
Enlaces externos [ editar ]
- Espectro de tirosina MS
- Metabolismo de la tirosina
- Biosíntesis de fenilalanina y tirosina
- Biosíntesis de fenilalanina, tirosina y triptófano
- Tirosina en la base de datos ChemIDplus