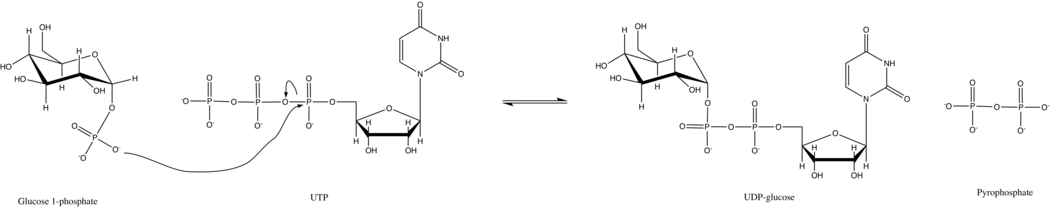
UTP: glucosa-1-fosfato uridililtransferasa
UTP: glucosa-1-fosfato uridililtransferasa, también conocida como glucosa-1-fosfato uridililtransferasa (o UDP-glucosa pirofosforilasa ) es una enzima involucrada en el metabolismo de los carbohidratos . Sintetiza UDP-glucosa a partir de glucosa-1-fosfato y UTP ; es decir,
UTP: glucosa-1-fosfato uridililtransferasa es una enzima que se encuentra en los tres dominios ( bacterias , eukarya y arqueas ), ya que es un actor clave en la glucogénesis y la síntesis de la pared celular . Su papel en el metabolismo del azúcar se ha estudiado ampliamente en plantas para comprender el crecimiento de las plantas y aumentar la producción agrícola. Recientemente, se ha estudiado y cristalizado la UTP-glucosa-1-fosfato uridililtransferasa humana, lo que revela un tipo de regulación diferente al de otros organismos previamente estudiados. Su importancia se deriva de los muchos usos de UDP-glucosa, incluido el metabolismo de la galactosa , la síntesis de glucógeno ,síntesis de glicoproteínas y síntesis de glicolípidos . [1] [2]
La estructura de UTP-glucosa-1-fosfato uridililtransferasa es significativamente diferente entre procariotas y eucariotas , pero dentro de las eucariotas, las estructuras primaria, secundaria y terciaria de la enzima están bastante conservadas. [3] En muchas especies, la UTP-glucosa-1-fosfato uridililtransferasa se encuentra como un homopolímero que consta de subunidades idénticas en una estructura cuaternaria simétrica. [4] [5] El número de subunidades varía entre especies: por ejemplo, en Escherichia coli , la enzima se encuentra como un tetrámero, mientras que en Burkholderia xenovorans , la enzima es dimérica. [5] [6]En los seres humanos y en las levaduras, la enzima es activa como un octámero que consta de dos tetrámeros apilados entre sí con residuos hidrófobos conservados en las interfaces entre las subunidades. [7] [8] En contraste, la enzima en las plantas ha conservado residuos cargados que forman la interfaz entre las subunidades.
En los seres humanos, cada subunidad enzimática contiene varios residuos (L113, N251 y N328) que están muy conservados en eucariotas. Un motivo de pliegue de Rossman participa en la unión del nucleótido UTP y un dominio de unión al azúcar (residuos T286-G293) se coordina con el anillo de glucosa. [9] Una mutación sin sentido (G115D) en la región de la enzima que contiene el sitio activo (que se conserva en eucariotas) provoca una disminución drástica de la actividad enzimática in vitro. [10]
Los genes humanos que codifican proteínas con actividad UTP-glucosa-1-fosfato uridililtransferasa incluyen dos isoformas con pesos moleculares de 56,9 y 55,7 kDa, respectivamente. [11]
La UTP-glucosa-1-fosfato uridililtransferasa es de naturaleza ubicua debido a su importante papel en la generación de UDP-glucosa , un compuesto central en el metabolismo de los carbohidratos. En las hojas de las plantas, la UTP-glucosa-1-fosfato uridililtransferasa es una parte clave de la vía de biosíntesis de sacarosa , que suministra glucosa difosfato de uridina a la sacarosa-fosfato sintasa que convierte la UDP-glucosa y la D -fructosa 6-fosfato en sacarosa-6-fosfato. [12] También puede ser parcialmente responsable de la descomposición de la sacarosa en otros tejidos usando UDP-glucosa.