Coenzima Q 10
 | |
| Nombres | |
|---|---|
| Nombre IUPAC preferido 2 - [(2 E , 6 E , 10 E , 14 E , 18 E , 22 E , 26 E , 30 E , 34 E ) -3,7,11,15,19,23,27,31,35, 39-decametiltetraconta-2,6,10,14,18,22,26,30,34,38-decaen-1-il] -5,6-dimetoxi-3-metilciclohexa-2,5-dieno-1,4 -dione | |
| Otros nombres La ubiquinona, ubidecarenona, coenzima Q, la CoQ 10 , / ˌ k oʊ ˌ k Ju t ɛ n / , la CoQ, Q 10 , vitamina Q | |
| Identificadores | |
Modelo 3D ( JSmol ) | |
| CHEBI | |
| CHEMBL | |
| ChemSpider | |
| Tarjeta de información ECHA | 100.005.590 |
PubChem CID | |
| UNII | |
Tablero CompTox ( EPA ) | |
| |
| |
| Propiedades | |
| C 59 H 90 O 4 | |
| Masa molar | 863,365 g · mol −1 |
| Apariencia | sólido amarillo o naranja |
| Punto de fusion | 48–52 ° C (118–126 ° F; 321–325 K) |
| insoluble | |
| Farmacología | |
| C01EB09 ( OMS ) | |
| Compuestos relacionados | |
Quinonas relacionadas | 1,4-benzoquinona plastoquinona ubiquinol |
Salvo que se indique lo contrario, los datos se proporcionan para materiales en su estado estándar (a 25 ° C [77 ° F], 100 kPa). | |
| Referencias de Infobox | |
La coenzima Q , también conocida como ubiquinona , es una familia de coenzimas que es ubicua en los animales y la mayoría de las bacterias (de ahí el nombre de ubiquinona). En los seres humanos, la forma más común es la coenzima Q 10 o ubiquinona-10 . La CoQ 10 no está aprobada por la Administración de Drogas y Alimentos de los Estados Unidos (FDA) para el tratamiento de ninguna condición médica; [1] sin embargo, se vende como suplemento dietético y es un ingrediente de algunos cosméticos. [2] [3]
Es una 1,4-benzoquinona , donde Q se refiere al grupo químico de quinona y 10 se refiere al número de subunidades químicas de isoprenilo en su cola. En las ubiquinonas naturales, el número puede oscilar entre 6 y 10. Esta familia de sustancias liposolubles, que se asemejan a las vitaminas , está presente en todas las células eucariotas que respiran , principalmente en las mitocondrias . Es un componente de la cadena de transporte de electrones y participa en la respiración celular aeróbica , que genera energía en forma de ATP . Noventa y cinco por ciento del cuerpo humanoLa energía se genera de esta manera. [4] [5] Los órganos con los requisitos de energía más altos, como el corazón , el hígado y los riñones, tienen las concentraciones más altas de CoQ 10 . [6] [7] [8]
Hay tres estados redox de CoQ: completamente oxidado ( ubi quinona), semi quinona ( ubisemi quinona) y completamente reducido ( ubiquinol ). La capacidad de esta molécula para actuar como un portador de dos electrones (moviéndose entre la forma quinona y quinol) y un portador de un electrón (moviéndose entre la semiquinona y una de estas otras formas) es fundamental para su papel en la cadena de transporte de electrones. debido a los grupos de hierro-azufre que sólo pueden aceptar un electrón a la vez, y como un antioxidante eliminador de radicales libres .
Deficiencia y toxicidad
Hay dos factores principales que conducen a la deficiencia de CoQ 10 en humanos: biosíntesis reducida y mayor uso por parte del cuerpo. La biosíntesis es la principal fuente de CoQ 10 . La biosíntesis requiere al menos 12 genes y las mutaciones en muchos de ellos causan deficiencia de CoQ. Los niveles de CoQ 10 también pueden verse afectados por otros defectos genéticos (como mutaciones del ADN mitocondrial , ETFDH , APTX , FXN y BRAF , genes que no están directamente relacionados con el proceso biosintético de CoQ 10 ). Algunos de estos, como las mutaciones en COQ6 , pueden provocar enfermedades graves como la resistencia a los esteroides.síndrome nefrótico con sordera neurosensorial .
Se informan algunos efectos adversos, principalmente gastrointestinales, con ingestas muy elevadas. El método de evaluación de riesgos del nivel de seguridad observado (OSL) indicó que la evidencia de seguridad es fuerte en ingestas de hasta 1200 mg / día, y este nivel se identifica como OSL. [9]
Evaluación
Aunque la CoQ 10 se puede medir en el plasma sanguíneo , estas mediciones reflejan la ingesta dietética más que el estado de los tejidos. Actualmente, la mayoría de los centros clínicos miden los niveles de CoQ 10 en cultivos de fibroblastos cutáneos , biopsias musculares y células mononucleares sanguíneas. [10] fibroblastos de cultivo puede usarse también para evaluar la tasa de endógeno de CoQ 10 biosíntesis, mediante la medición de la absorción de 14 C - marcado p -hidroxibenzoato . [11]
Estatinas
Se ha sugerido que la miotoxicidad de las estatinas se debe al deterioro de la biosíntesis de CoQ, pero la evidencia que respalda esto se consideró controvertida en 2011. [10] [ necesita actualización ]
Si bien las estatinas pueden reducir la coenzima Q 10 en la sangre, no está claro si reducen la coenzima Q 10 en el músculo. [12] La evidencia no respalda que la suplementación mejore los efectos secundarios de las estatinas. [12]
Suplemento dietético
Regulación y composición
CoQ 10 se vende en muchas jurisdicciones como un suplemento dietético a nombre de UbiQ 300 y UbiQ 100, no sujeto a las mismas regulaciones que los medicamentos , pero no aprobado para el tratamiento de ninguna condición médica . [1] [13] La fabricación de CoQ 10 no está regulada, y los diferentes lotes y marcas pueden variar significativamente: [1] un análisis de laboratorio de 2004 realizado por ConsumerLab.com de suplementos de CoQ 10 a la venta en los EE. UU. Encontró que algunos no contenían la cantidad identificada en la etiqueta del producto. Las cantidades oscilaron entre "CoQ 10 no detectable", hasta el 75% de la dosis indicada, hasta un 75% de exceso. [14]
Generalmente, la CoQ 10 se tolera bien. Los efectos secundarios más comunes son síntomas gastrointestinales ( náuseas , vómitos , supresión del apetito y dolor abdominal ), erupciones cutáneas y dolores de cabeza . [15]
Si bien no existe una dosis ideal establecida de CoQ 10 , una dosis diaria típica es de 100 a 200 miligramos. Las diferentes formulaciones tienen cantidades declaradas variables de CoQ 10 y otros ingredientes.
Enfermedad del corazón
Una revisión Cochrane de 2014 no encontró "evidencia convincente para apoyar o refutar" el uso de CoQ 10 para el tratamiento de la insuficiencia cardíaca . [16] Otra revisión Cochrane de 2014 encontró evidencia insuficiente para llegar a una conclusión sobre su uso para la prevención de enfermedades cardíacas. [17] Una revisión Cochrane de 2016 concluyó que la CoQ 10 no tuvo ningún efecto sobre la presión arterial . [18] En un metanálisis de 2017 de personas con insuficiencia cardíaca, 30 a 100 mg / día de CoQ 10 resultó en un 31% menos de mortalidad. También se incrementó la capacidad de ejercicio. No se encontraron diferencias significativas en los criterios de valoración de la fracción de eyección del corazón izquierdo yClasificación de la New York Heart Association (NYHA). [19]
Migrañas
La guía de la Canadian Headache Society para la profilaxis de la migraña recomienda, basándose en pruebas de baja calidad, que se ofrezcan 300 mg de CoQ 10 como opción para la profilaxis. [20]
Miopatía por estatinas
La CoQ 10 se ha utilizado habitualmente para tratar la degradación muscular asociada como efecto secundario del uso de estatinas . Un metanálisis de 2015 de ensayos controlados aleatorios encontró que la CoQ 10 no tenía ningún efecto sobre la miopatía por estatinas . [21] Un metanálisis de 2018 concluyó que había evidencia preliminar de que la CoQ 10 oral reduce los síntomas musculares asociados con las estatinas, incluidos el dolor muscular, la debilidad muscular, los calambres musculares y el cansancio muscular. [22]
Cáncer
Hasta 2014 [actualizar]no se habían realizado grandes ensayos clínicos de CoQ 10 en el tratamiento del cáncer . [1] El Instituto Nacional del Cáncer de EE. UU. Identificó problemas con los pocos estudios pequeños que se habían realizado, indicando que "la forma en que se realizaron los estudios y la cantidad de información reportada no estaba claro si los beneficios fueron causados por la CoQ 10 o por otra cosa ". [1] La Sociedad Estadounidense del Cáncer concluyó que "la CoQ 10 puede reducir la eficacia de la quimioterapia y la radioterapia, por lo que la mayoría de los oncólogos recomendarían evitarla durante el tratamiento del cáncer". [23]
Enfermedad dental
Un estudio de revisión de 1995 encontró que no hay ningún beneficio clínico para el uso de CoQ 10 en el tratamiento de la enfermedad periodontal . [24] La mayoría de los estudios que sugirieron lo contrario estaban desactualizados, se centraron en pruebas in vitro , [25] [26] [27] tenían muy pocos sujetos de prueba y / o metodología estadística y configuración de prueba erróneas, [28] [29] o eran patrocinado por un fabricante del producto. [30]
Enfermedad renal crónica
En 2019 se propuso una revisión de los efectos de la suplementación con CoQ 10 en personas con ERC. [31]
Usos adicionales
La coenzima Q10 también se ha utilizado para tratar la enfermedad de Alzheimer, el colesterol alto o la esclerosis lateral amiotrófica (enfermedad de Lou Gehrig). Sin embargo, la investigación ha demostrado que este medicamento puede no ser eficaz para tratar estas afecciones [32].
La coenzima Q10 también se ha utilizado como ingrediente activo en cosmecéuticos y como ingrediente inactivo en formulaciones de protección solar . Cuando se aplica tópicamente en productos para el cuidado de la piel, demuestra cierta capacidad para reducir el estrés oxidativo en la piel, [33] retrasa los signos del envejecimiento cutáneo intrínseco, revierte los signos del envejecimiento cutáneo extrínseco, [34] [35] ayuda a desvanecer la pigmentación , [36] [ 37] aumentan la estabilidad de ciertos protectores solares activos, [38] aumentan el SPF de los protectores solares, [39] y brindan algo de protección infrarroja a los protectores solares. [40] [41] Gran parte de la investigación sobre los beneficios para la piel de la ubiquinona muestra que funciona sinérgicamente con otros antioxidantes tópicos para mejorar la piel y las formulaciones cosméticas.
Interacciones
La coenzima Q 10 tiene el potencial de inhibir los efectos de la teofilina así como el anticoagulante warfarina ; la coenzima Q 10 puede interferir con las acciones de la warfarina al interactuar con las enzimas del citocromo p450 , reduciendo así el INR , una medida de la coagulación sanguínea. [42] La estructura de la coenzima Q 10 es muy similar a la de la vitamina K , que compite con los efectos anticoagulantes de la warfarina y los contrarresta. La coenzima Q 10 debe evitarse en pacientes que actualmente toman warfarina debido al mayor riesgo de coagulación. [15]
Propiedades químicas
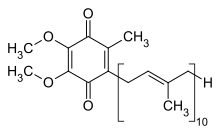
La estructura oxidada de CoQ 10 se muestra en la parte superior derecha. Los diversos tipos de coenzima Q pueden distinguirse por el número de subunidades isoprenoides en sus cadenas laterales . La coenzima Q más común en las mitocondrias humanas es CoQ 10 . Q se refiere a la cabeza de la quinona y 10 se refiere al número de repeticiones de isopreno en la cola. La siguiente molécula tiene tres unidades isoprenoides y se llamaría Q 3 .
En su estado puro, es un polvo lipófilo de color naranja, y no tiene sabor ni olor. [43] : 230
Biosíntesis
La biosíntesis ocurre en la mayoría de los tejidos humanos. Hay tres pasos principales:
- Creación de la estructura de benzoquinona (usando fenilalanina o tirosina , vía 4-hidroxibenzoato )
- Creación de la cadena lateral de isopreno (utilizando acetil-CoA )
- La unión o condensación de las dos estructuras anteriores.
Las dos reacciones iniciales ocurren en las mitocondrias , el retículo endoplásmico y los peroxisomas , lo que indica múltiples sitios de síntesis en las células animales. [44]
Una enzima importante en esta vía es la HMG-CoA reductasa , generalmente un objetivo de intervención en las complicaciones cardiovasculares. La familia de medicamentos para reducir el colesterol "estatinas" inhibe la HMG-CoA reductasa. Un posible efecto secundario de las estatinas es la disminución de la producción de CoQ 10 , que puede estar relacionada con el desarrollo de miopatía y rabdomiólisis . Sin embargo, el papel que juegan las estatinas en la deficiencia de CoQ es controvertido. Aunque estos medicamentos reducen los niveles sanguíneos de CoQ, aún no se han realizado estudios sobre los efectos de los niveles musculares de CoQ. La suplementación con CoQ tampoco reduce los efectos secundarios de las estatinas. [10] [12]
Los genes involucrados incluyen PDSS1 , PDSS2 , COQ2 y ADCK3 ( COQ8 , CABC1 ). [45]
Los organismos distintos de los humanos utilizan sustancias químicas de origen algo diferentes para producir la estructura de benzoquinona y la estructura de isopreno. Por ejemplo, la bacteria E. coli produce la primera a partir del corismato y la última a partir de una fuente distinta del mevalonato. La levadura común S. cerevisiae , sin embargo, deriva la primera del corismato o la tirosina y la última del mevalonato . La mayoría de los organismos comparten el intermedio común 4-hidroxibenzoato, pero nuevamente utilizan diferentes pasos para llegar a la estructura "Q". [46]
Absorción y metabolismo
Absorción
CoQ 10 es un polvo cristalino insoluble en agua. La absorción sigue el mismo proceso que la de los lípidos; el mecanismo de absorción parece ser similar al de la vitamina E , otro nutriente soluble en lípidos. Este proceso en el cuerpo humano implica la secreción en el intestino delgado de enzimas pancreáticas y bilis , lo que facilita la emulsificación y formación de micelas necesarias para la absorción de sustancias lipofílicas . [47] La ingesta de alimentos (y la presencia de lípidos) estimula la excreción biliar corporal de ácidos biliares y mejora en gran medida la absorción de CoQ.10 . La CoQ 10 exógena se absorbe en el intestino delgado y se absorbe mejor si se toma con una comida. La concentración sérica de CoQ 10 en condiciones de alimentación es más alta que en condiciones de ayuno. [48] [49]
Metabolismo
Los datos sobre el metabolismo de la CoQ 10 en animales y seres humanos son limitados. [50] Un estudio con 14 C marcado con la CoQ 10 en ratas mostraron la mayor parte de la radiactividad en el hígado dos horas después de la administración oral cuando se observó la radiactividad plasmática máxima, pero la CoQ 9 (con sólo 9 unidades de isoprenilo) es la forma predominante de coenzima Q en ratas. [51] Parece que la CoQ 10 se metaboliza en todos los tejidos, mientras que una ruta principal para su eliminación es la excreción biliar y fecal . Después de la retirada de CoQ 10suplementación, los niveles vuelven a la normalidad en unos pocos días, independientemente del tipo de formulación utilizada. [52]
Farmacocinética
Se han publicado algunos informes sobre la farmacocinética de CoQ 10 . El pico plasmático se puede observar 2-6 horas después de la administración oral, dependiendo principalmente del diseño del estudio. En algunos estudios, también se observó un segundo pico plasmático aproximadamente a las 24 horas después de la administración, probablemente debido tanto al reciclaje enterohepático como a la redistribución del hígado a la circulación. [47] Tomono y col . usó CoQ10 cristalino marcado con deuterio para investigar la farmacocinética en humanos y determinó un tiempo medio de eliminación de 33 horas. [53]
Mejorando la biodisponibilidad de CoQ 10
Es bien conocida la importancia de cómo se formulan los fármacos para la biodisponibilidad. Con el fin de encontrar un principio para aumentar la biodisponibilidad de CoQ 10 después de la administración oral, se han adoptado varios enfoques nuevos; Se han desarrollado y probado diferentes formulaciones y formas en animales y seres humanos. [50]
Reducción del tamaño de las partículas
Se han explorado las nanopartículas como un sistema de administración de varios fármacos, como la mejora de la biodisponibilidad oral de fármacos con características de baja absorción. [54] Sin embargo, esto no ha tenido éxito con CoQ 10 , aunque los informes han diferido ampliamente. [55] [56] El uso de suspensión acuosa de CoQ 10 finamente pulverizado en agua pura también revela sólo un efecto menor. [52]
Cápsulas de gel blando con CoQ 10 en suspensión de aceite
Un enfoque exitoso es utilizar el sistema de emulsión para facilitar la absorción del tracto gastrointestinal y mejorar la biodisponibilidad. Las emulsiones de aceite de soja (microesferas de lípidos) pudieron estabilizarse muy eficazmente con lecitina y se utilizaron en la preparación de cápsulas de gelatina blanda. En uno de los primeros intentos de este tipo, Ozawa et al. realizó un estudio farmacocinético en beagles en el que se investigó la emulsión de CoQ 10 en aceite de soja; aproximadamente el doble del plasma de CoQ 10 nivel que el de la preparación de comprimidos de control se determinó durante la administración de una microesfera de lípidos. [52]Aunque Kommuru et al. Observaron una mejora casi insignificante de la biodisponibilidad . con ucápsulas de gelatina blanda a base de aceite en un estudio posterior en perros, [57] se confirmó el aumento significativo de la biodisponibilidad de CoQ 10 para varias formulaciones a base de aceite en la mayoría de los otros estudios. [58]
Nuevas formas de CoQ 10 con mayor solubilidad en agua
Facilitar la absorción del fármaco aumentando su solubilidad en agua es una estrategia farmacéutica común y también se ha demostrado que tiene éxito con la CoQ 10 . Se han desarrollado varios enfoques para lograr este objetivo, y muchos de ellos producen resultados significativamente mejores que las cápsulas de gelatina blanda a base de aceite a pesar de los muchos intentos de optimizar su composición. [50] Ejemplos de tales enfoques son el uso de la dispersión acuosa de CoQ 10 sólido con el polímero tiloxapol , [59] formulaciones basadas en varios agentes solubilizantes, como lecitina hidrogenada , [60] y la complejación con ciclodextrinas.; entre estos últimos, se ha encontrado que el complejo con β-ciclodextrina tiene una biodisponibilidad muy aumentada [61] [62] y también se utiliza en las industrias farmacéutica y alimentaria para la fortificación con CoQ 10 . [50]
Historia
En 1950, GN Festenstein fue el primero en aislar una pequeña cantidad de CoQ 10 del revestimiento del intestino de un caballo en Liverpool , Inglaterra. En estudios posteriores, el compuesto se denominó brevemente sustancia SA , se consideró quinona y se observó que se podía encontrar en muchos tejidos de varios animales. [63]
En 1957, Frederick L. Crane y sus colegas del Instituto de Enzimas de la Universidad de Wisconsin-Madison aislaron el mismo compuesto de las membranas mitocondriales del corazón de res y notaron que transportaba electrones dentro de las mitocondrias. Lo llamaron Q-275 para abreviar, ya que era una quinona . [64] [63] Pronto notaron que Q-275 y la sustancia SA estudiada en Inglaterra pueden ser el mismo compuesto. Esto se confirmó más tarde ese año y Q-275 / sustancia SA pasó a llamarse ubiquinona, ya que era una quinona ubicua que se podía encontrar en todos los tejidos animales. [63] [43]
En 1958, DE Wolf y sus colegas que trabajaban con Karl Folkers en Merck en Rahway informaron sobre su estructura química completa . [65] [63] [43] Más tarde, ese mismo año, DE Green y sus colegas del grupo de investigación de Wisconsin sugirieron que la ubiquinona debería llamarse mitoquinona o coenzima Q debido a su participación en la cadena de transporte de electrones mitocondrial . [63] [43]
En 1966, A. Mellors y AL Tappel de la Universidad de California fueron los primeros en demostrar que la CoQ 6 reducida era un antioxidante eficaz en las células. [66] [43]
En la década de 1960, Peter D. Mitchell amplió la comprensión de la función mitocondrial a través de su teoría del gradiente electroquímico , que involucra la CoQ 10 , y a finales de la década de 1970, los estudios de Lars Ernster ampliaron la importancia de la CoQ 10 como antioxidante. La década de 1980 fue testigo de un fuerte aumento en el número de ensayos clínicos con CoQ 10 . [43]
Concentraciones dietéticas
En 2010 se publicaron revisiones detalladas sobre la aparición de CoQ 10 y la ingesta dietética. [67] Además de la síntesis endógena dentro de los organismos, varios alimentos también suministran CoQ 10 al organismo. Sin embargo, a pesar del gran interés de la comunidad científica en este compuesto, se ha realizado un número muy limitado de estudios para determinar el contenido de CoQ 10 en componentes dietéticos. Los primeros informes sobre este aspecto se publicaron en 1959, pero la sensibilidad y selectividad de los métodos analíticos en ese momento no permitían análisis confiables, especialmente para productos con bajas concentraciones. [67] Desde entonces, los avances en la química analítica han permitido una determinación más confiable de CoQ 10. concentraciones en varios alimentos:
| Comida | Concentración de CoQ 10 (mg / kg) | |
|---|---|---|
| Carne de res | corazón | 113 |
| hígado | 39–50 | |
| músculo | 26–40 | |
| Cerdo | corazón | 12-128 |
| hígado | 23–54 | |
| músculo | 14–45 | |
| Pollo | seno | 8-17 |
| muslo | 24-25 | |
| ala | 11 | |
| Pez | sardina | 5-64 |
| caballa : | ||
| - carne roja | 43–67 | |
| - carne blanca | 11-16 | |
| salmón | 4-8 | |
| atún | 5 | |
| Aceites | haba de soja | 54–280 |
| aceituna | 4–160 | |
| semilla de uva | 64–73 | |
| girasol | 4-15 | |
| canola | 64–73 | |
| Nueces | maní | 27 |
| nuez | 19 | |
| semilla de sésamo | 18-23 | |
| pistacho | 20 | |
| avellana | 17 | |
| almendra | 5-14 | |
| Verduras | perejil | 8-26 |
| brócoli | 6–9 | |
| coliflor | 2-7 | |
| Espinacas | hasta 10 | |
| col china | 2-5 | |
| Fruta | palta | 10 |
| grosella negra | 3 | |
| uva | 6–7 | |
| fresa | 1 | |
| naranja | 1-2 | |
| pomelo | 1 | |
| manzana | 1 | |
| Plátano | 1 | |
La carne y el pescado son las fuentes más ricas de CoQ 10 en la dieta ; se pueden encontrar niveles superiores a 50 mg / kg en el corazón e hígado de res , cerdo y pollo . Los productos lácteos son fuentes mucho más pobres de CoQ 10 que los tejidos animales. Los aceites vegetales también son bastante ricos en CoQ 10 . Dentro de las verduras, el perejil y la perilla son las fuentes más ricas en CoQ 10 , pero se pueden encontrar diferencias significativas en sus niveles de CoQ 10 en la literatura. Brócoli , uvas y coliflor.son fuentes modestas de CoQ 10 . La mayoría de las frutas y bayas representan una fuente pobre o muy pobre de CoQ 10 , con la excepción de los aguacates , que tienen un contenido relativamente alto de CoQ 10 . [67]
Consumo
En el mundo desarrollado, la ingesta diaria estimada de CoQ 10 se ha determinado en 3 a 6 mg por día, derivado principalmente de la carne. [67]
Efecto del calor y el procesamiento.
Cocinar friendo reduce el contenido de CoQ 10 entre un 14% y un 32%. [68]
Ver también
- Idebenona : análogo sintético con propiedades de generación de oxidantes reducidas
- Mesilato de mitoquinona : análogo sintético con permeabilidad mitocondrial mejorada
Referencias
- ↑ a b c d e White, J. (14 de mayo de 2014). "PDQ® Coenzima Q 10 " . Instituto Nacional del Cáncer , Institutos Nacionales de Salud , Departamento de Salud y Servicios Humanos de EE . UU . Consultado el 29 de junio de 2014 .
- ^ Hojerová, J (mayo de 2000). "[Coenzima Q10 - su importancia, propiedades y uso en nutrición y cosmética]". Ceska a Slovenska Farmacie: Casopis Ceske Farmaceuticke Spolecnosti a Slovenske Farmaceuticke Spolecnosti . 49 (3): 119–23. PMID 10953455 .
- ^ "¿Qué es la coenzima Q10 (CoQ10) y por qué se encuentra en los productos para el cuidado de la piel?" . WebMD .
- ^ Ernster L, Dallner G (mayo de 1995). "Aspectos bioquímicos, fisiológicos y médicos de la función de ubiquinona" . Biochimica et Biophysica Acta (BBA) - Bases moleculares de la enfermedad . 1271 (1): 195-204. doi : 10.1016 / 0925-4439 (95) 00028-3 . PMID 7599208 .
- ↑ Dutton, P. L .; Ohnishi, T .; Darrouzet, E .; Leonard, M. A .; Sharp, R. E .; Cibney, B. R .; Daldal, F .; Moser, C. C. (2000). "4 reacciones de reducción de oxidación de coenzima Q en el transporte de electrones mitocondriales". En Kagan, V. E .; Quinn, P. J. (eds.). Coenzima Q: Mecanismos moleculares en salud y enfermedad . Boca Ratón: CRC Press. págs. 65–82.
- ↑ Okamoto T, Matsuya T, Fukunaga Y, Kishi T, Yamagami T (1989). "Niveles de ubiquinol-10 en suero humano y relación con los lípidos séricos". Revista internacional de investigación sobre vitaminas y nutrición. Internationale Zeitschrift für Vitamin- und Ernahrungsforschung. Journal International de Vitaminologie et de Nutrition . 59 (3): 288–92. PMID 2599795 .
- ^ Aberg F, Appelkvist EL, Dallner G, Ernster L (junio de 1992). "Distribución y estado redox de ubiquinonas en tejidos humanos y de rata". Archivos de Bioquímica y Biofísica . 295 (2): 230–4. doi : 10.1016 / 0003-9861 (92) 90511-T . PMID 1586151 .
- ^ Shindo Y, Witt E, Han D, Epstein W, Packer L (enero de 1994). "Antioxidantes enzimáticos y no enzimáticos en la epidermis y dermis de la piel humana" . The Journal of Investigative Dermatology . 102 (1): 122–4. doi : 10.1111 / 1523-1747.ep12371744 . PMID 8288904 .
- ^ Hathcock JN, Shao A (agosto de 2006). "Evaluación de riesgos de la coenzima Q10 (ubiquinona)". Toxicología regulatoria y farmacología . 45 (3): 282–8. doi : 10.1016 / j.yrtph.2006.05.006 . PMID 16814438 .
- ↑ a b c Trevisson E, DiMauro S, Navas P, Salviati L (octubre de 2011). "Deficiencia de coenzima Q en el músculo". Opinión actual en neurología . 24 (5): 449–56. doi : 10.1097 / WCO.0b013e32834ab528 . hdl : 10261/129020 . PMID 21844807 .
- ^ Montero R, Sánchez-Alcázar JA, Briones P, Hernández AR, Cordero MD, Trevisson E, et al. (Junio de 2008). "Análisis de coenzima Q10 en músculo y fibroblastos para el diagnóstico de síndromes por deficiencia de CoQ10". Bioquímica clínica . 41 (9): 697–700. doi : 10.1016 / j.clinbiochem.2008.03.007 . PMID 18387363 .
- ^ a b c Tan JT, Barry AR (junio de 2017). "Suplementación de coenzima Q10 en el tratamiento de la mialgia asociada a estatinas" . Revista Estadounidense de Farmacia del Sistema de Salud . 74 (11): 786–793. doi : 10.2146 / ajhp160714 . PMID 28546301 . S2CID 3825396 .
- ^ "Trastornos mitocondriales en niños: coenzima Q10" . Reino Unido: Instituto Nacional para la Excelencia en la Salud y la Atención. 28 de marzo de 2017.
- ^ "ConsumerLab.com encuentra discrepancias en la fuerza de los suplementos de CoQ 10 ". Carta de Townsend para médicos y pacientes . Agosto-septiembre de 2004. p. 19.
- ↑ a b Wyman M, Leonard M, Morledge T (julio de 2010). "Coenzima Q10: ¿una terapia para la hipertensión y la mialgia inducida por estatinas?". Revista de Medicina de la Clínica Cleveland . 77 (7): 435–42. doi : 10.3949 / ccjm.77a.09078 . PMID 20601617 . S2CID 26572524 .
- ^ Madmani ME, Yusuf Solaiman A, Tamr Agha K, Madmani Y, Shahrour Y, Essali A, Kadro W (junio de 2014). "Coenzima Q10 para insuficiencia cardíaca". Grupo del corazón. La base de datos Cochrane de revisiones sistemáticas (6): CD008684. doi : 10.1002 / 14651858.CD008684.pub2 . PMID 24049047 .
- ^ Flowers N, Hartley L, Todkill D, Stranges S, Rees K (4 de diciembre de 2014). "Suplementación de coenzima Q10 para la prevención primaria de enfermedades cardiovasculares". La base de datos Cochrane de revisiones sistemáticas . 12 (12): CD010405. doi : 10.1002 / 14651858.CD010405.pub2 . PMID 25474484 .
- ^ Ho MJ, Li EC, Wright JM (marzo de 2016). "Eficacia reductora de la presión arterial de la coenzima Q10 para la hipertensión primaria" . La base de datos Cochrane de revisiones sistemáticas . 3 (3): CD007435. doi : 10.1002 / 14651858.CD007435.pub3 . PMC 6486033 . PMID 26935713 .
- ^ Lei L, Liu Y (julio de 2017). "Eficacia de la coenzima Q10 en pacientes con insuficiencia cardíaca: un metaanálisis de ensayos clínicos" . Trastornos cardiovasculares de BMC . 17 (1): 196. doi : 10.1186 / s12872-017-0628-9 . PMC 5525208 . PMID 28738783 .
- ^ Pringsheim T, Davenport W, Mackie G, Worthington I, Aubé M, Christie SN, et al. (Marzo de 2012). "Guía de la Canadian Headache Society para la profilaxis de la migraña". La Revista Canadiense de Ciencias Neurológicas . 39 (2 Suppl 2): S1-59. PMID 22683887 .
- ^ Banach M, Serban C, Sahebkar A, Ursoniu S, Rysz J, Muntner P, et al. (Enero de 2015). "Efectos de la coenzima Q10 sobre la miopatía inducida por estatinas: un metanálisis de ensayos controlados aleatorios". Actas de Mayo Clinic (revisión sistemática y metaanálisis). Grupo de colaboración de metaanálisis de lípidos y presión arterial. 90 (1): 24–34. doi : 10.1016 / j.mayocp.2014.08.021 . PMID 25440725 .
- ^ Qu H, Guo M, Chai H, Wang WT, Gao ZY, Shi DZ (octubre de 2018). "Efectos de la coenzima Q10 en la miopatía inducida por estatinas: un metaanálisis actualizado de ensayos controlados aleatorios" . Revista de la Asociación Estadounidense del Corazón . 7 (19): e009835. doi : 10.1161 / JAHA.118.009835 . PMC 6404871 . PMID 30371340 .
- ^ "Coenzima Q 10 " . Sociedad Americana del Cáncer.
- ^ Watts TL (marzo de 1995). "Coenzima Q10 y tratamiento periodontal: ¿hay algún efecto beneficioso?". British Dental Journal . 178 (6): 209–13. doi : 10.1038 / sj.bdj.4808715 . PMID 7718355 . S2CID 7207070 .
- ^ Folkers K, Hanioka T, Xia LJ, McRee JT, Langsjoen P (abril de 1991). "La coenzima Q10 aumenta las proporciones de linfocitos T4 / T8 en sujetos normales y su relevancia para los pacientes que tienen el complejo relacionado con el SIDA". Comunicaciones de investigación bioquímica y biofísica . 176 (2): 786–91. doi : 10.1016 / S0006-291X (05) 80254-2 . PMID 1673841 .
- ^ Littarru GP, Nakamura R, Ho L, Folkers K, Kuzell WC (octubre de 1971). "Deficiencia de coenzima Q 10 en tejido gingival de pacientes con enfermedad periodontal" . Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 68 (10): 2332–5. Código Bibliográfico : 1971PNAS ... 68.2332L . doi : 10.1073 / pnas.68.10.2332 . PMC 389415 . PMID 5289867 .
- ^ Nakamura R, Littarru GP, Folkers K, Wilkinson EG (abril de 1974). "Estudio de las enzimas CoQ10 en la encía de pacientes con enfermedad periodontal y evidencia de una deficiencia de coenzima Q10" . Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 71 (4): 1456–60. Código Bibliográfico : 1974PNAS ... 71.1456N . doi : 10.1073 / pnas.71.4.1456 . PMC 388248 . PMID 4151519 .
- ^ McRee, J. T .; Hanioka, T .; Shizukuishi, S .; Folkers, K. (1993). "Terapia con coenzima Q 10 para pacientes con enfermedad periodontal" . Revista de salud dental . 43 (5): 659–666. doi : 10.5834 / jdh.43.659 .
- ^ Hanioka T, Tanaka M, Ojima M, Shizukuishi S, Folkers K (1994). "Efecto de la aplicación tópica de coenzima Q10 sobre periodontitis adulta". Aspectos moleculares de la medicina . 15 Supl (Supl): s241-8. doi : 10.1016 / 0098-2997 (94) 90034-5 . PMID 7752836 .
- ^ Wilkinson EG, Arnold RM, Folkers K (agosto de 1976). "Bioenergética en medicina clínica. VI. Tratamiento adyuvante de la enfermedad periodontal con coenzima Q10". Comunicaciones de Investigación en Patología Química y Farmacología . 14 (4): 715–9. PMID 785563 .
- ^ Xu, Yongxing; Liu, Juan; Han, Enhong; Wang, Yan; Gao, Jianjun (2019). "Eficacia de la coenzima Q10 en pacientes con enfermedad renal crónica: protocolo para una revisión sistemática" . BMJ Open . 9 (5): e029053. doi : 10.1136 / bmjopen-2019-029053 . ISSN 2044-6055 . PMC 6530451 . PMID 31092669 .
- ^ https://neurologycentretoronto.com/wp-content/uploads/2017/06/14-Coenzyme-Q10-Drugs.com_.pdf
- ^ Knott, Anja; Achterberg, Volker; Smuda, Christoph; Mielke, Heiko; Sperling, Gabi; Dunckelmann, Katja; Vogelsang, Alexandra; Krüger, Andrea; Schwengler, Helge; Behtash, Mojgan; Kristof, Sonja (12 de noviembre de 2015). "El tratamiento tópico con fórmulas que contienen coenzima Q10 mejora el nivel de Q10 de la piel y proporciona efectos antioxidantes" . Biofactors (Oxford, Inglaterra) . 41 (6): 383–390. doi : 10.1002 / biof.1239 . ISSN 0951-6433 . PMC 4737275 . PMID 26648450 .
- ^ Addor, Flavia Alvim Sant'anna (2017). "Antioxidantes en dermatología" . Anais Brasileiros de Dermatologia . 92 (3): 356–362. doi : 10.1590 / abd1806-4841.20175697 . ISSN 0365-0596 . PMC 5514576 . PMID 29186248 .
- ^ Blatt, Thomas; Wittern, Klaus-Peter; Wenck, Horst; Staeb, Franz (1 de marzo de 2004). "CoQ10, un energizante tópico para pieles envejecidas" . Revista de la Academia Estadounidense de Dermatología . 50 (3): P76. doi : 10.1016 / j.jaad.2003.10.628 . ISSN 0190-9622 .
- ^ Zhang, M .; Dang, L .; Guo, F .; Wang, X .; Zhao, W .; Zhao, R. (junio de 2012). "La coenzima Q (10) mejora la expresión de elastina dérmica, inhibe la producción de IL-1α y la síntesis de melanina in vitro" . Revista Internacional de Ciencias Cosméticas . 34 (3): 273–279. doi : 10.1111 / j.1468-2494.2012.00713.x . ISSN 1468-2494 . PMID 22339577 . S2CID 4664219 .
- ^ Hseu, You-Cheng; Ho, Yi-Geng; Mathew, Dony Chacko; Yen, Hung-Rong; Chen, Xuan-Zao; Yang, Hsin-Ling (1 de junio de 2019). "La actividad despigmentante in vitro e in vivo de la coenzima Q10 a través de la regulación a la baja de las vías de señalización de α-MSH y la inducción de genes antioxidantes mediados por Nrf2 / ARE en queratinocitos de piel irradiados con UVA" . Farmacología bioquímica . 164 : 299–310. doi : 10.1016 / j.bcp.2019.04.015 . ISSN 0006-2952 . PMID 30991050 .
- ^ Afonso, S .; Horita, K .; Sousa e Silva, JP; Almeida, IF; Amaral, MH; Lobão, PA; Costa, PC; Miranda, Margarida S .; Esteves da Silva, Joaquim CG; Sousa Lobo, JM (noviembre de 2014). "Fotodegradación de avobenzona: efecto estabilizador de antioxidantes" . Revista de Fotoquímica y Fotobiología. B, biología . 140 : 36–40. doi : 10.1016 / j.jphotobiol.2014.07.004 . ISSN 1873-2682 . PMID 25086322 .
- ^ Wu, Haiyou; Zhong, Zhangfeng; Lin, Sien; Qiu, Chuqun; Xie, Peitao; Lv, Simin; Cui, Liao; Wu, Tie (19 de agosto de 2020). "El protector solar de coenzima Q10 previene la progresión del daño cutáneo inducido por rayos ultravioleta en ratones" . BioMed Research International . 2020 : 1–8. doi : 10.1155 / 2020/9039843 . PMC 7453241 . PMID 32923487 .
- ^ Grether-Beck, Susanne; Marini, Alessandra; Jaenicke, Thomas; Krutmann, Jean (enero de 2015). "Fotoprotección eficaz de la piel humana contra la radiación infrarroja A mediante antioxidantes aplicados tópicamente: resultados de un estudio aleatorizado, doble ciego, controlado por vehículo" . Fotoquímica y Fotobiología . 91 (1): 248–250. doi : 10.1111 / php.12375 . ISSN 1751-1097 . PMID 25349107 . S2CID 206270691 .
- ^ Lim, Henry W .; Arellano-Mendoza, Maria-Ivonne; Stengel, Fernando (marzo de 2017). "Retos actuales en fotoprotección" . Revista de la Academia Estadounidense de Dermatología . 76 (3S1): S91 – S99. doi : 10.1016 / j.jaad.2016.09.040 . ISSN 1097-6787 . PMID 28038886 .
- ^ Sharma, A; Fonarow, GC; Butler, J; Ezekowitz, JA; Felker, GM (abril de 2016). "Coenzima Q10 e insuficiencia cardíaca: una revisión del estado de la técnica". Circulación: insuficiencia cardíaca . 9 (4): e002639. doi : 10.1161 / CIRCHEARTFAILURE.115.002639 . PMID 27012265 . S2CID 2034503 .
- ^ a b c d e f Boreková M, et al. (2008). "Beneficios nutritivos y para la salud de la coenzima Q10" . Revista Checa de Ciencias de la Alimentación . 26 (4): 229–241. doi : 10.17221 / 1122-cjfs .
- ^ Bentinger M, Tekle M, Dallner G (mayo de 2010). "Coenzima Q - biosíntesis y funciones". Comunicaciones de investigación bioquímica y biofísica . 396 (1): 74–9. doi : 10.1016 / j.bbrc.2010.02.147 . PMID 20494114 .
- ^ Espinós, Carmen; Felipo, Vicente; Palau, Francesc (2009). Enfermedades neuromusculares hereditarias: traducción de patomecanismos a terapias . Saltador. págs. 122ss. ISBN 978-90-481-2812-9. Consultado el 4 de enero de 2011 .
- ^ Meganathan R (septiembre de 2001). "Biosíntesis de ubiquinona en microorganismos" . Cartas de Microbiología FEMS . 203 (2): 131–9. doi : 10.1111 / j.1574-6968.2001.tb10831.x . PMID 11583838 .
- ^ a b Bhagavan HN, Chopra RK (mayo de 2006). "Coenzima Q10: absorción, captación tisular, metabolismo y farmacocinética". Investigación de Radicales Libres . 40 (5): 445–53. doi : 10.1080 / 10715760600617843 . PMID 16551570 . S2CID 39001523 .
- ^ Bogentoft 1991 [ verificación necesaria ]
- ^ Ochiai A, Itagaki S, Kurokawa T, Kobayashi M, Hirano T, Iseki K (agosto de 2007). "Mejora de la absorción intestinal de la coenzima q10 por la ingesta de alimentos" . Yakugaku Zasshi . 127 (8): 1251–4. doi : 10.1248 / yakushi.127.1251 . PMID 17666877 . [ verificación necesaria ]
- ^ a b c d Žmitek; et al. (2008). "Mejora de la biodisponibilidad de CoQ 10 " . Industria Agroalimentaria Hi Tech . 19 (4): 9. Archivado desde el original el 5 de octubre de 2011 . Consultado el 21 de octubre de 2008 .
- ^ Kishi, H .; Kanamori, N .; Nisii, S .; Hiraoka, E .; Okamoto, T .; Kishi, T. (1964). "Metabolismo y coenzima Q 10 exógena in vivo y biodisponibilidad de las preparaciones de coenzima Q 10 en Japón". Aspectos biomédicos y clínicos de la coenzima Q . Amsterdam: Elsevier. págs. 131-142.
- ↑ a b c Ozawa Y, Mizushima Y, Koyama I, Akimoto M, Yamagata Y, Hayashi H, Murayama H (abril de 1986). "Mejora de la absorción intestinal de la coenzima Q10 con una microesfera lipídica". Arzneimittel-Forschung . 36 (4): 689–90. PMID 3718593 .
- ^ Tomono Y, Hasegawa J, Seki T, Motegi K, Morishita N (octubre de 1986). "Estudio farmacocinético de la coenzima Q10 marcada con deuterio en el hombre". Revista Internacional de Farmacología Clínica, Terapia y Toxicología . 24 (10): 536–41. PMID 3781673 .
- ^ Mathiowitz E, Jacob JS, Jong YS, Carino GP, Chickering DE, Chaturvedi P, et al. (Marzo de 1997). "Microesferas biológicamente erosionables como posibles sistemas de administración de fármacos por vía oral". Naturaleza . 386 (6623): 410–4. Código Bibliográfico : 1997Natur.386..410M . doi : 10.1038 / 386410a0 . PMID 9121559 . S2CID 4324209 .
- ^ Hsu CH, Cui Z, Mumper RJ, Jay M (2003). "Preparación y caracterización de nanopartículas de coenzima Q10 novedosas diseñadas a partir de precursores de microemulsión" . AAPS PharmSciTech . 4 (3): E32. doi : 10.1208 / pt040332 . PMC 2750625 . PMID 14621964 . [ verificación necesaria ]
- ^ Joshi SS, Sawant SV, Shedge A, Halpner AD (enero de 2003). "Biodisponibilidad comparativa de dos nuevas preparaciones de coenzima Q10 en seres humanos". Revista Internacional de Farmacología Clínica y Terapéutica . 41 (1): 42–8. doi : 10.5414 / CPP41042 . PMID 12564745 . [ verificación necesaria ]
- ^ Kommuru TR, Ashraf M, Khan MA, Reddy IK (julio de 1999). "Estudios de estabilidad y bioequivalencia de dos formulaciones comercializadas de coenzima Q10 en perros beagle" . Boletín químico y farmacéutico . 47 (7): 1024–8. doi : 10.1248 / cpb.47.1024 . PMID 10434405 .
- ^ Bhagavan HN, Chopra RK (junio de 2007). "Respuesta de la coenzima Q10 en plasma a la ingestión oral de formulaciones de coenzima Q10". Mitocondria . 7 Supl (Supl): S78-88. doi : 10.1016 / j.mito.2007.03.003 . PMID 17482886 . [ verificación necesaria ]
- ^ US 6197349 , Westesen, K. & Siekmann, B., "Partículas con propiedades fisicoquímicas modificadas, su preparación y usos", publicado en 2001
- ^ US 4483873 , Ohashi, H .; Takami, T. & Koyama, N. et al., "Solución acuosa que contiene ubidecarenona", publicado en 1984
- ^ Zmitek J, Smidovnik A, Fir M, Prosek M, Zmitek K, Walczak J, Pravst I (2008). "Biodisponibilidad relativa de dos formas de una nueva coenzima Q10 soluble en agua". Anales de nutrición y metabolismo . 52 (4): 281–7. doi : 10.1159 / 000129661 . PMID 18645245 . S2CID 825159 .
- ^ Kagan, Daniel; Madhavi, Doddabele (2010). "Un estudio sobre la biodisponibilidad de un nuevo complejo de coenzima Q 10 -β-ciclodextrina de liberación sostenida ". Medicina Integrativa . 9 (1).
- ↑ a b c d e Morton RA (diciembre de 1958). "Ubiquinona". Naturaleza . 182 (4652): 1764–7. Código Bibliográfico : 1958Natur.182.1764M . doi : 10.1038 / 1821764a0 . PMID 13622652 .
- ^ Crane FL, Hatefi Y, Lester RL, Widmer C (julio de 1957). "Aislamiento de una quinona de mitocondrias de corazón de res". Biochimica et Biophysica Acta . 25 (1): 220–1. doi : 10.1016 / 0006-3002 (57) 90457-2 . PMID 13445756 .
- ^ Wolf DE, et al. (1958). "Estudios de estructura de coenzima QI en el grupo de coenzima Q". Revista de la Sociedad Química Estadounidense . 80 (17): 4752. doi : 10.1021 / ja01550a096 . ISSN 0002-7863 .
- ^ Mellors A, Tappel AL (julio de 1966). "Quinonas y quinoles como inhibidores de la peroxidación lipídica". Lípidos . 1 (4): 282–4. doi : 10.1007 / BF02531617 . PMID 17805631 . S2CID 2129339 .
- ^ a b c d e Pravst I, Zmitek K, Zmitek J (abril de 2010). "Contenidos de coenzima Q10 en alimentos y estrategias de fortificación". Revisiones críticas en ciencia de los alimentos y nutrición . 50 (4): 269–80. doi : 10.1080 / 10408390902773037 . PMID 20301015 . S2CID 38779392 .
- ^ Weber C, Bysted A, Hłlmer G (1997). "El contenido de coenzima Q10 de la dieta media danesa". Revista internacional de investigación sobre vitaminas y nutrición. Internationale Zeitschrift für Vitamin- und Ernahrungsforschung. Journal International de Vitaminologie et de Nutrition . 67 (2): 123–9. PMID 9129255 .
enlaces externos
- "Lista de ingredientes de CoQ 10 verificados por USP " . Convención de la Farmacopea de EE. UU. Archivado desde el original el 9 de febrero de 2009.
- "Coenzima Q 10 " . Instituto Nacional del Cáncer . 23 de septiembre de 2005.
- Bonakdar, Robert Alan; Guarneri, Erminia (15 de septiembre de 2005). "Coenzima Q 10 " . Médico de familia estadounidense . 72 (6): 1065–1070. PMID 16190504 .
- Antioxidantes
- 1,4-benzoquinonas
- Respiración celular
- Coenzimas
- Antioxidantes dietéticos
- Glucólisis
- Éteres de fenol
- Polienos