Hexacarbonilo de vanadio
 | |
| Nombres | |
|---|---|
| Nombre IUPAC hexacarbonilvanadio (0) | |
| Identificadores | |
| |
Modelo 3D ( JSmol ) | |
| CHEBI | |
| Tarjeta de información ECHA | 100.039.928 |
PubChem CID | |
| UNII | |
| |
| Propiedades | |
| C 6 O 6 V | |
| Masa molar | 219,00 g / mol |
| Apariencia | cristales azul verdosos soluciones amarillas |
| Densidad | 1,7 g / cm 3 |
| Punto de fusion | se descompone |
| Punto de ebullición | sublima a 50 ° C (122 ° F; 323 K) (15 mmHg) |
| insoluble | |
| Solubilidad en otros disolventes. | 5 g / L de hexano ; más soluble en diclorometano |
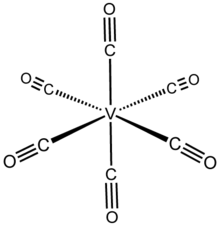
| Estructura | |
| ortorrómbico | |
| octaédrico | |
| 0 D | |
| Riesgos | |
| Principales peligros | Fuente de CO |
| Compuestos relacionados | |
Compuestos relacionados | Cr (CO) 6 , VCl 3 |
Salvo que se indique lo contrario, los datos se proporcionan para materiales en su estado estándar (a 25 ° C [77 ° F], 100 kPa). | |
| Referencias de Infobox | |
Vanadio hexacarbonilo es el compuesto inorgánico con la fórmula V (CO) 6 . Es un sólido volátil azul-negro. Esta especie altamente reactiva es digna de mención desde perspectivas teóricas como un raro carbonilo metálico homoléptico aislable que es paramagnético. La mayoría de las especies con la fórmula M x (CO) y siguen la regla de los 18 electrones , mientras que V (CO) 6 tiene 17 electrones de valencia. [1]
Síntesis
Tradicionalmente, V (CO) 6 se prepara en dos pasos mediante la intermediación de V (CO)-
6. En el primer paso, el VCl 3 se reduce con sodio metálico a 200 atm de CO a 160 ° C. El solvente para esta reducción es típicamente diglime , CH 3 OCH 2 CH 2 OCH 2 CH 2 OCH 3 . Este tri éter solubiliza sales de sodio, similar al comportamiento de un éter corona :
- 4 Na + VCl 3 + 6 CO + 2 diglyme → [Na (diglyme) 2 ] [V (CO) 6 ] + 3 NaCl
El anión resultante se oxida con ácido: [2]
- 2 V (CO)-
6+ 2 H 3 PO 4 → 2 V (CO) 6 + H 2 + 2 H
2correos-
4
Reacciones
El hexacarbonilo de vanadio es térmicamente inestable. Su reacción principal es la reducción al monoanión V (CO)-
6, sales de las cuales están bien estudiadas. También es susceptible de sustitución por ligandos de fosfina terciaria , lo que a menudo conduce a una desproporción .
V (CO) 6 reacciona con fuentes del anión ciclopentadienilo para dar el complejo de taburete de piano de cuatro patas naranja (C 5 H 5 ) V (CO) 4 (pf 136 ° C). Como muchos compuestos organometálicos de carga neutra, esta especie de medio sándwich es volátil. En la preparación original de esta especie, se empleó C 5 H 5 HgCl como fuente de C
5H-
5.
Estructura
V (CO) 6 adopta una geometría de coordinación octaédrica y es isoestructural con hexacarbonilo de cromo , aunque tienen diferentes recuentos de electrones de valencia. La cristalografía de rayos X de alta resolución indica que la molécula está ligeramente distorsionada con dos distancias V – C ( axiales ) más cortas de 1.993 (2) Å frente a cuatro (ecuatorial) 2.005 (2) Å. Aunque V (−I) es un ion más grande que V (0), las distancias V – C en V (CO)-
6son 0,07 Å más cortos que en el precursor neutro. [3]
Referencias
- ^ Elschenbroich, C .; Salzer, A. (1992). Organometálicos: una introducción concisa (2ª ed.). Weinheim: Wiley-VCH. ISBN 3-527-28165-7.
- ^ Liu, X .; Ellis, JE (2004). "Hexacarbonilvanadato (1−) y Hexacarbonilvanadio (0)". Inorg. Synth . 34 : 96-103. doi : 10.1002 / 0471653683.ch3 . ISBN 0-471-64750-0.
- ^ Bellard, S .; Rubinson, KA; Sheldrick, GM (1979). "Cristal y estructura molecular del vanadio hexacarbonilo" . Acta Crystallographica . B35 : 271–274. doi : 10.1107 / S0567740879003332 .
Otras lecturas
- Síntesis original: Ercoli, R .; Calderazzo, F .; Alberola, A. (1960). "Síntesis de vanadio hexacarbonilo". Mermelada. Chem. Soc . 81 : 2966-2967. doi : 10.1021 / ja01496a073 .
- Compuestos de vanadio
- Complejos de carbonilo