Cribado de dos híbridos
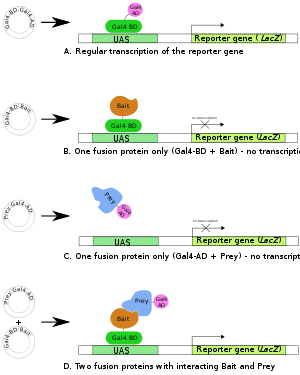
Una . El gen del factor de transcripción Gal4 produce una proteína de dos dominios ( BD y AD ) esencial para la transcripción del gen indicador ( LacZ ).
B , C . Se preparan dos proteínas de fusión: Gal4BD + Bait y Gal4AD + Prey . Ninguno de ellos suele ser suficiente para iniciar la transcripción (del gen informador) por sí solo.
D . Cuando se producen ambas proteínas de fusión y la parte de cebo de la primera proteína de fusión interactúa con la parte de presa de la segunda, se produce la transcripción del gen informador.
El cribado de dos híbridos (originalmente conocido como sistema de dos híbridos de levadura o Y2H ) es una técnica de biología molecular utilizada para descubrir interacciones proteína-proteína (PPI) [1] e interacciones proteína-ADN [2] [3] mediante la prueba de interacciones físicas (como la unión) entre dos proteínas o una sola proteína y una molécula de ADN , respectivamente.
La premisa detrás de la prueba es la activación de genes informadores descendentes mediante la unión de un factor de transcripción a una secuencia de activación ascendente (UAS). Para el cribado de dos híbridos, el factor de transcripción se divide en dos fragmentos separados, denominados dominio de unión al ADN (DBD o, a menudo, también abreviado como BD) y dominio de activación (AD). El BD es el dominio responsable de la unión a los UAS y el AD es el dominio responsable de la activación de la transcripción . [1] [2] El Y2H es, por tanto, un ensayo de complementación de fragmentos de proteína .
Historia
Iniciada por Stanley Fields y Ok-Kyu Song en 1989, la técnica fue diseñada originalmente para detectar interacciones proteína-proteína utilizando el activador transcripcional Gal4 de la levadura Saccharomyces cerevisiae . La proteína Gal4 activó la transcripción de un gen involucrado en la utilización de galactosa, que formó la base de la selección. [4] Desde entonces, el mismo principio se ha adaptado para describir muchos métodos alternativos, incluidos algunos que detectan interacciones proteína-ADN o interacciones ADN-ADN , así como métodos que utilizan diferentes organismos hospedadores como Escherichia coli o células de mamíferos en lugar de levadura.[3] [5]
Premisa basica
La clave para la selección de dos híbridos es que en la mayoría de los factores de transcripción eucariotas , los dominios de activación y unión son modulares y pueden funcionar en proximidad entre sí sin unión directa. [6] Esto significa que aunque el factor de transcripción se divide en dos fragmentos, aún puede activar la transcripción cuando los dos fragmentos están conectados indirectamente.
El método de detección más común es el ensayo de dos híbridos de levadura. En este enfoque, el investigador sabe dónde se encuentra cada presa en el medio utilizado (placas de agar). En la última década, se han examinado millones de interacciones potenciales en varios organismos utilizando sistemas de detección de alto rendimiento (a menudo con robots) y se han detectado y categorizado más de miles de interacciones en bases de datos como BioGRID . [7] [8] Este sistema a menudo utiliza una cepa de levadura modificada genéticamente en la que la biosíntesis de ciertos nutrientes (generalmente aminoácidos o ácidos nucleicos) esta falto de. Cuando se cultiva en un medio que carece de estos nutrientes, la levadura no sobrevive. Se puede hacer que esta cepa de levadura mutante incorpore ADN extraño en forma de plásmidos . En el cribado de dos híbridos de levadura, se introducen simultáneamente plásmidos de cebo y presa separados en la cepa de levadura mutante o se usa una estrategia de apareamiento para obtener ambos plásmidos en una célula huésped. [9]
El segundo enfoque de alto rendimiento es el enfoque de selección de bibliotecas. En esta configuración, las células que albergan el cebo y la presa se aparean en un orden aleatorio. Después de aparear y seleccionar las células supervivientes en un medio selectivo, el científico secuenciará los plásmidos aislados para ver qué presa (secuencia de ADN) está interactuando con el cebo utilizado. Este enfoque tiene una menor tasa de reproducibilidad y tiende a producir cantidades más altas de falsos positivos en comparación con el enfoque matricial. [9]
Los plásmidos están diseñados para producir un producto proteico en el que el fragmento del dominio de unión al ADN (BD) se fusiona con una proteína mientras que otro plásmido se modifica para producir un producto proteico en el que el fragmento del dominio de activación (AD) se fusiona con otra proteína. La proteína fusionada con la BD puede denominarse proteína cebo y, por lo general, es una proteína conocida que el investigador utiliza para identificar nuevos socios de unión. La proteína fusionada con la EA puede denominarse proteína de presa y puede ser una sola proteína conocida o una biblioteca de proteínas conocidas o desconocidas. En este contexto, una biblioteca puede consistir en una colección de secuencias que codifican proteínas que representan todas las proteínas expresadas en un organismo o tejido particular, o puede generarse sintetizando secuencias de ADN aleatorias. [3]Independientemente de la fuente, se incorporan posteriormente en la secuencia que codifica la proteína de un plásmido, que luego se transfecta en las células elegidas para el método de selección. [3] Esta técnica, cuando se usa una biblioteca, asume que cada célula se transfecta con un solo plásmido y que, por lo tanto, cada célula finalmente expresa no más de un miembro de la biblioteca de proteínas.
Si las proteínas de cebo y presa interactúan (es decir, se unen), entonces la AD y la BD del factor de transcripción están conectadas indirectamente, lo que lleva a la AD a la proximidad del sitio de inicio de la transcripción y puede producirse la transcripción de los genes informadores. Si las dos proteínas no interactúan, no hay transcripción del gen informador. De esta manera, una interacción exitosa entre la proteína fusionada está vinculada a un cambio en el fenotipo celular. [1]
El desafío de separar las células que expresan proteínas que interactúan con sus proteínas de fusión homólogas de aquellas que no lo hacen, se aborda en la siguiente sección.
Dominios fijos
En cualquier estudio, algunos de los dominios de proteínas, los que se están investigando, se variarán de acuerdo con los objetivos del estudio, mientras que otros dominios, los que no se están investigando, se mantendrán constantes. Por ejemplo, en un estudio de dos híbridos para seleccionar dominios de unión al ADN, se variará el dominio de unión al ADN, BD, mientras que las dos proteínas que interactúan, el cebo y la presa, deben mantenerse constantes para mantener una unión fuerte entre los BD y AD. Hay una serie de dominios entre los que elegir el BD, el cebo y la presa y el AD, si se desea que se mantengan constantes. En las investigaciones de interacción proteína-proteína, el BD puede elegirse de cualquiera de los muchos dominios fuertes de unión al ADN, como Zif268 . [2]Una elección frecuente de dominios de cebo y presa son los residuos 263-352 de la levadura Gal11P con una mutación N342V [2] y los residuos 58-97 de la levadura Gal4, [2] respectivamente. Estos dominios se pueden usar en técnicas de selección basadas tanto en levaduras como en bacterias y se sabe que se unen fuertemente. [1] [2]
La EA elegida debe poder activar la transcripción del gen informador, utilizando la propia maquinaria de transcripción de la célula. Por tanto, la variedad de AD disponibles para su uso en técnicas basadas en levaduras puede no ser adecuada para su uso en sus análogos basados en bacterias. La EA derivada del virus del herpes simple, VP16 y la levadura Gal4 AD se han utilizado con éxito en levaduras [1], mientras que una parte de la subunidad α de la ARN polimerasa de E. coli se ha utilizado en métodos basados en E. coli . [2] [3]
Mientras que los dominios de activación poderosa pueden permitir una mayor sensibilidad hacia interacciones más débiles, a la inversa, una AD más débil puede proporcionar una mayor rigurosidad.
Construcción de plásmidos de expresión
Se deben incorporar varias secuencias genéticas diseñadas en la célula huésped para realizar análisis de dos híbridos o una de sus técnicas derivadas. Las consideraciones y métodos usados en la construcción y entrega de estas secuencias difieren según las necesidades del ensayo y el organismo elegido como base experimental.
Hay dos amplias categorías de bibliotecas híbridas: bibliotecas aleatorias y bibliotecas basadas en cDNA. Una biblioteca de ADNc está constituida por el ADNc producido a través de la transcripción inversa del ARNm recogido de células específicas de tipos de células. Esta biblioteca se puede ligar en una construcción de modo que se adhiera al BD o AD que se usa en el ensayo. [1] Una biblioteca aleatoria utiliza longitudes de ADN de secuencia aleatoria en lugar de estas secciones de ADNc. Existen varios métodos para la producción de estas secuencias aleatorias, incluida la mutagénesis en casete . [2] Independientemente de la fuente de la biblioteca de ADN, se liga en el lugar apropiado en el plásmido / fagémido relevante usando el apropiadoendonucleasas de restricción . [2]
Consideraciones específicas de E. coli
Al colocar las proteínas híbridas bajo el control de promotores lac inducibles por IPTG , se expresan solo en medios suplementados con IPTG. Además, al incluir diferentes genes de resistencia a antibióticos en cada construcción genética, el crecimiento de células no transformadas se evita fácilmente mediante cultivo en medios que contienen los antibióticos correspondientes. Esto es particularmente importante para los métodos de contra selección en los que se necesita una falta de interacción para la supervivencia celular. [2]
El gen informador puede insertarse en el genoma de E. coli insertándolo primero en un episoma , un tipo de plásmido con la capacidad de incorporarse al genoma de la célula bacteriana [2] con un número de copias de aproximadamente una por célula. [10]
Los fagémidos de expresión híbridos pueden electroporarse en células de E. coli XL-1 Blue que, después de la amplificación e infección con el fago auxiliar VCS-M13 , producirán una reserva de fago de biblioteca. Cada uno de estos fagos contendrá un miembro monocatenario de la biblioteca de fagémidos. [2]
Recuperación de información proteica
Una vez realizada la selección, se debe determinar la estructura primaria de las proteínas que presentan las características adecuadas. Esto se logra mediante la recuperación de las secuencias que codifican proteínas (como se insertaron originalmente) de las células que muestran el fenotipo apropiado.
E. coli
El fagémido usado para transformar las células de E. coli se puede "rescatar" de las células seleccionadas infectándolas con el fago auxiliar VCS-M13. Las partículas de fago resultantes que se producen contienen los fagémidos monocatenarios y se utilizan para infectar células XL-1 Blue. [2] Los fagémidos bicatenarios se recolectan posteriormente de estas células XL-1 Blue, esencialmente invirtiendo el proceso utilizado para producir el fago de la biblioteca original. Finalmente, las secuencias de ADN se determinan mediante secuenciación didesoxi . [2]
Controlando la sensibilidad
El represor de Tet-R derivado de Escherichia coli se puede usar en línea con un gen indicador convencional y se puede controlar mediante tetraciclina o doxiciclina (inhibidores de Tet-R). Por tanto, la expresión de Tet-R está controlada por el sistema estándar de dos híbridos, pero el Tet-R a su vez controla (reprime) la expresión de un informador mencionado anteriormente, como HIS3 , a través de su promotor Tet-R. A continuación, se pueden usar tetraciclina o sus derivados para regular la sensibilidad de un sistema que utiliza Tet-R. [1]
La sensibilidad también puede controlarse variando la dependencia de las células de sus genes indicadores. Por ejemplo, esto puede verse afectado alterando la concentración de histidina en el medio de crecimiento para las células dependientes de his3 y alterando la concentración de estreptomicina para las células dependientes de aadA . [2] [3] La dependencia del gen de selección también puede controlarse aplicando un inhibidor del gen de selección a una concentración adecuada. El 3-amino-1,2,4-triazol (3-AT), por ejemplo, es un inhibidor competitivo del producto del gen HIS3 y puede usarse para valorar el nivel mínimo de expresión de HIS3 requerido para el crecimiento en medios deficientes en histidina. [2]
La sensibilidad también se puede modular variando el número de secuencias operadoras en el ADN informador.
Proteínas de no fusión
Una tercera proteína que no es de fusión puede coexpresarse con dos proteínas de fusión. Dependiendo de la investigación, la tercera proteína puede modificar una de las proteínas de fusión o mediar o interferir con su interacción. [1]
La coexpresión de la tercera proteína puede ser necesaria para la modificación o activación de una o ambas proteínas de fusión. Por ejemplo, S. cerevisiae no posee tirosina quinasa endógena. Si una investigación involucra una proteína que requiere fosforilación de tirosina, la quinasa debe suministrarse en forma de gen de tirosina quinasa. [1]
La proteína de no fusión puede mediar en la interacción uniendo ambas proteínas de fusión simultáneamente, como en el caso de la dimerización del receptor dependiente de ligando. [1]
Para una proteína con un compañero que interactúa, su homología funcional con otras proteínas puede evaluarse suministrando la tercera proteína en forma de no fusión, que luego puede o no competir con la proteína de fusión por su compañero de unión. La unión entre la tercera proteína y la otra proteína de fusión interrumpirá la formación del complejo de activación de la expresión del informador y, por tanto, reducirá la expresión del informador, lo que conducirá al cambio distintivo en el fenotipo. [1]
Levadura de ubiquitina dividida de dos híbridos
Una limitación de las pantallas clásicas de dos híbridos de levadura es que se limitan a proteínas solubles. Por tanto, es imposible utilizarlos para estudiar las interacciones proteína-proteína entre proteínas de membrana integrales insolubles . El sistema de ubiquitina dividida proporciona un método para superar esta limitación. [11] En el sistema de ubiquitina dividida, dos proteínas de membrana integrales que se estudiarán se fusionan con dos restos de ubiquitina diferentes : un resto de ubiquitina C-terminal ("Cub", residuos 35-76) y un resto de ubiquitina N-terminal (" Nub ", residuos 1-34). Estas proteínas fusionadas se denominan cebo y presa, respectivamente. Además de fusionarse con una proteína de membrana integral, el resto Cub también se fusiona con un factor de transcripción(TF) que pueden escindirse mediante proteasas específicas de ubiquitina . Tras la interacción cebo-presa, las fracciones Nub y Cub se ensamblan, reconstituyendo la ubiquitina dividida. La molécula de ubiquitina dividida reconstituida es reconocida por proteasas específicas de ubiquitina, que escinden el factor de transcripción, lo que le permite inducir la transcripción de genes indicadores . [12]
Ensayo fluorescente de dos híbridos
Zolghadr y colaboradores presentaron un sistema fluorescente de dos híbridos que utiliza dos proteínas híbridas que se fusionan con diferentes proteínas fluorescentes, así como con LacI, el represor lac . La estructura de las proteínas de fusión se ve así: FP2-LacI-cebo y FP1-presa donde las proteínas de cebo y presa interactúan y traen las proteínas fluorescentes (FP1 = GFP , FP2 = mCherry ) en estrecha proximidad en el sitio de unión del LacI proteína en el genoma de la célula huésped. [13] El sistema también se puede utilizar para detectar inhibidores de interacciones proteína-proteína. [14]
Sistemas enzimáticos de dos híbridos: KISS
Mientras que el sistema Y2H original usaba un factor de transcripción reconstituido, otros sistemas crean actividades enzimáticas para detectar IBP. Por ejemplo, el sensor de sustrato de quinasa ("KISS"), es un enfoque de dos híbridos de mamíferos que se ha diseñado para mapear los PPI intracelulares. Aquí, una proteína de cebo se fusiona con una porción de TYK2 que contiene quinasa y una presa se acopla a un fragmento de receptor de citocina gp130 . Cuando el cebo y la presa interactúan, TYK2 fosforila los sitios de acoplamiento de STAT3 en la quimera de la presa, lo que finalmente conduce a la activación de un gen indicador . [15]
Variantes de uno, tres y uno-dos híbridos
Un híbrido
La variación de un híbrido de esta técnica está diseñada para investigar las interacciones proteína-ADN y utiliza una única proteína de fusión en la que la EA está vinculada directamente al dominio de unión. Sin embargo, el dominio de unión en este caso no es necesariamente de secuencia fija como en el análisis proteína-proteína de dos híbridos, sino que puede estar constituido por una biblioteca. Esta biblioteca se puede seleccionar frente a la secuencia diana deseada, que se inserta en la región promotora de la construcción del gen indicador. En un sistema de selección positiva, se selecciona así un dominio de unión que se une con éxito al UAS y permite la transcripción. [1]
Tenga en cuenta que la selección de dominios de unión al ADN no se realiza necesariamente usando un sistema de un híbrido, sino que también se puede realizar usando un sistema de dos híbridos en el que el dominio de unión se varía y las proteínas de cebo y presa se mantienen constantes. [2] [3]
Tres híbridos
Las interacciones ARN-proteína se han investigado mediante una variación de tres híbridos de la técnica de dos híbridos. En este caso, una molécula de ARN híbrida sirve para unir los dos dominios de fusión de proteínas, que no están destinados a interactuar entre sí, sino a la molécula de ARN intermediaria (a través de sus dominios de unión al ARN). [1] Las técnicas que involucran proteínas que no son de fusión y que realizan una función similar, como se describe en la sección anterior sobre "proteínas que no son de fusión", también pueden denominarse métodos de tres híbridos.
Uno-dos-híbrido
El uso simultáneo de los métodos de uno y dos híbridos (es decir, interacción simultánea proteína-proteína y proteína-ADN) se conoce como un enfoque de uno-dos híbridos y se espera que aumente la rigurosidad del cribado. [1]
Organismo hospedante
Aunque teóricamente, cualquier célula viva podría usarse como base para un análisis de dos híbridos, existen consideraciones prácticas que dictan cuál se elige. La línea celular elegida debe ser relativamente barata y fácil de cultivar y suficientemente robusta para resistir la aplicación de los métodos de investigación y reactivos. [1] Esto último es especialmente importante para realizar estudios de alto rendimiento . Por tanto, la levadura S. cerevisiae ha sido el principal organismo huésped para estudios de dos híbridos. Sin embargo, no siempre es el sistema ideal para estudiar proteínas que interactúan de otros organismos. [dieciséis]Las células de levadura a menudo no tienen las mismas modificaciones postraduccionales, tienen un uso de codón diferente o carecen de ciertas proteínas que son importantes para la expresión correcta de las proteínas. Para hacer frente a estos problemas, se han desarrollado varios sistemas novedosos de dos híbridos. Dependiendo del sistema utilizado, se utilizan placas de agar o medio de cultivo específico para hacer crecer las células y permitir la selección para la interacción. El método utilizado más común es el de placas de agar, en el que las células se cultivan en placas en un medio selectivo para ver si tiene lugar la interacción. Las células que no tienen proteínas de interacción no deberían sobrevivir en este medio selectivo. [7] [17]
S. cerevisiae (levadura)
La levadura S. cerevisiae fue el organismo modelo utilizado durante el inicio de la técnica de dos híbridos. Se conoce comúnmente como el sistema Y2H. Tiene varias características que lo convierten en un organismo robusto para albergar la interacción, incluida la capacidad de formar estructuras de proteínas terciarias, pH interno neutro, capacidad mejorada para formar enlaces disulfuro y glutatión en estado reducido, entre otros factores tampón citosólicos, para mantener un ambiente interno hospitalario. medio ambiente. [1] El modelo de levadura puede manipularse mediante técnicas no moleculares y se conoce su secuencia completa del genoma. [1] Los sistemas de levadura son tolerantes a diversas condiciones de cultivo y productos químicos agresivos que no podrían aplicarse a cultivos de tejidos de mamíferos. [1]
Se han creado varias cepas de levadura específicamente para las pantallas Y2H, por ejemplo, Y187 [18] y AH109 , [19] ambas producidas por Clontech . También se han utilizado las cepas de levadura R2HMet y BK100. [20]
Candida albicans
C. albicans es una levadura con una característica particular: traduce el codón CUG en serina en lugar de leucina. Debido a este uso diferente de codones, es difícil usar el sistema modelo S. cerevisiae como Y2H para verificar las interacciones proteína-proteína usandogenes de C. albicans . Para proporcionar un entorno más nativo, se desarrolló un sistema dedos híbridos (C2H) de C. albicans . Con este sistema se pueden estudiar interacciones proteína-proteína en lapropia C. albicans . [21] [22] Una adición reciente fue la creación de un sistema de alto rendimiento. [23] [24] [25]
E. coli
Los dos métodos híbridos bacterianos (B2H o BTH) generalmente se llevan a cabo en E. coli y tienen algunas ventajas sobre los sistemas basados en levadura. Por ejemplo, la mayor eficiencia de transformación y la tasa de crecimiento más rápida hacen que E. coli utilice bibliotecas más grandes (más de 10 8 ). [2] La ausencia de requisitos para incluir una señal de localización nuclear en la secuencia de proteínas y la capacidad de estudiar proteínas que serían tóxicas para la levadura también pueden ser factores importantes a considerar al elegir un organismo de base experimental. [2]
La actividad de metilación de ciertas proteínas de ADN metiltransferasa de E. coli puede interferir con algunas selecciones de proteínas de unión al ADN. Si esto se anticipa, el uso de una cepa de E. coli que sea defectuosa para una metiltransferasa particular puede ser una solución obvia. [2] El B2H puede no ser ideal cuando se estudian interacciones proteína-proteína eucariotas (por ejemplo, proteínas humanas) ya que las proteínas pueden no plegarse como en las células eucariotas o pueden carecer de otro procesamiento.
Células mamíferas
En los últimos años, se ha diseñado un sistema de dos híbridos de mamíferos (M2H) para estudiar las interacciones proteína-proteína de los mamíferos en un entorno celular que imita de cerca el entorno de la proteína nativa. [26] En este sistema se utilizan células de mamíferos transfectadas transitoriamente para encontrar interacciones proteína-proteína. [27] [28] El uso de una línea celular de mamíferos para estudiar las interacciones proteína-proteína de los mamíferos ofrece la ventaja de trabajar en un contexto más nativo. [5] Las modificaciones postraduccionales, fosforilación, acilación y glicosilación son similares. La localización intracelular de las proteínas también es más correcta en comparación con el uso de un sistema de dos híbridos de levadura. [29] [30]También es posible con el sistema de dos híbridos de mamíferos estudiar las entradas de señal. [31] Otra gran ventaja es que los resultados se pueden obtener dentro de las 48 horas posteriores a la transfección. [5]
Arabidopsis thaliana
En 2005 se desarrolló un sistema de dos híbridos en plantas. El uso de protoplastos de interacciones proteína-proteína de A. thaliana se puede estudiar en plantas. De esta manera, las interacciones se pueden estudiar en su contexto nativo. En este sistema, GAL4 AD y BD están bajo el control del fuerte promotor 35S. La interacción se mide utilizando un reportero GUS. Para permitir un cribado de alto rendimiento, los vectores se hicieron compatibles con la pasarela. El sistema se conoce como sistema de protoplastos dos híbridos (P2H). [32]
Aplysia californica
La liebre marina A californica es un organismo modelo en neurobiología para estudiar, entre otros, los mecanismos moleculares de la memoria a largo plazo. Para estudiar interacciones, importantes en neurología, en un entorno más nativo se ha desarrollado un sistema de dos híbridos en neuronas de A. californica . En este sistema se utilizan GAL4 AD y BD. [33] [34]
Bombyx mori
Se desarrolló un sistema insecto de dos híbridos (I2H) en una línea celular de gusano de seda de la larva u oruga de la polilla de la seda domesticada, Bombyx mori (células BmN4). Este sistema utiliza el GAL4 BD y el dominio de activación del ratón NF-κB P65. Ambos están bajo el control del promotor OpIE2. [35]
Aplicaciones
Determinación de secuencias cruciales para la interacción.
Al cambiar los aminoácidos específicos mediante la mutación de los pares de bases de ADN correspondientes en los plásmidos utilizados, se puede determinar la importancia de esos residuos de aminoácidos para mantener la interacción. [1]
Después de utilizar un método basado en células bacterianas para seleccionar proteínas de unión al ADN, es necesario comprobar la especificidad de estos dominios, ya que existe un límite en la medida en que el genoma de la célula bacteriana puede actuar como sumidero de dominios con afinidad por otros. secuencias (o de hecho, una afinidad general por el ADN). [2]
Descubrimiento de drogas y venenos
Las interacciones de señalización proteína-proteína plantean dianas terapéuticas adecuadas debido a su especificidad y omnipresencia. El enfoque de descubrimiento aleatorio de fármacos utiliza bancos de compuestos que comprenden estructuras químicas aleatorias y requiere un método de alto rendimiento para probar estas estructuras en su objetivo previsto. [1] [17]
La célula elegida para la investigación puede diseñarse específicamente para reflejar el aspecto molecular que el investigador pretende estudiar y luego usarse para identificar nuevos agentes terapéuticos o anti-plagas para humanos o animales. [1] [17]
Determinación de la función de las proteínas.
Mediante la determinación de los socios de interacción de proteínas desconocidas, se pueden inferir las posibles funciones de estas nuevas proteínas. [1] Esto se puede hacer usando una sola proteína conocida contra una biblioteca de proteínas desconocidas o, a la inversa, seleccionando de una biblioteca de proteínas conocidas usando una sola proteína de función desconocida. [1]
Selección de proteínas con dedos de zinc
Para seleccionar proteínas con dedos de zinc (ZFP) para la ingeniería de proteínas , se han utilizado con éxito métodos adaptados de la técnica de cribado de dos híbridos. [2] [3] Una ZFP es en sí misma una proteína de unión al ADN que se utiliza en la construcción de dominios de unión al ADN personalizados que se unen a una secuencia de ADN deseada. [36]
Mediante el uso de un gen de selección con la secuencia diana deseada incluida en el UAS, y aleatorizando las secuencias de aminoácidos relevantes para producir una biblioteca ZFP, se pueden seleccionar células que albergan una interacción ADN-ZFP con las características requeridas. Cada ZFP normalmente reconoce sólo 3-4 pares de bases, por lo que para evitar el reconocimiento de sitios fuera del UAS, el ZFP aleatorizado se diseña en un "andamio" que consta de otras dos ZFP de secuencia constante. Por tanto, el UAS está diseñado para incluir la secuencia objetivo del andamio constante además de la secuencia para la que se selecciona una ZFP. [2] [3]
También pueden investigarse varios otros dominios de unión al ADN usando este sistema. [2]
Fortalezas
- Las pantallas de dos híbridos son de baja tecnología; se pueden realizar en cualquier laboratorio sin equipos sofisticados.
- Las pantallas de dos híbridos pueden proporcionar una primera pista importante para la identificación de los socios de interacción.
- El ensayo es escalable, lo que permite detectar interacciones entre muchas proteínas. Además, se puede automatizar y, mediante el uso de robots, muchas proteínas se pueden cribar frente a miles de proteínas potencialmente interactuantes en un tiempo relativamente corto. Se utilizan dos tipos de pantallas grandes: el enfoque de biblioteca y el enfoque matricial.
- Los datos de dos híbridos de levadura pueden ser de calidad similar a los datos generados por el enfoque alternativo de purificación por coafinidad seguida de espectrometría de masas (AP / MS). [37] [9]
Debilidades
- La principal crítica aplicada a la selección de levaduras de dos híbridos de interacciones proteína-proteína es la posibilidad de un alto número de identificaciones falsas positivas (y falsas negativas). Se desconoce la tasa exacta de resultados falsos positivos, pero las estimaciones anteriores llegaban al 70%. Esto también explica, en parte, el solapamiento muy pequeño que a menudo se encuentra en los resultados cuando se usa un cribado de dos híbridos (de alto rendimiento), especialmente cuando se usan diferentes sistemas experimentales. [9] [28]
La razón de esta alta tasa de error radica en las características de la pantalla:
- Ciertas variantes de ensayo sobreexpresan las proteínas de fusión que pueden causar concentraciones de proteínas no naturales que conducen a positivos inespecíficos (falsos).
- Las proteínas híbridas son proteínas de fusión; es decir, las partes fusionadas pueden inhibir ciertas interacciones, especialmente si una interacción tiene lugar en el extremo N-terminal de una proteína de prueba (donde el dominio de activación o de unión al ADN suele estar unido).
- Es posible que no se produzca una interacción en la levadura, el organismo huésped típico del Y2H. Por ejemplo, si se prueba una proteína bacteriana en levadura, es posible que carezca de una chaperona para el plegado adecuado que solo está presente en su huésped bacteriano. Además, una proteína de mamífero a veces no se modifica correctamente en la levadura (p. Ej., Falta la fosforilación ), lo que también puede conducir a resultados falsos.
- El Y2H tiene lugar en el núcleo. Si las proteínas de prueba no están localizadas en el núcleo (porque tienen otras señales de localización), se puede encontrar que dos proteínas que interactúan no interactúan.
- Algunas proteínas pueden interactuar específicamente cuando se coexpresan en la levadura, aunque en realidad nunca están presentes en la misma célula al mismo tiempo. Sin embargo, en la mayoría de los casos no se puede descartar que dichas proteínas se expresen efectivamente en determinadas células o en determinadas circunstancias.
Cada uno de estos puntos por sí solo puede dar lugar a resultados falsos. Debido a los efectos combinados de todas las fuentes de error, la levadura de dos híbridos debe interpretarse con precaución. La probabilidad de generar falsos positivos significa que todas las interacciones deben confirmarse mediante un ensayo de alta confianza, por ejemplo , la coinmunoprecipitación de las proteínas endógenas, lo que es difícil para los datos de interacción proteína-proteína a gran escala. Alternativamente, los datos de Y2H se pueden verificar utilizando múltiples variantes de Y2H [38] o técnicas bioinformáticas. La última prueba si las proteínas que interactúan se expresan al mismo tiempo, comparten algunas características comunes (como anotaciones de ontología genética o ciertas topologías de red ), tienen interacciones homólogas en otras especies.[39]
Ver también
- Presentación de fagos , un método alternativo para detectar interacciones proteína-proteína y proteína-ADN
- Matriz de proteínas , un método basado en chips para detectar interacciones proteína-proteína
- Análisis de matrices genéticas sintéticas , un método basado en levaduras para estudiar interacciones genéticas
Referencias
- ^ a b c d e f g h i j k l m n o p q r s t u v w Young KH (febrero de 1998). "Levadura de dos híbridos: tantas interacciones, (en) tan poco tiempo" . Biología de la reproducción . 58 (2): 302-11. doi : 10.1095 / biolreprod58.2.302 . PMID 9475380 .
- ^ a b c d e f g h i j k l m n o p q r s t u v w x Joung JK, Ramm EI, Pabo CO (junio de 2000). "Un sistema de selección bacteriana de dos híbridos para el estudio de interacciones proteína-ADN y proteína-proteína" . Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 97 (13): 7382–7. Código bibliográfico : 2000PNAS ... 97.7382J . doi : 10.1073 / pnas.110149297 . PMC 16554 . PMID 10852947 .
- ^ a b c d e f g h i Hurt JA, Thibodeau SA, Hirsh AS, Pabo CO, Joung JK (octubre de 2003). "Proteínas de dedos de zinc altamente específicas obtenidas por mezcla de dominios dirigida y selección basada en células" . Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 100 (21): 12271–6. Código Bibliográfico : 2003PNAS..10012271H . doi : 10.1073 / pnas.2135381100 . PMC 218748 . PMID 14527993 .
- ^ Fields S, Song O (julio de 1989). "Un nuevo sistema genético para detectar interacciones proteína-proteína". Naturaleza . 340 (6230): 245–6. Código Bibliográfico : 1989Natur.340..245F . doi : 10.1038 / 340245a0 . PMID 2547163 . S2CID 4320733 . El resumen es gratis; el artículo de texto completo no lo es.
- ^ a b c Luo Y, Batalao A, Zhou H, Zhu L (febrero de 1997). "Sistema de dos híbridos de mamíferos: un enfoque complementario al sistema de dos híbridos de levadura" . BioTechniques . 22 (2): 350–2. doi : 10.2144 / 97222pf02 . PMID 9043710 .
- ↑ Verschure PJ, Visser AE, Rots MG (2006). Salga del ritmo: sistemas de control de genes epigenéticos y factores de transcripción diseñados . Avances en Genética. 56 . págs. 163–204. doi : 10.1016 / S0065-2660 (06) 56005-5 . ISBN 9780120176564. PMID 16735158 .[ enlace muerto ]
- ↑ a b Brückner A, Polge C, Lentze N, Auerbach D, Schlattner U (junio de 2009). "Levadura de dos híbridos, una poderosa herramienta para la biología de sistemas" . Revista Internacional de Ciencias Moleculares . 10 (6): 2763–88. doi : 10.3390 / ijms10062763 . PMC 2705515 . PMID 19582228 .
- ^ Gietz RD, Triggs-Raine B, Robbins A, Graham KC, Woods RA (julio de 1997). "Identificación de proteínas que interactúan con una proteína de interés: aplicaciones del sistema de dos híbridos de levadura". Bioquímica molecular y celular . 172 (1–2): 67–79. doi : 10.1023 / A: 1006859319926 . PMID 9278233 . S2CID 32413316 .
- ↑ a b c d Auerbach D, Stagljar I (2005). "Redes de interacción proteína-proteína de dos híbridos de levadura". Proteómica e interacciones proteína-proteína . Reseñas de proteínas. 3 . págs. 19–31. doi : 10.1007 / 0-387-24532-4_2 . ISBN 978-0-387-24531-7.
- ^ Whipple FW (agosto de 1998). "Análisis genético de proteínas de unión a ADN procariotas y eucariotas en Escherichia coli" . Investigación de ácidos nucleicos . 26 (16): 3700–6. doi : 10.1093 / nar / 26.16.3700 . PMC 147751 . PMID 9685485 .
- ^ Stagljar I, Korostensky C, Johnsson N, te Heesen S (abril de 1998). "Un sistema genético basado en split-ubiquitina para el análisis de interacciones entre proteínas de membrana in vivo" . Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 95 (9): 5187–92. Código bibliográfico : 1998PNAS ... 95.5187S . doi : 10.1073 / pnas.95.9.5187 . PMC 20236 . PMID 9560251 .
- ^ Snider J, Kittanakom S, Curak J, Stagljar I (febrero de 2010). "Sistema de doble híbrido de levadura de membrana basado en ubiquitina dividida (MITO): una poderosa herramienta para identificar interacciones proteína-proteína" . Revista de experimentos visualizados (36). doi : 10.3791 / 1698 . PMC 2818708 . PMID 20125081 .
- ^ Zolghadr K, Mortusewicz O, Rothbauer U, Kleinhans R, Goehler H, Wanker EE, Cardoso MC, Leonhardt H (noviembre de 2008). "Un ensayo fluorescente de dos híbridos para la visualización directa de interacciones de proteínas en células vivas" . Proteómica molecular y celular . 7 (11): 2279–87. doi : 10.1074 / mcp.M700548-MCP200 . PMID 18622019 .
- ^ Yurlova L, Derks M, Buchfellner A, Hickson I, Janssen M, Morrison D, Stansfield I, Brown CJ, Ghadessy FJ, Lane DP, Rothbauer U, Zolghadr K, Krausz E (abril de 2014). "El ensayo fluorescente de dos híbridos para detectar inhibidores de la interacción proteína-proteína en células vivas: dirigiéndose a la interacción de p53 con Mdm2 y Mdm4" . Revista de cribado biomolecular . 19 (4): 516-25. doi : 10.1177 / 1087057113518067 . PMID 24476585 .
- ^ Lievens S, Gerlo S, Lemmens I, De Clercq DJ, Risseeuw MD, Vanderroost N, De Smet AS, Ruyssinck E, Chevet E, Van Calenbergh S, Tavernier J (diciembre de 2014). "Sensor de sustrato de quinasa (KISS), un sensor de interacción de proteínas in situ de mamíferos" . Proteómica molecular y celular . 13 (12): 3332–42. doi : 10.1074 / mcp.M114.041087 . PMC 4256487 . PMID 25154561 .
- ^ Stynen B, Tournu H, Tavernier J, Van Dijck P (junio de 2012). "Diversidad en métodos genéticos in vivo para estudios de interacción proteína-proteína: desde el sistema de dos híbridos de levadura hasta el sistema de luciferasa dividida en mamíferos" . Revisiones de Microbiología y Biología Molecular . 76 (2): 331–82. doi : 10.1128 / MMBR.05021-11 . PMC 3372256 . PMID 22688816 .
- ↑ a b c Hamdi A, Colas P (febrero de 2012). "Métodos de dos híbridos de levadura y sus aplicaciones en el descubrimiento de fármacos" . Tendencias en Ciencias Farmacológicas . 33 (2): 109–18. doi : 10.1016 / j.tips.2011.10.008 . PMID 22130009 .
- ^ Fromont-Racine M, Rain JC, Legrain P (julio de 1997). "Hacia un análisis funcional del genoma de la levadura a través de exhaustivas pantallas de dos híbridos". Genética de la naturaleza . 16 (3): 277–82. doi : 10.1038 / ng0797-277 . PMID 9207794 . S2CID 32591856 .
- ^ Lu L, Horstmann H, Ng C, Hong W (diciembre de 2001). "Regulación de la estructura y función de Golgi por proteína 1 similar a ARF (Arl1)". Revista de ciencia celular . 114 (Pt 24): 4543–55. doi : 10.1242 / jcs.114.24.4543 . PMID 11792819 .
- ^ Khadka S, Vangeloff AD, Zhang C, Siddavatam P, Heaton NS, Wang L, Sengupta R, Sahasrabudhe S, Randall G, Gribskov M, Kuhn RJ, Perera R, LaCount DJ (diciembre de 2011). "Una red de interacción física del virus del dengue y proteínas humanas" . Proteómica molecular y celular . 10 (12): M111.012187. doi : 10.1074 / mcp.M111.012187 . PMC 3237087 . PMID 21911577 .
- ^ Schoeters, Floris; Van Dijck, Patrick (7 de agosto de 2019). "Interacciones proteína-proteína en Candida albicans" . Fronteras en microbiología . 10 : 1792. doi : 10.3389 / fmicb.2019.01792 . PMC 6693483 . PMID 31440220 .
- ^ Stynen B, Van Dijck P, Tournu H (octubre de 2010). "Un codón CUG adaptado sistema de dos híbridos para el hongo patógeno Candida albicans" . Investigación de ácidos nucleicos . 38 (19): e184. doi : 10.1093 / nar / gkq725 . PMC 2965261 . PMID 20719741 .
- ^ Schoeters, Floris; Munro, Carol A .; d'Enfert, Christophe; Van Dijck, Patrick; Mitchell, Aaron P. (22 de agosto de 2018). "Un sistema de dos híbridos de alto rendimiento" . mSphere . 3 (4). doi : 10.1128 / mSphere.00391-18 . PMC 6106057 . PMID 30135223 .
- ^ Legrand, Mélanie; Bachellier-Bassi, Sophie; Lee, Keunsook K; Chaudhari, Yogesh; Tournu, Hélène; Arbogast, Laurence; Boyer, Hélène; Chauvel, Murielle; Cabral, Vitor; Maufrais, Corinne; Nesseir, Audrey; Maslanka, Irena; Permal, Emmanuelle; Rossignol, Tristan; Walker, Louise A; Zeidler, Ute; Znaidi, Sadri; Schoeters, Floris; Majgier, Charlotte; Julien, Renaud A; Ma, Laurence; Tichit, Magali; Bouchier, Christiane; Van Dijck, Patrick; Munro, Carol A; d'Enfert, Christophe (10 de agosto de 2018). "Generación de plataformas genómicas para estudiar la patogénesis de Candida albicans" (PDF) . Investigación de ácidos nucleicos . 46 (16): 8664. doi : 10.1093 / nar / gky747 . PMC 6144791 . PMID 30107554 .
- ^ Schoeters, Floris; Van Dijck, Patrick (2019). "Interacciones proteína-proteína en Candida albicans" . Fronteras en microbiología . 10 : 1792. doi : 10.3389 / fmicb.2019.01792 . ISSN 1664-302X . PMC 6693483 . PMID 31440220 .
- ^ https://www.promega.com/-/media/files/resources/promega-notes/66/the-checkmatetm-mammalian-two-hybrid-system.pdf?la=en
- ^ Feng XH, Derynck R (2001). "Ensayos de dos híbridos de mamíferos: análisis de interacciones proteína-proteína en la transformación de la vía de señalización del factor de crecimiento β". Sistemas de dos híbridos . 177 . págs. 221-239. doi : 10.1385 / 1-59259-210-4: 221 . ISBN 978-1-59259-210-4. PMID 11530609 .
- ↑ a b Deane CM, Salwiński Ł, Xenarios I, Eisenberg D (mayo de 2002). "Interacciones de proteínas: dos métodos para evaluar la fiabilidad de las observaciones de alto rendimiento" . Proteómica molecular y celular . 1 (5): 349–56. doi : 10.1074 / mcp.M100037-MCP200 . PMID 12118076 .
- ^ Buckholz RG, Gleeson MA (noviembre de 1991). "Sistemas de levadura para la producción comercial de proteínas heterólogas". Bio / Tecnología . 9 (11): 1067–72. doi : 10.1038 / nbt1191-1067 . PMID 1367623 . S2CID 31597609 .
- ^ Fagan R, Flint KJ, Jones N (septiembre de 1994). "La fosforilación de E2F-1 modula su interacción con el producto del gen del retinoblastoma y la proteína adenoviral E4 de 19 kDa". Celular . 78 (5): 799–811. doi : 10.1016 / s0092-8674 (94) 90522-3 . PMID 8087847 . S2CID 22888513 .
- ^ Liu, junio O. (1998). "Todo lo que necesita saber sobre el sistema de dos híbridos de levadura". Biología estructural de la naturaleza . 5 (7): 535–536. doi : 10.1038 / 788 . S2CID 37127696 .
- ^ Ehlert A, Weltmeier F, Wang X, Mayer CS, Smeekens S, Vicente-Carbajosa J, Dröge-Laser W (junio de 2006). "Análisis de interacción proteína-proteína de dos híbridos en protoplastos de Arabidopsis: establecimiento de un mapa de heterodimerización de factores de transcripción bZIP del grupo C y del grupo S" . The Plant Journal . 46 (5): 890–900. doi : 10.1111 / j.1365-313X.2006.02731.x . PMID 16709202 .
- ^ Choi JH, Lee JA, Yim SW, Lim CS, Lee CH, Lee YD, Bartsch D, Kandel ER, Kaang BK (2003). "Utilizando un sistema aplysia de dos híbridos para examinar las interacciones entre los factores de transcripción implicados en la facilitación a largo plazo en el sistema nervioso de la aplysia" . Aprendizaje y memoria . 10 (1): 40–3. doi : 10.1101 / lm.55303 . PMC 196654 . PMID 12551962 .
- ^ Lee JA, Lee SH, Lee C, Chang DJ, Lee Y, Kim H, Cheang YH, Ko HG, Lee YS, Jun H, Bartsch D, Kandel ER, Kaang BK (septiembre de 2006). "El heterodímero ApAF-ApC / EBP activado por PKA es un efector descendente clave de ApCREB y es necesario y suficiente para la consolidación de la facilitación a largo plazo" . The Journal of Cell Biology . 174 (6): 827–38. doi : 10.1083 / jcb.200512066 . PMC 2064337 . PMID 16966424 .
- ^ Mon H, Sugahara R, Hong SM, Lee JM, Kamachi Y, Kawaguchi Y, Kusakabe T (septiembre de 2009). "Análisis de interacciones de proteínas con sistema de dos híbridos en células de insectos cultivadas". Bioquímica analítica . 392 (2): 180–2. doi : 10.1016 / j.ab.2009.05.033 . PMID 19481053 .
- ^ Gommans WM, Haisma HJ, Rots MG (diciembre de 2005). "Ingeniería de factores de transcripción de proteínas de dedos de zinc: la relevancia terapéutica de activar o desactivar la expresión génica endógena a voluntad" . Revista de Biología Molecular . 354 (3): 507-19. doi : 10.1016 / j.jmb.2005.06.082 . PMID 16253273 . [ enlace muerto permanente ]
- ^ Yu H, Braun P, Yildirim MA, Lemmens I, Venkatesan K, Sahalie J, Hirozane-Kishikawa T, Gebreab F, Li N, Simonis N, Hao T, Rual JF, Dricot A, Vazquez A, Murray RR, Simon C , Tardivo L, Tam S, Svrzikapa N, Fan C, de Smet AS, Motyl A, Hudson ME, Park J, Xin X, Cusick ME, Moore T, Boone C, Snyder M, Roth FP, Barabási AL, Tavernier J, Hill DE, Vidal M (octubre de 2008). "Mapa de interacción de proteínas binarias de alta calidad de la red del interactoma de levadura" . Ciencia . 322 (5898): 104–10. Código Bibliográfico : 2008Sci ... 322..104Y . doi : 10.1126 / science.1158684 . PMC 2746753 . PMID 18719252 .
- ^ Chen YC, Rajagopala SV, Stellberger T, Uetz P (septiembre de 2010). "Evaluación comparativa exhaustiva del sistema de dos híbridos de levadura". Métodos de la naturaleza . 7 (9): 667–8, respuesta del autor 668. doi : 10.1038 / nmeth0910-667 . PMID 20805792 . S2CID 35834541 .
- ^ Koegl M, Uetz P (diciembre de 2007). "Mejora de los sistemas de cribado de dos híbridos de levadura" . Sesiones informativas sobre genómica funcional y proteómica . 6 (4): 302–12. doi : 10.1093 / bfgp / elm035 . PMID 18218650 .
enlaces externos
| Recursos de la biblioteca sobre el cribado de dos híbridos |
|
- Detalle de la técnica hermana del sistema de dos híbridos
- Descripción general de Science Creative Quarterly del sistema híbrido de dos levaduras
- Pantallas híbridas de levadura One-Hybrid compatibles con Gateway
- Animación de video del sistema Yeast Two-Hybrid
- Two-Hybrid + System + Techniques en los encabezados de temas médicos (MeSH) de la Biblioteca Nacional de Medicina de EE. UU .
- Levadura de dos híbridos
- Base de datos BioGrid con interacciones proteína-proteína
- Biología Celular
- Biología Molecular
- Ensayos de interacción proteína-proteína
- Biologia de sistemas