Saltar a navegación Saltar a búsqueda
 Estructura del citrato férrico de amonio | |
 Estructura cristalina de (NH 4 ) 5 [Fe (C 6 H 4 O 7 ) 2 ] · 2H 2 O [1] | |
| Nombres | |
|---|---|
| Nombre IUPAC 2-hidroxipropano-1,2,3-tricarboxilato, sal de amonio y hierro (3+) | |
| Otros nombres Citrato férrico de amonio Citrato de amonio y hierro (III) Citrato de amonio férrico Citrato de hierro y amonio FerriSeltz | |
| Identificadores | |
| |
| CHEBI | |
| CHEMBL | |
| Tarjeta de información ECHA | 100.013.351 |
| Número CE |
|
| Número e | E381 (antioxidantes, ...) |
| KEGG | |
PubChem CID | |
| UNII | |
Tablero CompTox ( EPA ) | |
| |
| Propiedades | |
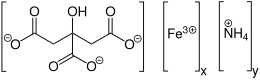
| C 6 H 8 O 7 ⋅ x Fe 3+ ⋅ y NH 3 | |
| Apariencia | cristales amarillos |
| Farmacología | |
| V08CA07 ( OMS ) | |
| Peligros | |
| Ficha de datos de seguridad | [1] |
Salvo que se indique lo contrario, los datos se proporcionan para materiales en su estado estándar (a 25 ° C [77 ° F], 100 kPa). | |
| Referencias de Infobox | |
El citrato férrico de amonio tiene la fórmula (NH 4 ) 5 [Fe (C 6 H 4 O 7 ) 2 ]. Una característica distintiva de este compuesto es que es muy soluble en agua, en contraste con el citrato férrico que no es muy soluble.
En su estructura cristalina, cada fracción de ácido cítrico ha perdido cuatro protones. El grupo hidroxilo desprotonado y dos de los grupos carboxilato se ligan al centro férrico, mientras que el tercer grupo carboxilato se coordina con el amonio. [1]
Usos [ editar ]
El citrato férrico de amonio tiene una variedad de usos, que incluyen:
- Como ingrediente alimentario, tiene un número SIN y se utiliza como regulador de la acidez [ cita requerida ] . Se utiliza principalmente en la bebida escocesa Irn-Bru .
- Purificación del agua.
- Como agente reductor de sales metálicas de baja actividad como el oro y la plata .
- Con ferricianuro de potasio como parte del proceso fotográfico de cianotipo .
- Se utiliza en las profundidades de hierro de Kligler para determinar la producción de sulfuro de hidrógeno en el metabolismo microbiano.
- En las imágenes médicas, el citrato férrico de amonio se utiliza como medio de contraste .
- Como hematínico . [3]
Ver también [ editar ]
- Aditivo alimentario
- Lista de aditivos alimentarios
Referencias [ editar ]
- ↑ a b Matzapetakis, M .; Raptopoulou, CP; Tsohos, A .; Papaefthymiou, V .; Luna, N .; Salifoglou, A. (1998). "Síntesis, caracterización espectroscópica y estructural del primer complejo mononuclear, soluble en agua de hierro-citrato, (NH 4 ) 5 Fe (C 6 H 4 O 7 ) 2 · 2H 2 O". Mermelada. Chem. Soc . 120 (50): 13266-13267. doi : 10.1021 / ja9807035 .
- ^ "KEGG DRUG: Citrato de amonio férrico" .
- ^ Budavari, Susan, ed. (2001), The Merck Index: An Encyclopedia of Chemicals, Drugs, and Biologicals (13a ed.), Merck, ISBN 0911910131