Haluro de arilo
En química orgánica , un haluro de arilo (también conocido como haloareno ) es un compuesto aromático en el que uno o más átomos de hidrógeno, unidos directamente a un anillo aromático , son reemplazados por un haluro . Los haloarenos son diferentes de los haloalcanos porque presentan muchas diferencias en los métodos de preparación y propiedades. Los miembros más importantes son los cloruros de arilo, pero la clase de compuestos es tan amplia que existen muchos derivados y aplicaciones.
Preparación
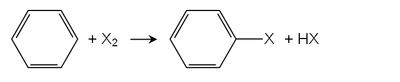
Las dos rutas preparatorias principales para haluros de arilo son la halogenación directa y las sales de diazonio. [1]
Halogenación directa
En la halogenación de Friedel-Crafts , los ácidos de Lewis sirven como catalizadores. Se utilizan muchos cloruros metálicos, los ejemplos incluyen cloruro de hierro (III) o cloruro de aluminio . El haluro de arilo más importante, el clorobenceno , se produce por esta vía. La monocloración de benceno siempre va acompañada de la formación de derivados de diclorobenceno. [2]
Los arenos con grupos donadores de electrones reaccionan con halógenos incluso en ausencia de ácidos de Lewis. Por ejemplo, los fenoles y las anilinas reaccionan rápidamente con el cloro y el agua con bromo para dar múltiples productos halogenados. [3] La decoloración del agua con bromo por arenos ricos en electrones se utiliza en la prueba de bromo .
La halogenación directa de arenos es posible en presencia de luz o a alta temperatura. Para los derivados de alquilbenceno, las posiciones de alquilo tienden a halogenarse primero en la halogenación de radicales libres. Para halogenar el anillo, se requieren ácidos de Lewis y se debe excluir la luz para evitar la reacción competitiva. [1]
Reacciones de Sandmeyer, Balz-Schiemann y Gattermann
La segunda ruta principal es la reacción de Sandmeyer . Las anilinas ( arilaminas ) se convierten en sus sales de diazonio utilizando ácido nitroso . Por ejemplo, el cloruro de cobre (I) convierte las sales de diazonio en cloruro de arilo. El nitrógeno gaseoso es el grupo saliente, lo que hace que esta reacción sea muy favorable. La reacción de Schiemann similar usa el anión tetrafluoroborato como donante de fluoruro. La reacción de Gatterman también se puede utilizar para convertir la sal de diazonio en clorobenceno o bromobenceno utilizando polvo de cobre en lugar de cloruro de cobre o bromuro de cobre. Pero esto debe hacerse en presencia de HCl y HBr respectivamente.
Halogenación en la naturaleza
Los haluros de arilo se encuentran ampliamente en la naturaleza, más comúnmente producidos por organismos marinos que utilizan el cloruro y el bromuro en las aguas del océano. Los compuestos aromáticos clorados y bromados también son numerosos, por ejemplo, derivados de tirosina, triptófano y diversos derivados de pirrol. Algunos de estos haluros de arilo de origen natural exhiben propiedades medicinales útiles. [4] [5]


Tendencias estructurales
Las distancias CX para los haluros de arilo siguen la tendencia esperada. Estas distancias para fluorobenceno, clorobenceno, bromobenceno y 4-yodobenzoato de metilo son 135,6 (4), 173,90 (23), 189,8 (1) y 209,9 pm , respectivamente. [6]
Reacciones
Sustitución
A diferencia de los haluros de alquilo típicos, los haluros de arilo normalmente no participan en reacciones de sustitución convencionales. Los haluros de arilo con grupos aceptores de electrones en las posiciones orto y para pueden sufrir reacciones S N Ar . Por ejemplo, el 2,4-dinitroclorobenceno reacciona en solución básica para dar un fenol:
A diferencia de la mayoría de las otras reacciones de sustitución, el fluoruro es el mejor grupo saliente y el yoduro el peor. [7] Un documento de 2018 indica que esta situación puede ser bastante común, ya que ocurre en sistemas que anteriormente se suponía que procedían a través de mecanismos S N Ar. [8]
Benceno
Los haluros de arilo a menudo reaccionan a través de la intermediación de bencinas . El clorobenceno y la amida de sodio reaccionan en el amoníaco líquido para dar anilina por esta vía.
Formación de reactivos organometálicos
Los haluros de arilo reaccionan con metales, generalmente litio o magnesio , para dar más derivados organometálicos que funcionan como fuentes de aniones arilo. Mediante la reacción de intercambio metal-halógeno , los haluros de arilo se convierten en compuestos de aril litio. Es ilustrativa la preparación de fenil litio a partir de bromobenceno usando butil litio (BuLi):
- C 6 H 5 Br + BuLi → C 6 H 5 Li + BuBr
La formación directa de reactivos de Grignard , mediante la adición de magnesio al haluro de arilo en una solución etérea, funciona bien si el anillo aromático no se desactiva significativamente por los grupos captadores de electrones.
Otras reacciones
Los haluros pueden ser desplazados por nucleófilos fuertes a través de reacciones que involucran aniones radicales. Alternativamente, los haluros de arilo, especialmente los bromuros y yoduros, experimentan una adición oxidativa y, por lo tanto, están sujetos a reacciones de tipo de aminación de Buchwald-Hartwig .
El clorobenceno fue una vez el precursor del fenol , que ahora se produce por oxidación del cumeno . A altas temperaturas, los grupos arilo reaccionan con el amoníaco para dar anilinas. [2]
Biodegradacion
Rhodococcus phenolicus es una bacteria que degrada el diclorobenceno como única fuente de carbono. [9]
Aplicaciones
Los haluros de arilo producidos a mayor escala son el clorobenceno y los isómeros del diclorobenceno. Una aplicación importante pero descontinuada fue el uso de clorobenceno como solvente para dispersar el herbicida Lasso. En general, la producción de cloruros de arilo (también derivados de naftilo) ha ido disminuyendo desde la década de 1980, en parte debido a preocupaciones ambientales. [2] La trifenilfosfina se produce a partir del clorobenceno:
- 3 C 6 H 5 Cl + PCl 3 + 6 Na → P (C 6 H 5 ) 3 + 6 NaCl
Los bromuros de arilo se utilizan ampliamente como retardadores del fuego. El miembro más destacado es el tetrabromobisfenol-A , que se prepara mediante bromación directa del difenol. [10]
Referencias
- ^ a b Boyd, Robert W .; Morrison, Robert (1992). Química orgánica . Englewood Cliffs, Nueva Jersey: Prentice Hall. pag. 947. ISBN 978-0-13-643669-0.
- ^ a b c Beck, U .; Löser, E. (2011). "Bencenos clorados y otros hidrocarburos aromáticos clorados de núcleo". Enciclopedia de química industrial de Ullmann . doi : 10.1002 / 14356007.o06_o03 . ISBN 978-3527306732.
- ^ Procedimiento ilustrativo para la cloración de un compuesto aromático: Edward R. Atkinson; Donald M. Murphy y James E. Lufkin (1951). "Ácido dl-4,4 ', 6,6'-tetraclorodifénico" . Síntesis orgánicas .; Volumen colectivo , 4 , p. 872
- ^ Fujimori, Danica Galonić; Walsh, Christopher T. (2007). "Novedades en halogenaciones enzimáticas" . Opinión actual en biología química . 11 (5): 553–60. doi : 10.1016 / j.cbpa.2007.08.002 . PMC 2151916 . PMID 17881282 .
- ^ Gribble, Gordon W. (2004). "Organohalógenos naturales: ¿una nueva frontera para los agentes medicinales?". Revista de educación química . 81 (10): 1441. Código bibliográfico : 2004JChEd..81.1441G . doi : 10.1021 / ed081p1441 .
- ^ Oberhammer, Heinz (2009). "La química estructural de enlaces carbono-halógeno". Química de grupos funcionales de PATai . doi : 10.1002 / 9780470682531.pat0002 . ISBN 978-0-470-68253-1.
- ^ Ritter, Tobías; Hooker, Jacob M .; Neumann, Constanze N. (junio de 2016). "Sustitución aromática nucleofílica concertada con 19F- y 18F-" . Naturaleza . 534 (7607): 369–373. Código bibliográfico : 2016Natur.534..369N . doi : 10.1038 / nature17667 . ISSN 1476-4687 . PMC 4911285 . PMID 27281221 .
- ↑ Jacobsen, Eric N .; Harrison A. Besser; Zeng, Yuwen; Kwan, Eugene E. (septiembre de 2018). "Sustituciones aromáticas nucleofílicas concertadas" . Química de la naturaleza . 10 (9): 917–923. Código bibliográfico : 2018NatCh..10..917K . doi : 10.1038 / s41557-018-0079-7 . ISSN 1755-4349 . PMC 6105541 . PMID 30013193 .
- ^ Rehfuss, Marc; Urbano, James (2005). " Rhodococcus phenolicus sp. Nov., Un nuevo bioprocesador aislado actinomiceto con la capacidad de degradar clorobenceno, diclorobenceno y fenol como fuentes únicas de carbono". Microbiología sistemática y aplicada . 28 (8): 695–701. doi : 10.1016 / j.syapm.2005.05.011 . PMID 16261859 .
- ^ Ioffe, D .; Kampf, A. (2002). "Bromo, compuestos orgánicos". Enciclopedia Kirk-Othmer de tecnología química . doi : 10.1002 / 0471238961.0218151325150606.a01 . ISBN 978-0471238966.
- Compuestos aromáticos
- Organohaluros