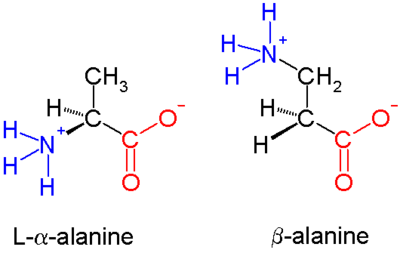
Los β-péptidos son péptidos derivados de β-aminoácidos. Los β-aminoácidos parentales son H 2 NCH 2 CH 2 CO 2 H pero la mayoría de los ejemplos presentan sustituyentes en lugar de uno o más enlaces CH. El único aminoácido β común de origen natural es la β-alanina . Los péptidos β en general no aparecen en la naturaleza. Se están explorando antibióticos basados en péptidos β como formas de evadir la resistencia a los antibióticos . [1] Los primeros estudios en este campo fueron publicados en 1996 por el grupo de Dieter Seebach [1] y el de Samuel Gellman. [2]
Síntesis [ editar ]
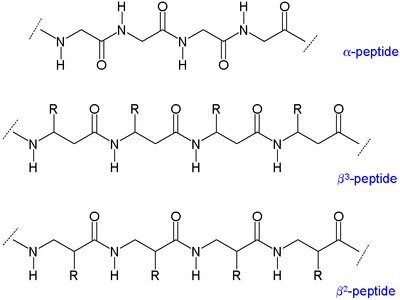
Existen dos tipos principales de péptidos β: los que tienen el residuo orgánico (R) junto a la amina se denominan péptidos β 3 y los que tienen una posición próxima al grupo carbonilo se denominan péptidos β 2 . [3]
Los β-aminoácidos se han preparado por muchas vías. [4] [5] en particular los basados en la síntesis de Arndt-Eistert .
Estructura secundaria [ editar ]
Debido a que sus cadenas principales son más largas que las de los péptidos normales , los péptidos β forman estructuras secundarias dispares . Los sustituyentes alquilo en las posiciones α y β en un aminoácido β favorecen una conformación torpe alrededor del enlace entre el carbono α y el carbono β. Esto también afecta la estabilidad termodinámica de la estructura.
Se han informado muchos tipos de estructuras de hélice que consisten en péptidos β. Estos tipos de conformación se distinguen por el número de átomos en el anillo con enlaces de hidrógeno que se forma en solución; Se ha informado de 8 hélices, 10 hélices, 12 hélices, 14 hélices, [6] y 10/12 hélices. En términos generales, los péptidos β forman una hélice más estable que los péptidos α. [7]
Potencial clínico [ editar ]
Los péptidos β son estables frente a la degradación proteolítica in vitro e in vivo , una ventaja potencial sobre los péptidos naturales. [8] Se han utilizado β-péptidos para imitar antibióticos basados en péptidos naturales como las magaininas , que son muy potentes pero difíciles de usar como fármacos porque son degradados por enzimas proteolíticas. [9]
Lista [ editar ]
Existen 8 formas beta: alanina, leucina, lisina, arginina, glutamato, glutamina, fenilalanina, formas de tirosina. [10] El ácido aspártico se considera tanto en forma beta como alfa, aunque la forma beta se encuentra en microcistinas . [10]
Ver también [ editar ]
Referencias [ editar ]
- ↑ a b Seebach D, Overhand M, Kühnle FNM, Martinoni B, Oberer L, Hommel U, Widmer H (junio de 1996). “β-Péptidos: Síntesis por homologación Arndt-Eistert con acoplamiento peptídico concomitante. Determinación de la estructura por espectroscopia de RMN y CD y por cristalografía de rayos X. Estructura secundaria helicoidal de un -hexapéptido en solución y su estabilidad frente a pepsina”. Helvetica Chimica Acta . 79 (4): 913–941. doi : 10.1002 / hlca.19960790402 .
- ^ Appella DH, Christianson LA, Karle IL, Powell DR, Gellman SH (1996). "Foldameros de péptidos β: formación de hélice robusta en una nueva familia de oligómeros de aminoácidos". Mermelada. Chem. Soc. 118 (51): 13071–2. doi : 10.1021 / ja963290l .
- ^ Seebach D, Matthews JL (1997). "β-Péptidos: una sorpresa a cada paso". Chem. Comun. (21): 2015–22. doi : 10.1039 / a704933a .
- ^ Basler B, Schuster O, Bach T (noviembre de 2005). "Derivados de β-aminoácidos conformacionalmente restringidos por [2 + 2] -fotocicloadición intramolecular de una amida de ácido tetrónico y posterior apertura del anillo de lactona". J. Org. Chem . 70 (24): 9798–808. doi : 10.1021 / jo0515226 . PMID 16292808 .
- ^ Murray JK, Farooqi B, Sadowsky JD, et al. (Septiembre de 2005). "Síntesis eficiente de una biblioteca combinatoria de péptidos β con irradiación de microondas". Mermelada. Chem. Soc . 127 (38): 13271–80. doi : 10.1021 / ja052733v . PMID 16173757 .
- ^ Vasantha, Basavalingappa; George, Gijo; Raghothama, Srinivasarao; Balaram, Padmanabhan (enero de 2017). "Péptidos de β3 (R) -valina homooligoméricos: Transformación entre estructuras helicoidales C14 y C12 inducida por un residuo Aib invitado" . Biopolímeros . 108 (1): e22935. doi : 10.1002 / bip.22935 . ISSN 1097-0282 . PMID 27539268 .
- ^ Gademann K, Hintermann T, Schreiber JV (octubre de 1999). "Beta-péptidos: retorciéndose y girando". Curr. Medicina. Chem . 6 (10): 905-25. PMID 10519905 .
- ^ Beke T, Somlai C, Perczel A (enero de 2006). "Hacia un diseño racional de estructuras de péptidos β". J Comput Chem . 27 (1): 20–38. doi : 10.1002 / jcc.20299 . PMID 16247761 .
- ^ Porter EA, Weisblum B, Gellman SH (2002). "Mimetismo de péptidos de defensa del huésped por oligómeros no naturales: péptidos β antimicrobianos". Mermelada. Chem. Soc. 124 (25): 7324-30. doi : 10.1021 / ja0260871 . PMID 12071741 .
- ^ a b Síntesis enantioselectiva de beta-aminoácidos Sec 2.2, Eusebio Juaristi, Vadim A. Soloshonok